肝肺综合征肝移植术后严重低氧血症的处理方案
时间:2024-07-16 17:01:51 热度:37.1℃ 作者:网络

关键词
肝肺综合征,HPS,肝移植,低氧血症,临床算法,治疗策略,依前列醇,一氧化氮,亚甲蓝,肺血管栓塞,体外生命支持
肝肺综合征(HPS)是指肝病、肺内血管扩张和气体交换异常的三联征,见于10-32%的肝病患者。肝移植是HPS唯一已知的治愈方法,但患者可能发生严重的移植后低氧血症,定义为需要100%吸入氧气以维持≥ 85%的饱和度。这种并发症见于6-21%的患者,死亡率为45%。其管理需要针对HPS中潜在的生理异常应用特定的策略,但对这些策略的认识及其最佳使用的知识是有限的。我们回顾了现有文献,以确定可用于这种并发症的策略,并根据最佳证据和专家意见制定了临床管理算法。证据仅限于病例报告和病例系列,我们根据其相对成功可能性、侵入性和风险确定了算法中包含的治疗及其推荐顺序。推荐的疗法包括:特伦德伦伯卧位、吸入依前列醇或一氧化氮、亚甲蓝、异常肺血管栓塞和体外生命支持。这种实用算法的可用性和使用可能会改善这种并发症的管理,并将受益于前瞻性验证。
肝肺综合征(HPS)定义为肝病、肺内血管扩张和异常气体交换的三联症,发现在10-32%的肝硬化患者中(这种疾病与进行性低氧血症和高死亡率相关。尽管肝移植(LT)对HPS有治疗作用,但这些患者术后并发症的发生率较高。特别是,“严重的移植后低氧血症”,定义为需要100%吸入氧(FiO2)来维持饱和度≥85%(与其他任何并发的肺部疾病不成比例),已被确定为导致这一人群ICU住院时间延长和死亡的主要并发症。尽管幸存者随着时间的推移气体交换完全正常化,但严重的移植后低氧血症发生在6-21%的HPS患者中,死亡率为45%,并占这一人群中大部分围手术期死亡。文献中描述了多种尝试管理这种并发症的策略,但这些策略从未被回顾和总结,使用也不一致,这导致了对系统方法的呼声。我们试图回顾现有证据,以制定一个实用的临床管理算法,用于HPS中严重移植后低氧血症。
算法
使用HPS中严重移植后低氧血症的现有定义(需要100% FiO2来维持饱和度≥85%),我们将触发算法的阈值定为尽管有100% FiO2,饱和度<85%。我们进一步要求这些条件至少持续一个小时,并且PEEP≥10 mmHg,符合急性呼吸窘迫综合征(ARDS)中使用ECLS的现有标准。鉴于ICU患者PaO2(P)和FiO2(F)的快速变化,我们选择PF比率作为监测气体交换反应性的指标。这是ICU文献中描述低氧性呼吸衰竭严重程度的常用指标,并且以前在HPS中使用过。我们根据三个因素将治疗反应定义为PF比率变化≥20%:(1)这是最小临床相关变化的接受阈值;(2)较小的百分比变化可能是由于PaO2的简单波动,鉴于进入算法的患者的基线PaO2<65-70 mmHg(对应于<85%的饱和度);(3)PaO2均方差系数的报告最高范围为10-11%,在医学上稳定的ICU患者1小时内,20%的变化近似于2个标准差的变化(作为基线值的比例)。
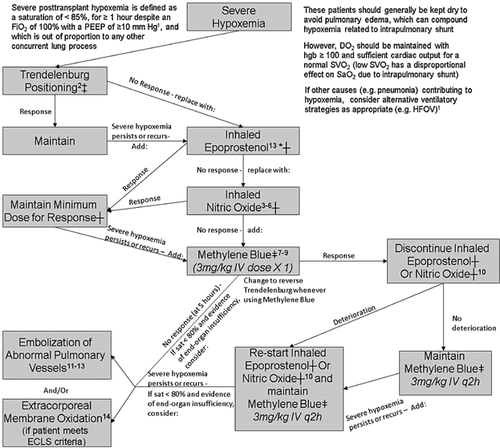
所提出的管理算法如图1所示。
图1 针对肝肺综合征患者严重移植后低氧血症的拟议管理算法。反应定义为P/F比率改善20%(和恶化P/F比率下降20%),在30分钟测量所有其他干预措施,在5小时测量甲烯蓝(MB)(MB反应最早可以在30分钟看到,但峰值效应在5小时)。‡如果在这个位置喂食,确保患者有幽门后喂养管。*如果使用高频振荡通气(HFOV),跳过这一步,直接使用吸入一氧化氮。†根据修改后的大学健康网络吸入性肺血管扩张剂政策(见支持信息1)。‡MB 3 mg/kg在50-100cc的正常盐水IV超过15分钟;改变MB的特伦德伦堡体位(如果不可能,平躺)。每3剂后暂停MB以评估持续需求。最大推荐持续时间:24-48小时(较大累积剂量的效果未知)(15.,16.)。注意:在使用MB之前,暂停任何选择性5-羟色胺再摄取抑制剂(SSRI)并等待适当的冲洗,如果使用MB(5-羟色胺毒性的风险)(17.);MB可能导致脉搏血氧饱和度假性降低(通过ABG验证氧合)。算法应根据术前测试结果的特伦德伦堡体位、吸入一氧化氮和/或IV MB进行调整,以及任何先前的肺血管造影识别可栓塞的肺血管。FiO2表示吸入氧分数;DO2表示系统氧输送;SVO2表示混合静脉血氧饱和度;HFOV表示频率振荡通气。
讨论
严重低氧血症占HPS患者接受LT后手术死亡的大多数。我们回顾了现有文献,以开发这种并发症的系统管理算法,该算法由最佳证据和专家意见提供信息。
这种并发症往往在术后早期发生(通常在LT后24小时内)。人们认为这与术后由于来自肝流出物的血管介质突然变化导致的肺血管收缩有关(10.,22.)。由于HPS血管的重塑和血管收缩受损,正常的(非扩张的)肺血管可能会不成比例地收缩,导致通过扩张的HPS血管的流量进一步增加,因此,HPS的基本扩散-灌注缺陷和通气-灌注(VQ)不匹配暂时恶化(10.)。因此,选择的治疗方法通过各种机制减少这些扩张血管的流量(表2)。治疗的总体目标是:(1)减轻早期死亡率;(2)维持氧合足够长的时间,以便预期的移植后HPS病理(和低氧血症)逆转可以开始发生。包括算法中每种治疗的理由和其他考虑如下。
纳入治疗的依据和考虑
特伦德伦堡体位
HPS中扩张的血管主要见于肺基底,特伦德伦堡体位(-10°)旨在将血流量重新分布远离这些基底肺单位。这不仅在HPS中有效,而且在非HPS患者中也有效,他们有直立性低氧血症。由于特伦德伦堡体位增加了误吸的风险,我们建议在LT时提前放置幽门后喂养管。端口吸引用于胃减压和带气囊的气管插管可能进一步降低这种风险。
吸入一氧化氮
一氧化氮被认为是HPS的主要血管舒张剂。然而,由于这些扩张的区域性质,外源性吸入一氧化氮在HPS中似乎有有益的效果。这是用于严重移植后低氧血症最广泛报道的药剂,绝大多数报告都注意到了有益的效果(表1)。吸入NO可能通过减轻上述正常血管的术后肺血管收缩。此外,通过优先扩张中上肺部的通气良好的区域的血管,它可能有效地将肺血流从负责低氧血症的扩张的基底血管转移开。中上区域血管优先扩张的原因有两个。首先,一些病理性扩张的基底血管可能已经通过重塑达到了最大扩张,因此不受NO的任何进一步扩张。其次,吸入途径优先将NO分布到已经通气良好的肺部区域。鉴于微肺不张和通气受损在肺底部更为突出,并且HPS中已经很好地描述了受损的低氧性血管收缩,避免通气不良区域可以防止由于受损的低氧性血管收缩而已经相对过度扩张的HPS血管进一步扩张。它被认为是安全的,并且高度选择性地针对肺循环,没有不良影响,包括对我们推荐剂量的全身血流动力学没有影响,并且可逆性快(111-130毫秒半衰期)。
吸入依前列醇
吸入依前列醇可能通过与吸入NO类似的机制起作用,并且同样快速和短暂,半衰期约为5分钟。尽管在HPS中吸入依前列醇的临床经验有限(表1),但在所有四个报告的HPS患者移植后成功使用。吸入治疗选择性地针对肺循环,并且有最小的不良影响。
静脉亚甲蓝
亚甲蓝是一种强效血管收缩剂,通过抑制cGMP途径发挥作用。如上所述,在肝硬化中,受损的低氧性肺血管收缩和相应的VQ不匹配最有可能在肺底部最为普遍,这是大多数肺内血管扩张(IPVDs)的发现地,并且微肺不张导致区域通气受损也更为突出。亚甲蓝可能诱导这些扩张的基底肺小动脉的血管收缩(未重塑的血管可能仍然能够血管收缩),从而改善VQ匹配。尽管这种血管收缩也可能影响正常的肺血管,但扩张的基底肺小动脉接受了更高比例的肺血流,因此接受了更高剂量的MB。鉴于其静脉给药,我们建议将患者切换到反向特伦德伦堡体位,以进一步通过重力有利于基底输送。鉴于其全身血管收缩作用和相应的可能降低心输出量,需要进行血流动力学监测,以确保任何心输出量的降低都足以被氧饱和度的改善所抵消,从而实现组织氧输送的净增加。
尽管在受控的非移植环境中,七名HPS患者使用MB后气体交换有所改善,但另一个病例报告指出,使用MB后气体交换有所恶化(可逆),移植后的经验限于一次(成功的)使用(表1)。这种患者对MB反应的变异性可能与每位患者HPS病理生理学中减少的血管张力和血管重塑的相对贡献有关。具体来说,具有肺血管重塑的患者可能不太可能对试图增加血管张力的药剂产生反应,因为与影响血管大小的血管舒张剂和血管收缩剂的不平衡相比,血管的形态学扩大更为明显。
尽管对MB大累积剂量的影响知之甚少,但病例报告表明,该治疗在我们推荐的剂量下是安全有效的。该药物在移植后也被证明是安全的,在那里它已被用于其潜在的抗炎作用。
静脉MB(亚甲蓝)和吸入血管扩张剂的联合使用
尽管只有两份报告描述了在HPS中将MB与吸入血管扩张剂联合使用,我们由于其低风险(考虑到吸入血管扩张剂是快速可逆的)和这些治疗的假设协同效应而包括了这一策略。如上所述,吸入血管扩张剂优先在通气良好的区域扩张血管,因为它们对通气不良的区域的访问有限。有了MB,我们试图在这些通气不良的区域优先诱导血管收缩,那里的HPS血管由于受损的低氧性血管收缩而不适当地扩张。当联合使用时,吸入血管扩张剂也可能减轻MB对通气良好区域的肺血管可能产生的任何血管收缩效应,从而最大化其血管收缩效应的期望异质性。这种策略的目标是将血流量重新分布,远离不适当扩张的HPS血管。由于吸入依前列醇通过cAMP而不是cGMP介导血管舒张,它不易受到MB的阻断,因此可能优于iNO,实现这种效果。
下叶肺血管栓塞
弥漫性IPVDs的栓塞疗法已被证明可以通过肺血流重新分布的机制改善HPS中的氧合。这一点得到了一个大型系列报告的支持,该报告报告了与HPS中看到的形态学相似的弥漫性、基底优势IPVDs的患者有类似的改善。然而,由于缺乏可靠的方式来预测反应,以及将严重低氧血症患者运送到透视程序套件的风险,栓塞已被包括在算法中作为“最后的手段”方法,并且访问可能限于专业中心。
体外生命支持
成人患者使用ECLS(使用静脉-静脉配置)仍然存在争议,在ECLS组织注册报告中仅占所有病例的12%。最近,Auzinger等人报告了HPS移植后低氧血症中第一例成人静脉-静脉ECLS病例。这位严重低氧血症患者(PF比率40-60)在ECLS上支持了21天,最终出院时没有补充氧气。Monsel等人描述了在一位51岁酒精性肝硬化、ARDS和肺内分流的男性中,成功使用ECLS 13天移植前和5天移植后。作为一种旨在作为恢复桥梁的支持性治疗,ECLS理论上非常适合HPS患者,因为在几乎所有LT幸存者中都发生了分流逆转和相应的气体交换改善。鉴于长时间通气的已知并发症,包括呼吸机相关性肺炎和肺损伤,早期启动ECLS是可取的,因为它可以减少通气需求并减轻终末器官低氧血症。因此,我们的算法方法寻求迅速指导临床医生通过各种治疗方法,以便在对其他治疗无反应的患者中尽早考虑ECLS。然而,HPS相关低氧血症的改善时间在患者之间高度可变,难以预测)。鉴于此以及与成人长时间ECLS相关的高风险并发症和死亡率,ECLS被建议作为“最后的手段”方法,如上所述。
治疗顺序在算法中
我们建议保持任何最初有效的治疗,并在随后的复发性低氧血症中顺序添加其他治疗。特伦德伦堡体位是算法中的第一种治疗,因为它风险低,最易于实施和逆转。我们随后使用吸入血管扩张剂,因为它们在HPS中被最广泛研究,具有快速的起效和快速可逆性。由于吸入依前列醇在危重病人中与iNO一样有效,成本更低,并且可能与MB具有更强的协同效应(如上所述),因此我们建议在iNO之前使用吸入依前列醇。如果看到组合治疗的积极效果,我们建议尝试撤回吸入血管扩张剂,以确定观察到的效果是由于MB单独还是组合。如果所有其他治疗都失败了,我们建议栓塞异常肺血管或ECLS。由于这些是侵入性、不可逆转的治疗,具有很高的并发症风险和非常有限的证据,我们建议在患者SaO2 <80%并且有终末器官功能不全的证据时,才证明这些风险是合理的。
移植前测试
我们的回顾表明,对各种治疗的反应存在变异性(表1)。这可能是由于他们管理的时机、剂量和持续时间的差异,以及与HPS病理生理学相关的患者特定因素以及任何共存的肺部疾病。以前的报告指出,基线PaO2 ≤50 mmHg和/或≥20%解剖分流的患者增加严重移植后低氧血症的风险。在这些“高风险”患者中,术前测试这些方法的反应性可能有助于预测它们的相对有效性。这些数据可以用来定制和适应每个患者的算法,积极的结果可以用来证明否则被认为风险过高的候选人的名单。
其他考虑
我们建议提前让外科麻醉团队参与,因为单独的麻醉诱导也会加重HPS患者的低氧血症,并且可能在术中考虑使用算法。血流动力学监测辅助工具可能有助于算法的最优使用。鉴于按定义,算法中的患者饱和度<85%,高血红蛋白目标也有助于保持组织氧输送。此外,受损的组织氧输送导致混合静脉血氧饱和度降低,这可能在肺内分流存在的情况下对动脉低氧血症产生不成比例的影响。最后,这些患者的同种异体功能需要特别密切的监测。尽管HPS患者即使在严重的移植后低氧血症的情况下通常也表现出良好的同种异体功能,但从理论上讲,长时间的移植后低氧血症会对同种异体功能产生负面影响。这可能会延迟肺血管异常的逆转,导致严重的低氧血症和较差的同种异体功能的恶性循环。沿着这些思路,“扩展标准”同种异体与增加的同种异体功能障碍有关,其使用必须在高风险发展严重移植后低氧血症的HPS患者中慎重考虑,逐案考虑。然而,鉴于移植后低氧血症的风险随着基线低氧血症的严重程度增加,并且HPS中的低氧血症是迅速进展的,这种风险必须与使用扩展标准器官所提供的移植等待时间的减少的好处相权衡。这是一个需要进一步研究的领域。
MELD例外点在减少这种并发症的发生率中的作用也值得一提。虽然选择的、高度专业化的中心已经证明了在非常严重的低氧血症患者中移植后良好的结果,除了移植后低氧血症的增加风险,研究表明,移植前PaO2 ≤50 mmHg的患者增加了整体移植后死亡率。这些数据,连同HPS患者PaO2每年下降5.2-13.5 mmHg的预期以及预期的移植延迟,构成了UNOS MELD例外阈值PaO2 <60 mmHg的基础。在移植等待时间通常导致这些患者PaO2下降到≤50 mmHg的中心(尽管分配了MELD例外点),可能需要更积极的优先级方法来减少这种并发症的发生率。未来的研究也应该解决从MELD例外到移植的时间长度是否独立地与移植后结果相关。
限制
我们的算法旨在用于插管患者。然而,严重的低氧血症也可能在早期拔管后发生,并且在算法中可能考虑策略以避免再次插管。以前的作者报告了这种人群中替代的通气策略,如高频振荡或喷射通气,或气道压力释放通气(APRV),但结果一直不一致。因此,我们没有讨论通气策略,也没有讨论LT接受者和插管患者的常规ICU管理问题,这些问题以前已经有很好地描述。同样,我们没有讨论管理移植后低氧血症的其他潜在贡献因素(例如肺不张、肺水肿、输血相关急性肺损伤和呼吸机相关性肺炎),这些问题在其他地方也有描述。尽管我们的搜索是系统的,但可能也存在发表偏见,倾向于报告积极结果的报告。此外,鉴于HPS的罕见性以及这种并发症只出现在接受LT的患者的一部分中,证据限于病例报告和病例系列。然而,我们能够包括27份报告和43名患者使用这些治疗的发现,我们不认为缺乏高质量证据使审查和总结这些数据以指导管理的好处无效。我们承认这个算法尚未得到前瞻性验证。然而,我们已经在中心使用这种方法,并且如上所述,已经证明了优于其他文献报道的结果。此外,我们相信,基于当前最佳证据和专家意见的算法的好处大于现状的风险,这是由于这种并发症的高死亡率、缺乏任何推荐的系统方法以及临床医生对这些策略的认识和一致使用的缺乏。
结论
严重的移植后低氧血症与HPS中的高死亡率相关。我们利用最佳证据和专家意见制定了这种并发症的实用管理算法。未来的研究应该前瞻性地测量这个算法对这一人群移植后结果的影响。


