专家论坛|孙柯:自身免疫性胰腺炎的病理学诊断
时间:2024-07-05 18:02:00 热度:37.1℃ 作者:网络
1自身免疫性胰腺炎(AIP)的诊断标准
1.1 AIP的定义和临床特征
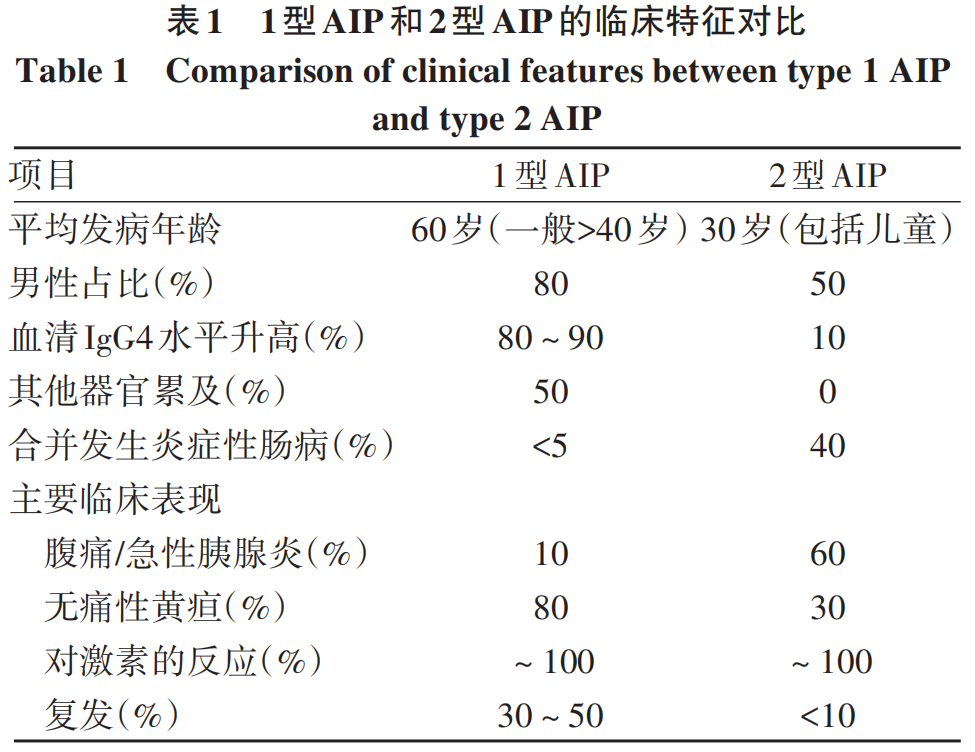
2010年国际胰腺病协会发布的国际共识诊断标准(ICDC)将AIP定义为一种特定形式的胰腺炎,其临床特征主要表现为梗阻性黄疸、伴或不伴胰腺弥漫性或局灶性肿大、组织学改变呈淋巴浆细胞浸润和纤维化,治疗上对类固醇激素有显著反应。AIP分为2个亚型:1型也称为淋巴浆细胞性硬化性胰腺炎(LPSP),是IgG4相关疾病的胰腺表现,通常伴特征性血清IgG4水平升高。临床上,IgG4相关疾病是一种系统性疾病,几乎可以影响所有器官。1型AIP、腹膜后纤维化、自身免疫性垂体炎、硬化性胆管炎、Riedel甲状腺炎和Mikulicz病是IgG4 相关疾病的最常见的表现。2型也称特发性导管中心性胰腺炎(IDCP),与IgG4无关。2型AIP不是一种系统性疾病,胰腺是唯一受影响的器官。但炎症性肠病(IBD)被认为是2型AIP患者一种潜在的胰腺外疾病,约40%病例被诊断伴有IBD(75%为溃疡性结肠炎,15%为克罗恩病,10%为未分类)。法国和比利时一项针对IBD患者的多中心研究发现,91例AIP患者中89例(98%)为2型AIP,只有2例(2%)是1型AIP,IBD通常在2型AIP发作之前或同时诊断(80%),但也可能在2型AIP诊断之后发生(20%)。尽管IBD增加了2型AIP和原发性硬化性胆管炎的发病风险,但既往文献中尚未见有描述同时患有2型AIP和原发性硬化性胆管炎的病例。虽然2型AIP和1型AIP有一些共同特点,但这两者是不同的实体,表1总结了这2种亚型AIP的临床特征。
1.2 AIP诊断标准的更新进程
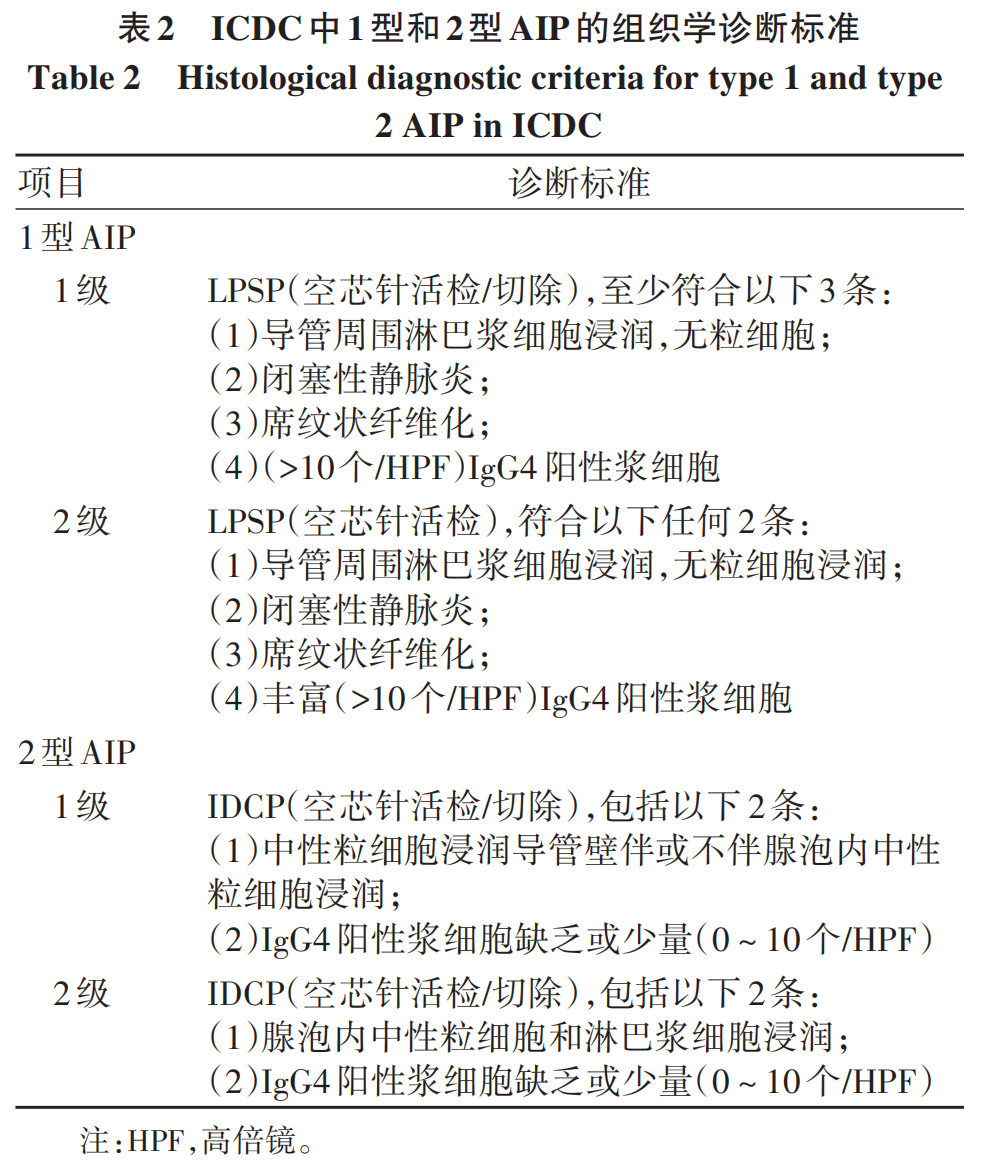
AIP的第一个诊断标准由日本胰腺学会(JPS)于2002年提出,并于2006年修订,描述包括了影像学、血清学和组织病理学因素的标准。但日本的AIP标准忽略了该疾病的其他2个基本方面:对类固醇激素治疗的明确反应和其他器官的累及。梅奥诊所提出了新的标准,确定了AIP的5个主要特征:组织学(histology)、影像学(imaging)、血清学(serology)、其他器官的受累(other organ involvement)和对类固醇激素治疗的反应(response),称为HISORt。2010年,AIP的国际共识诊断标准在各种标准的基础上制定,包括JPS(2002,2006)、HISORt(2006,2009)、Korean(2007)、Asian(2008)、Mannheim(2009)和Italian(2003,2009)。ICDC是基于胰腺实质和胰管的成像、血清学、其他器官受累情况、胰腺组织病理学和对类固醇激素治疗反应这5个方面制定的,并区分了1型和2型AIP。该标准描述了1型和2型AIP的诊断特征,并将证据强度分为2个等级:典型或高度提示AIP为1级,不确定或提示AIP为2级。ICDC目前是诊断AIP的最常用标准,在诊断这种疾病方面比以前发表的系统更有效。1型AIP通常可以在没有组织学证据的情况下进行诊断,但2型AIP需要足够的组织学标本才能做出明确诊断。特别对于影像学不典型的局灶性/节段性AIP以及血清IgG4阴性的AIP而言,组织学诊断显得尤为重要。ICDC的组织学诊断标准详见表2。
2AIP的病理学特征
2.1 1型AIP的病理学特征(经皮Trucut针/切除标本)
1型AIP组织学表现出3个特征:(1)大量浆细胞和淋巴细胞浸润,尤其是导管周围;(2)席纹状纤维化;(3)伴有淋巴浆细胞的静脉炎,受累静脉常形成闭塞性静脉炎。AIP的纤维炎症性过程累及胰腺导管、小叶、静脉和胆总管,浸润的炎症细胞由大量的小淋巴细胞和浆细胞组成,常伴随轻-中度的嗜酸性粒细胞。导管周围常出现厚袖套状淋巴浆细胞浸润伴间质反应,但导管上皮保存完好(图1a),这种现象导致了影像上主胰管特征性不规则狭窄的改变。胆总管会出现和胰管相似的改变,对应IgG4相关的硬化性胆管炎,是AIP患者出现黄疸的原因。小叶间的间质常表现出席纹状生长模式(图1b),在镜下形态上类似于隆突性皮肤纤维肉瘤中的肿瘤细胞的排列方式,但后期也可见透明(玻璃样)甚至瘢痕疙瘩(厚束的胶原)型纤维化。由于间质的硬化,胰腺小叶结构可见特别突出,不同小叶受累程度不同,胰腺腺泡萎缩消失,内分泌成分被保留,部分受累小叶间质水肿或黏液样变,炎症还可累及至胰腺周围脂肪组织,这也是影像上1型AIP肿大胰腺周围呈胶囊状边缘改变的原因。闭塞性静脉炎是指静脉管腔被致密的淋巴浆细胞浸润所闭塞,一般累及直径100 μm或更大的静脉,靠近小动脉,在HE切片中呈结节状炎症改变(图1c),有时不易识别,附近的小动脉具有提示作用,通过弹力纤维染色,可以突出这些静脉病变(图1d)。有时可能涉及较大的静脉如脾静脉甚至门静脉,在这种情况下,只有一部分静脉壁被炎症所取代。此外,还可能出现神经周围炎和动脉周围炎,偶尔也可以出现闭塞性动脉炎。在1型AIP中基本不会出现以下4种组织学改变:肉芽肿、明显的中性粒细胞浸润及微脓肿、坏死和多核巨细胞。肉芽肿的存在通常排除AIP的诊断,除非肉芽肿代表在AIP的典型背景中发生的共存病变/疾病。中性粒细胞浸润和坏死也不是1型AIP的特征,除非存在糜烂和溃疡。
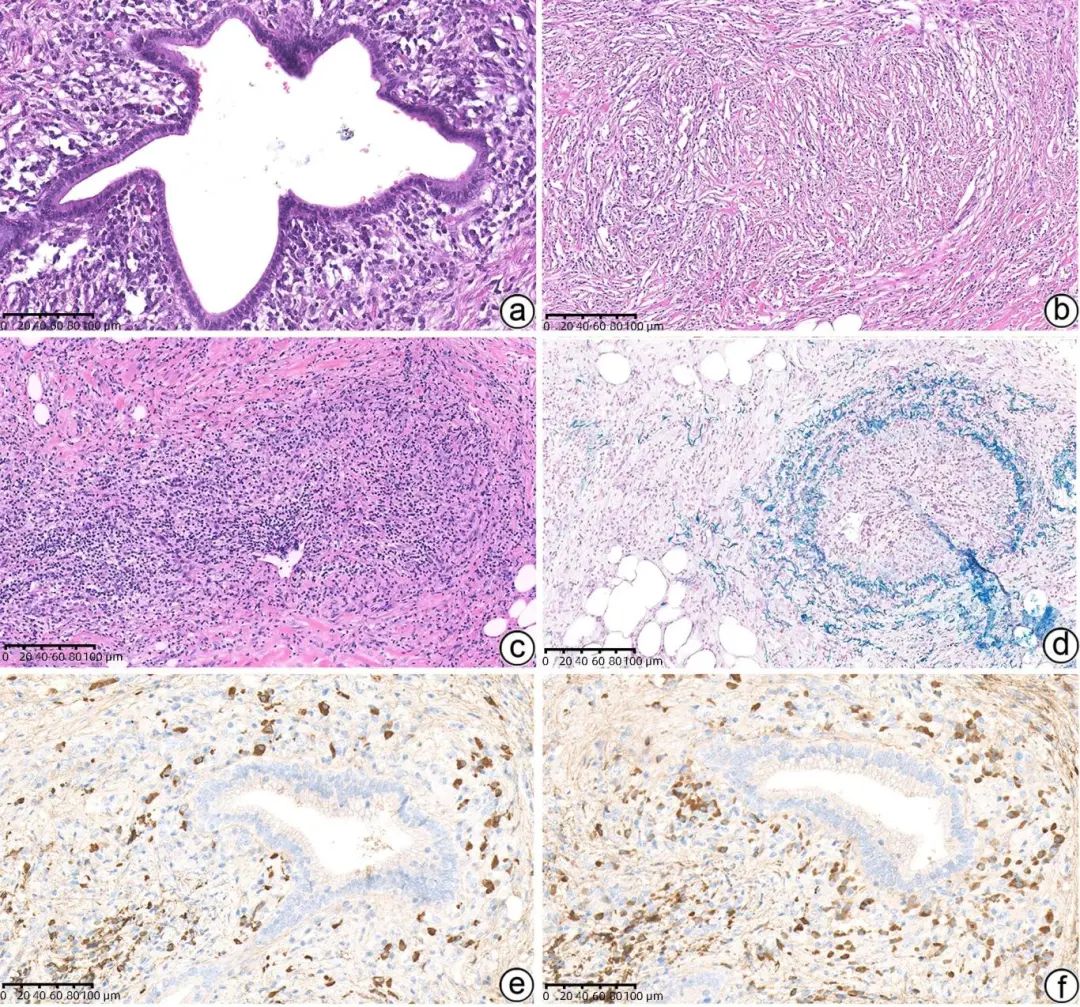
注:a,胰腺导管周围厚袖套状淋巴浆细胞浸润,导管上皮保存完好(HE染色,×200);b,席纹状纤维化(HE染色,×200);c,闭塞性静脉炎呈炎性结节样改变(HE染色,×200);d,闭塞性静脉炎(弹力纤维染色,×200);e,胰腺导管周围大量IgG4阳性的浆细胞(IgG4免疫组化染色,×200);f,胰腺导管周围大量IgG阳性的浆细胞(IgG免疫组化染色,×200)。
图1 1型AIP病理学特征
由于上述的所有组织学特征均可见于慢性胰腺炎甚至胰腺癌周围的组织,因此在考虑1型AIP这一诊断时,需将3种特征性组织学表现结合在一起才能明显提高诊断的特异性。尽管形态学特征在确定1型AIP的诊断中至关重要,但ICDC要求IgG4+浆细胞>10个/HPF作为综合诊断的一个组成部分,特别是在活检标本中。在1型AIP中,多篇文献报道IgG4+浆细胞>50个/HPF密集、弥漫性浸润具有高度特异性,目前这已是手术切除标本诊断1型AIP的条件之一。1型AIP被认为是IgG4相关疾病的胰腺表现,又被称为“IgG4相关的胰腺炎”,这类患者无论是同时还是异时出现胰腺外其他器官系统类似的改变,相关器官的组织学特征均具有惊人的相似性。在IgG4相关疾病病理学共识中,除了强调特征性病理形态和每高倍镜视野IgG4+浆细胞的绝对数外,认为IgG4+/IgG+浆细胞比例比IgG4+浆细胞/HPF计数更具意义。IgG4+浆细胞正常约占所有IgG+浆细胞的5%,但一些非IgG4相关疾病的炎症病变因富于浆细胞导致每高倍镜出现丰富的IgG4+浆细胞。据文献报道,在任何器官IgG4相关疾病中,IgG4+/IgG+浆细胞比例>40%是一个合适的临界值(图1e、f)。很多国家已经达成共识,将其作为IgG4相关疾病的组织学诊断标准之一。文献推荐计数IgG4+浆细胞/HPF是通过热点区计数3个40倍物镜视野再取平均值,同样按这个方法计数IgG4+/IgG+浆细胞的比例。临床上较小的标本里或在较大标本的边缘,容易出现浆细胞被挤压而破裂,引起IgG4和IgG免疫组化的背景染色明显,有可能导致IgG4和IgG+浆细胞被低估,因此有学者提出在IgG4染色的切片中评估IgG4阳性和阴性浆细胞比例,IgG4相关疾病通常这一比例>1,以此解决该问题。
当考虑诊断为1型AIP或IgG4相关硬化性胆管炎时,壶腹活检可见固有层内显著的IgG4+浆细胞浸润。虽然这一特征可能对IgG4相关疾病并非高度敏感和特异,但在适当的临床背景下,可以为这一诊断提供支持。
2.2 EUS-FNA/B标本诊断1型AIP
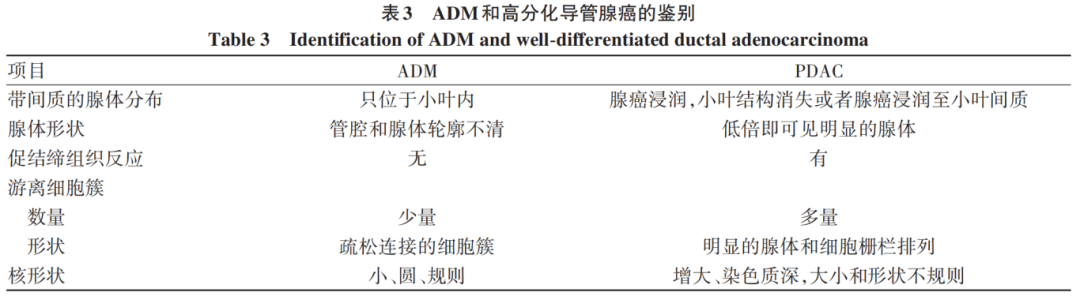
最初EUS-FNA被认为无法获得足够的组织用以诊断AIP,近年来随着技术的发展,越来越多的文献阐述了EUS-FNA/B在AIP组织学诊断中的应用。但目前通过EUS-FNA/B组织学诊断1型AIP的文献报道结果差异明显。1型AIP的组织学表现具有以下5个特征:(1)弥漫性淋巴浆细胞浸润和纤维化,(2)大量IgG4+浆细胞,(3)席纹状纤维化,(4)闭塞性静脉炎,(5)导管周围淋巴浆细胞浸润。不同的诊断标准采用的组织学特征稍有不同。ICDC采用特征(2)~(5),而JPS(2011,2018)采用了特征(1)~(4)。ICDC标准和JPS(2011,2018)标准中均提出,当识别出3个或更多特征时,1型AIP可通过组织学诊断。由于特征(1)和(2)相对容易识别,因此特征(3)~(5)是对1型AIP进行明确组织学诊断的关键发现。Notohara等总结发现,在EUS-FNA/B标本中席纹状纤维化的识别率0~86%,闭塞性静脉炎的识别率0~70%。出现这些巨大数据差异的可能原因如下:首先,尽管研究是基于ICDC,但在大多数研究中使用了组织学特征(1)~(4),而不是(2)~(5)。有一项研究基于特征(2)~(5),该研究中组织学明确诊断为1型AIP的病例比例极低(19%)。其次,在一些研究中,计数IgG4+浆细胞是对所有高倍镜视野进行的平均值评估,而在其他研究中,IgG4+浆细胞/HPF是对热点区进行计数。第三,正如Yoon等所指出的,使不使用弹力纤维染色对闭塞性静脉炎的检出率影响很大。活检标本如果不予弹力纤维染色,闭塞性静脉炎几乎无法识别。Notohara等通过全国多中心的回顾性研究,收集了85例临床已经证实的非肿瘤性胰腺疾病的FNB样本(允许多次穿刺),要求对HE染色中所有组织碎片长度>0.5 mm且宽度≥0.1 mm的区域进行测量,结果组织的中位长度为7 mm,52例(61.2%)>5 mm。席纹状纤维化、闭塞性静脉炎和导管病变的发生率分别为37.6%、28.2%和22.4%,>10个IgG4+浆细胞/HPF的发生率为85.9%。基于JPS 2011的组织学标准,组织学确定诊断(满足3个或更多特征)和可能诊断(满足2个特征)1型AIP的分别为39例(45.9%)和35例(41.2%)。而按ICDC组织学诊断标准分别仅有22例(25.9%)和23例(27.1%)病例符合的1级(确定)和2级(可能)。通过以上研究,Notohara等提出通过EUS-FNA/B获取大组织样本(>5 mm),可以减少因组织小挤压导致IgG4+浆细胞破裂引起的背景染色,从而使IgG4免疫组化染色更成功,也能更多地识别席纹状纤维化、闭塞性静脉炎和1型AIP导管病变。因此,获取足够数量的组织对1型AIP的活检诊断很重要。1型AIP病变的活检组织的数据分析应基于样本量,而非FNA和FNB之间的简单比较,有研究甚至通过EUS-FNA获得了足够的样本进行诊断。为了促进AIP活检诊断的标准化和准确性,在日本胃肠病学家和病理学家的参与下,Notohara等基于JPS2018制定了活检组织诊断活动性1型AIP的共识指南。为了更精准地诊断1型AIP,共识强调了每个组织学特征的定义和细节:(1)除IgG4+浆细胞>10个/HPF外,还提出“IgG4+浆细胞弥漫性浸润(定义为多灶>10个IgG4+浆细胞/HPF)”和“IgG4+/IgG+浆细胞比率增加(>40%)”也是1型AIP诊断的附加特征,当这些附加特征不存在时,必须谨慎诊断;(2)席纹状纤维化定义为富含梭形细胞和炎细胞的成分在纤细的胶原纤维背景中流水状排列。席纹状纤维化中观察到的梭形细胞小于典型肉芽组织中的肌纤维母细胞。炎症细胞呈弥漫而非局灶性。但即使存在厚而致密的嗜酸性胶原束,只要能识别出一灶典型特征,也被视为席纹状纤维化。共识强调,只有具有丰富细胞成分的病变才被定义为席纹状纤维化,重点是为了增加活检诊断的特异性;(3)闭塞性静脉炎指由1型AIP的特征性炎症变化引起的阻塞性或狭窄性静脉病变。纤维化和炎症细胞浸润是诊断是必要的,以区分闭塞性静脉炎和慢性胰腺炎或胰腺癌中的纤维性静脉闭塞。强调必须用弹力纤维染色来识别闭塞性静脉炎。胰腺导管周围也存在多层弹力纤维层,需要和静脉鉴别。1型AIP导管上皮通常出现在活检标本的边缘,活检组织中常不存在,因此共识提出导管病变不适合作为活检标本的关键发现。活检组织最困难的是与高分化导管腺癌的鉴别。分化良好的胰腺导管腺癌(PDAC)通常显示出微小的异型性,因此非典型腺体出现在AIP中,可能被误解为分化良好的PDAC,特别是腺泡导管化生(ADM)常会和高分化PDAC混淆,鉴别见表3。小叶中导管样化生上皮增加的现象被称为管状复合体或ADM。ADM定位于小叶中,是管腔和轮廓模糊的腺体,但细胞核小、圆、规则。在1型AIP,由于炎症细胞浸润和纤维化组成的背景基质类似于PDAC中的基质,使得ADM和高分化PDAC鉴别更加困难。除了AIP,ADM也可存在于由癌症和其他病因引起的急性胰腺炎、慢性胰腺炎、2型AIP和阻塞性胰腺炎中。
2.3 2型AIP的病理学特征(经皮Trucut针/切除标本)
2型AIP最主要的组织学特征是粒细胞上皮病变(GEL)。GEL是指胰腺内中等导管和小导管上皮内中性粒细胞浸润,通常导致管腔上皮的破坏和溃疡,以及中性粒细胞性脓肿形成(图2a),类似IBD中的隐窝脓肿,一些病例显示中性粒细胞浸润小叶腺泡和ADM(图2b)。尽管导管周围淋巴浆细胞浸润见于2种形式的AIP,但大多数情况下,1型AIP中3个特征性组织学改变在2型AIP中均很少见。在2型AIP中,导管周围的炎症比小叶炎症更明显,而1型表现为以小叶为中心的损伤模式。这种差异可能是2型AIP在影像中胰腺周围很少显示胶囊状边缘的原因之一。观察到GEL时一定要注意背景,因为孤立的GEL改变也可出现在肿瘤周围以及梗阻性胰腺炎中。2型AIP的另一个显著特征是IgG4+浆细胞的少量存在(<10个/HPF)或完全缺如。同样,2型AIP中IgG4+/IgG+浆细胞的比例<40%。1型AIP的诊断无须活检即可确定,但2型AIP的确诊通常需要组织确认存在GEL改变。如果没有组织学证据且没有IBD病史的患者表现出典型的AIP影像学特征和对类固醇激素良好反应,可以确定为AIP,但不能诊断为2型AIP。
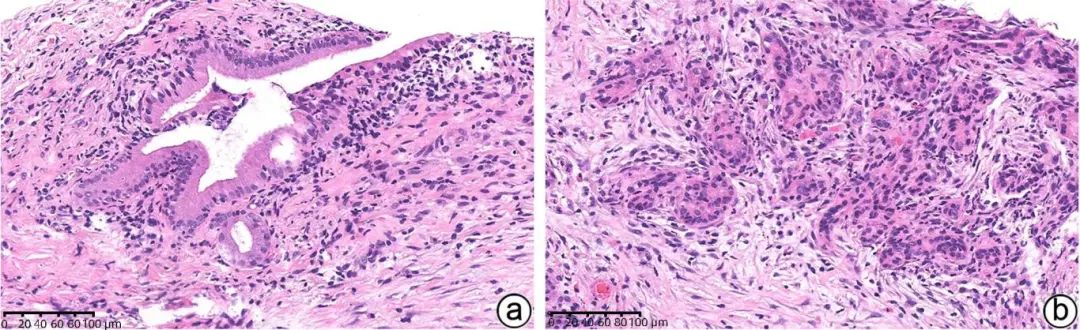
注:a,中性粒细胞浸润导管上皮,管腔内脓肿形成(粒细胞上皮病变);b,经皮胰腺穿刺组织中性粒细胞浸润导管上皮(粒细胞上皮病变);c,经皮胰腺穿刺组织胰腺腺泡导管化生伴多量中性粒细胞浸润。
图2 2型AIP病理学特征(HE染色,×200)
2.4 EUS-FNA/B标本诊断2型AIP
ICDC中明确,当组织中存在1处或多处GEL且IgG4+浆细胞<10/HPF时,可明确2型AIP诊断,但通过活检不易获得真正的导管,因此难以基于活检组织进行2型AIP的诊断。在活检组织中,小叶中出现具有中性粒细胞浸润的ADM是特征性表现,但非特异性表现,可将其视为ICDC中2型AIP的2级发现。日本学者曾报道10例可疑2型AIP的患者,通过EUS-FNA/B获取了足够的组织,组织>10个HPF(1个HPF相当于500 μm左右)的8例,根据ICDC标准,4例组织学表现对应ICDC的1级,5例对应2级。值得注意的是,在1型AIP中也可见具有少量中性粒细胞浸润的ADM,因此在活检组织中观察到这一现象时,应该仔细区分1型还是2型AIP。
3AIP的鉴别诊断
1型AIP和2型AIP的组织学诊断对比详见表4。前述的1型AIP特征性组织学改变主要出现在急性或亚急性期,到慢性期炎症退缩,纤维化进展,对诊断的挑战加剧。因此,对病理医生而言,熟悉1型AIP的显微镜下进展非常重要。2型AIP的临床常表现为急性胰腺炎,以及和IBD关系密切,但在IBD患者发展为急性胰腺炎时,还需要排除胆石症和药物(如美沙拉嗪和硫唑嘌呤)引起的急性胰腺炎,在Hart等报道的2型AIP中,2/3患者出现急性胰腺炎的表现,但经过临床处理后大多数患者胰腺仍弥漫或局灶性肿大,胰腺的这种动态实质变化可用于区分无血清特异性标志物的2型AIP和特发性急性胰腺炎。最近免疫检测点抑制剂相关的胰腺炎被称为3型AIP,是基于免疫耐受紊乱引发自身免疫反应是潜在病理生理机制这一假设提出的。3型AIP呈现胰酶无症状升高或临床胰腺炎,胰腺表现为弥漫性或局灶性肿大。3型AIP诊断相对简单,主要与免疫检查点抑制剂的使用时间有关,同时缺乏引起急性胰腺炎的其他病因,这类实际上可能归属于特殊类型的药物性胰腺炎。

4小结
上文主要阐述了AIP 2种亚型的临床及组织病理学特征,并总结了近期日本专家提出的通过EUS-FNA/B诊断1型活动性AIP的共识,尽管使用EUS-FNA/B获得足够量活检标本后对AIP进行组织学诊断是可行的,但需要临床、放射和病理多学科合作进行鉴别诊断,需要在临床和影像学基础上进行最终诊断,单独的活检组织可能不足以诊断AIP和区分AIP与PDAC。此外,2型AIP需要通过组织学诊断,目前亚洲报道的2型AIP病例数量很少,但病理医师也需要充分认识这类罕见亚型,才能正确指导临床治疗。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240606



