西湖大学最新Nature Aging: 母亲年龄增强了哺乳动物mtDNA复合体I基因致病性突变的纯化选择
时间:2024-08-05 15:02:45 热度:37.1℃ 作者:网络
线粒体疾病主要由线粒体DNA(mtDNA)突变引起,因缺乏有效治疗手段而成为重大挑战。研究线粒体疾病的母系传递模式可为预防措施铺平道路。这些疾病的复杂性和多样性源于mtDNA的独特遗传方式,传统治疗手段难以有效解决。深入理解母系传递模式有助于识别高风险个体,从而开发出针对性的预防策略和治疗方法。这不仅可以提高诊断的准确性,还能在遗传咨询中为患者和家庭提供更好的指导和支持。
在这项研究中,西湖大学蒋敏团队利用DddA衍生的胞嘧啶碱基编辑器(DdCBEs)生成了两种小鼠模型,分别携带复合I基因(ND1和ND5)的致病突变,模拟人类患者的突变。结果显示,两种突变在母系传递过程中受到强烈的净化选择,主要发生在出生后卵母细胞成熟过程中,蛋白质合成增加起重要作用。有趣的是,作者发现母体年龄增加强化了净化选择,表明较高的母体年龄可能对传递有害的mtDNA突变具有保护作用,这与传统认为的母体年龄与传递的mtDNA突变增加相关的观念相矛盾。收集全面的临床数据以了解人类中母体年龄与传递模式的关系是必要的,作者的发现可能对线粒体疾病,尤其是涉及复合I基因突变的生殖咨询具有深远影响。该研究以题为“Maternal age enhances purifying selection on pathogenic mutations in complex I genes of mammalian mtDNA”的论文发表在最新一期《Nature Aging》上。

线粒体是细胞和重要信号枢纽的动力室,拥有自己的基因组(mtDNA),由37个基因组成,包括两个线粒体核糖体RNA,22个mt-tRNA和11个mt-mRNA(两个是双顺反子),编码13种蛋白质,这些蛋白质是氧化磷酸化(OXPHOS)系统的核心亚基。线粒体DNA中的致病性突变可导致线粒体疾病,患病率约为5000分之一。患有此类疾病的患者通常表现出mtDNA的异质性,其中野生型和突变型mtDNA共存于单个细胞内。mtDNA中的大多数突变是在mtDNA复制过程中出现的错误,并且一旦形成,它们可能会通过母体传播影响多代人。目前,已证实约100种mtDNA突变导致线粒体疾病(https://www.mitomap.org/MITOMAP)。然而,这些突变的临床发生率存在很大差异。只有少数特定部位表现出较高的频率,大多数部位在临床上相对罕见。这些致病性突变的母体传播模式仍不清楚。
为了研究复合物I基因中mtDNA突变引起的线粒体疾病的传播模式,作者采用DdCBE技术生成两种小鼠模型,每种模型在复合物I基因(ND1和ND5)中携带单点突变。研究结果显示,这些突变在卵母细胞成熟过程中受到纯化选择的抑制,防止致病突变体传递到后代。随着母亲年龄的增加,纯化选择增强,可能具有保护作用。这一发现挑战了传统观点,对临床生殖咨询和线粒体疾病的研究具有重要意义。
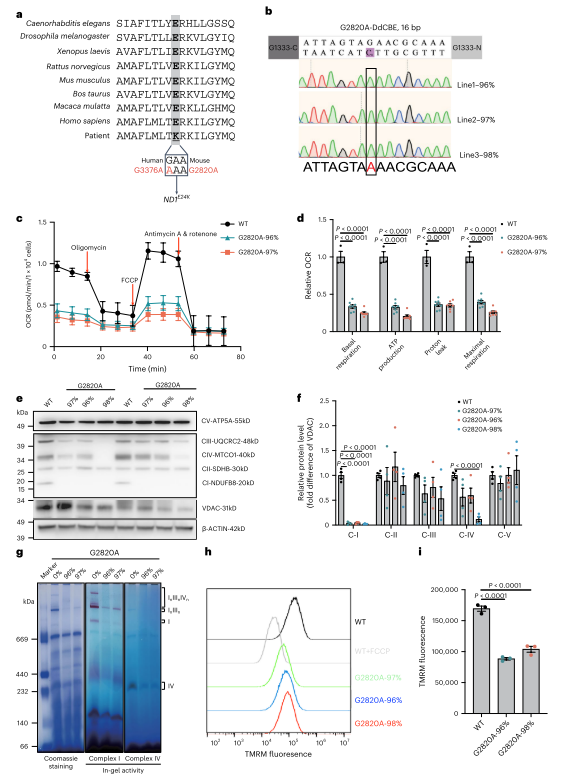
图1. 小鼠mtDNA 2820 G > A突变导致线粒体功能障碍
接下来,为了构建G2820A突变小鼠模型,作者使用DdCBE方法对受精卵进行编辑,并将胚胎移植到假妊娠小鼠中。实验确定250 ng/µl为最佳mRNA注射浓度,突变负荷最高达66.3%。全基因组测序显示无显著脱靶效应。突变小鼠不同器官和血液中突变负荷一致,但T细胞突变率略低。母体年龄增加时纯化选择增强,ND1突变幼崽减少。实验成功获得ND1 E24K(G2820A)突变小鼠模型,并发现随母体年龄增长的强纯化选择。
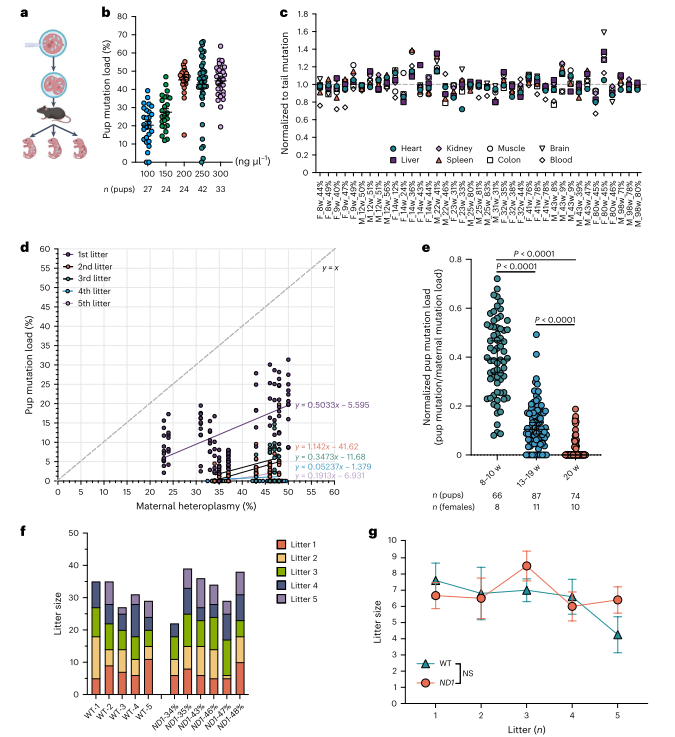
图2. 年龄增强m.2820 G > A mtDNA在传递过程中的纯化选择
同时由于幼鼠mtDNA突变量随母体年龄增加而降低,作者进一步研究了这一选择过程在成熟卵母细胞中的表现。结果显示,M2卵母细胞中的突变负荷与后代中突变负荷呈相似趋势,突变负荷随母体年龄增加显著降低。即使在不同世代的雌性中,这种选择也存在。ND1突变严重损害卵母细胞线粒体功能,但在雄性生殖系中没有类似的选择,雄性精子负荷范围广泛,不影响生育力。总而言之,母体年龄增强的选择仅在雌性生殖系中发生。
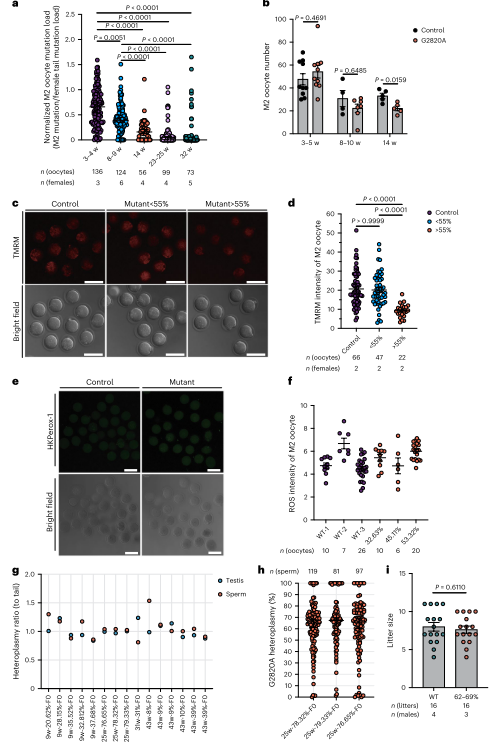
图3. M2卵母细胞对m.2820 G > A突变表现出年龄增强的纯化选择
在哺乳动物中,卵母细胞在出生后通过多个卵泡阶段成熟。为研究卵泡发育中母体年龄增强选择的确切阶段及其机制,作者分析了不同年龄雌鼠的各阶段卵母细胞突变负荷。结果显示,突变选择发生在原始卵泡阶段之后的窦卵泡阶段,并在减数分裂I完成前结束。这种选择不受卵母细胞闭锁驱动,而是在细胞器水平上发生。整体而言,纯化选择在出生后卵母细胞成熟过程中进行,并随母体年龄增加显著增强。在性成熟后的卵母细胞成熟过程中,针对ND1突变存在强选择压力,导致下一代中突变mtDNA水平较低(小于母亲尾部突变负荷的50%)。通过交配和辅助生殖技术(ART),高突变负荷的卵母细胞能传递给后代,但仍存在选择限制。对剩余受精卵进行第二轮DdCBE编辑,可进一步提高幼崽突变负荷,最高达82.9%。这表明ART结合DdCBE编辑可以有效维持和增加突变负荷水平。
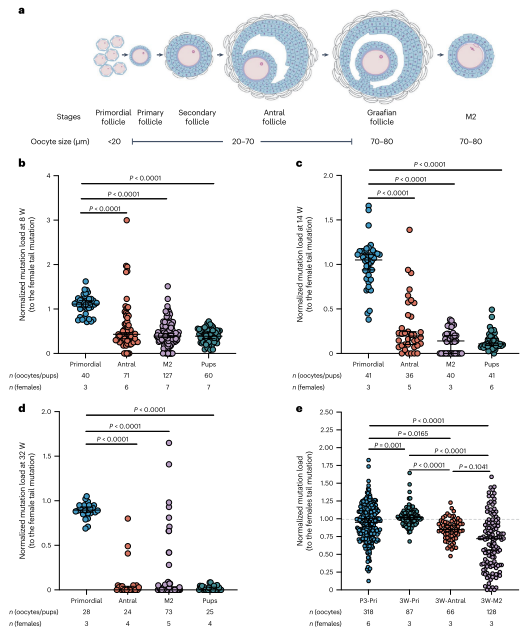
图4. 在卵母细胞成熟过程中,对m.2820 G > A进行了增强的纯化选择
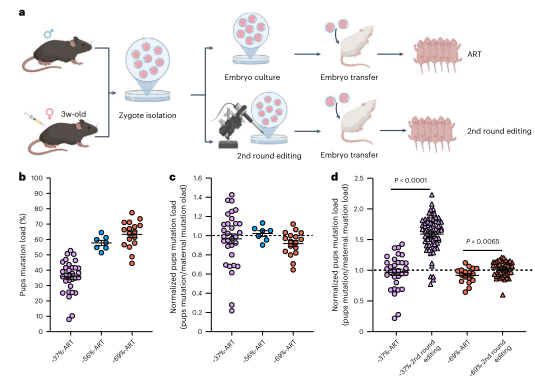
图5. 来自年轻小鼠的成熟卵母细胞中的高ND1突变可以传递给下一代
为研究线粒体复合物I基因中其他突变的选择过程,作者生成了ND5基因突变小鼠。ND 5编码复合物I膜部分亚基。通过类似的编辑技术,获得了不同突变负荷的ND 5小鼠。突变负荷高的细胞系表现出OCR降低和MMP下降。ND5突变小鼠显示出弱于ND 1突变小鼠的年龄增强选择,选择在母鼠22-23周龄时开始。通过多代观察,选择强度一致,表明选择源于突变致病性,而非核脱靶效应。同时在次级卵泡中,ND1和ND5突变的纯化选择主要由细胞器水平的选择驱动。为了研究ND1突变体卵母细胞中的分子变化,作者使用了Stereo-seq技术,对卵巢切片进行转录组检测。结果显示ND1突变导致发育中卵母细胞内的翻译显著增加,特别是细胞质和线粒体的核糖体相关基因表达增加。ND1突变体中与凋亡相关的分子变化也上调。此外,免疫荧光染色表明ND 1突变增强了mTORC 1通路调节的翻译活性。
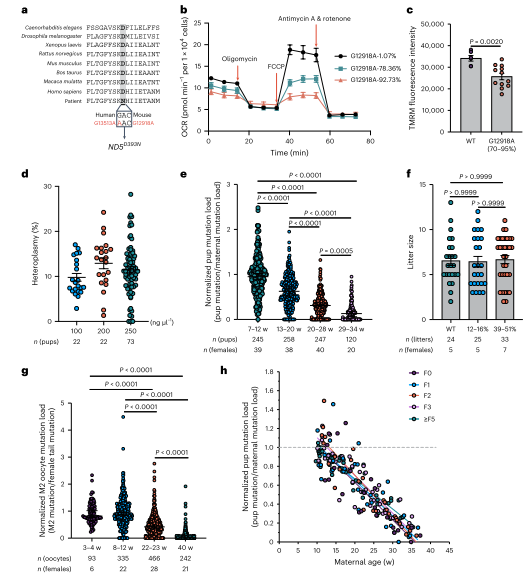
图6. 年龄增强了对小鼠ND 5 12918 G > A突变在传递过程中的纯化选择
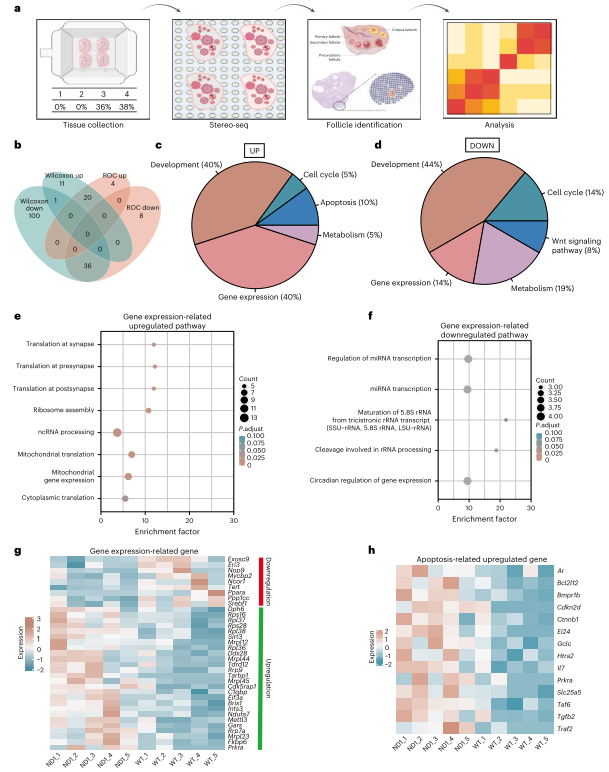
图7. 空间转录组学研究ND1突变雌性卵母细胞蛋白质合成增强
最后,作者在ND1突变卵母细胞中观察到蛋白质翻译增加,假设这在突变纯化选择中起作用。作者通过雷帕霉素腹腔注射抑制mTORC 1途径,研究发现长期翻译抑制降低了纯化选择强度,而短期抑制无显著影响。结果表明,增强的蛋白质翻译在mtDNA突变的纯化选择中起关键作用。同时,研究表明线粒体自噬在ND 1突变清除中并不重要,主要由蛋白质翻译驱动。
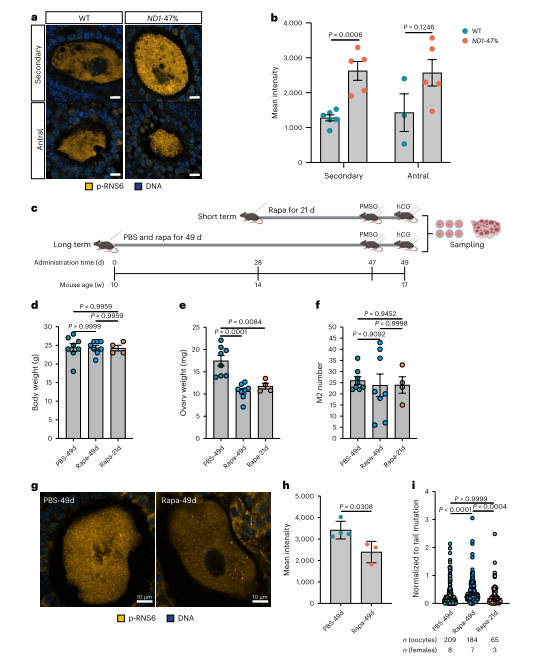
图8. ND1突变体卵母细胞蛋白质翻译增强驱动纯化选择
综上所述,作者的研究表明,强烈的纯化选择影响了两种携带导致人类线粒体疾病的同源突变的mtDNA复合物I基因小鼠模型的传递模式。此外,作者发现母体年龄进一步增强了这一选择过程。作者还确定,这种选择发生在出生后卵母细胞成熟期间,增加的蛋白质合成在这一过程中起到了重要作用。这些发现为理解人类线粒体疾病的传递模式及母体年龄对线粒体疾病中致病性突变选择和预防的影响提供了重要见解。
原文链接:
https://doi.org/10.1038/s43587-024-00672-6


