Ann. Oncol : IMpassion132 III期试验:化疗伴或不伴阿替利珠单抗治疗早期复发的不可切除局部晚期或转移性三阴性乳腺癌
时间:2024-07-12 13:00:20 热度:37.1℃ 作者:网络
早期三阴性乳腺癌 (eTNBC) 是一种预后较差的乳腺癌亚型,其特征是缺乏雌激素受体 (ER)、孕激素受体 (PR) 和人类表皮生长因子受体 2 (HER2) 表达,传统的治疗方法包括含蒽环类或紫杉烷的化疗,但治疗效果有限,且容易复发,早期复发是指患者在完成 eTNBC 的标准治疗(化疗或手术)后 12 个月内出现复发,早期复发的 eTNBC 患者预后更差,治疗选择有限,临床需求迫切,免疫检查点抑制剂,如阿替利珠单抗,已被证明可以改善 PD-L1 阳性晚期三阴性乳腺癌 (aTNBC) 患者的预后,然而,针对早期复发 eTNBC 的随机数据仍然有限,且大多数临床试验都排除了这部分患者,IMpassion132 试验是一项针对早期复发 aTNBC 患者的随机、双盲、安慰剂对照、多中心、III 期临床试验,该试验旨在评估阿替利珠单抗联合化疗的疗效和安全性。
方法
这是一项国际、双盲、安慰剂对照、多中心、III 期临床试验,纳入了年龄 ≥ 18 岁,ECOG 体能状态 0 或 1,并具有良好的血液学和内脏器官功能,接受过 eTNBC 的含蒽环类或紫杉烷的辅助化疗或新辅助化疗,不可切除的局部或远处复发 TNBC,距离 eTNBC 的最后一次治疗(化疗或手术)不到 12 个月,患者按照1:1的比例随机分配至安慰剂组或阿替利珠单抗组。安慰剂组:每 21 天接受安慰剂治疗,直至疾病进展、出现不可接受的毒性或患者/医生撤回;阿替利珠单抗组:每 21 天接受 1200 mg 阿替利珠单抗治疗,直至疾病进展、出现不可接受的毒性或患者/医生撤回,主要终点为总生存期 (OS),次要终点为无进展生存期 (PFS)、客观缓解率 (ORR)、安全性。

研究结果
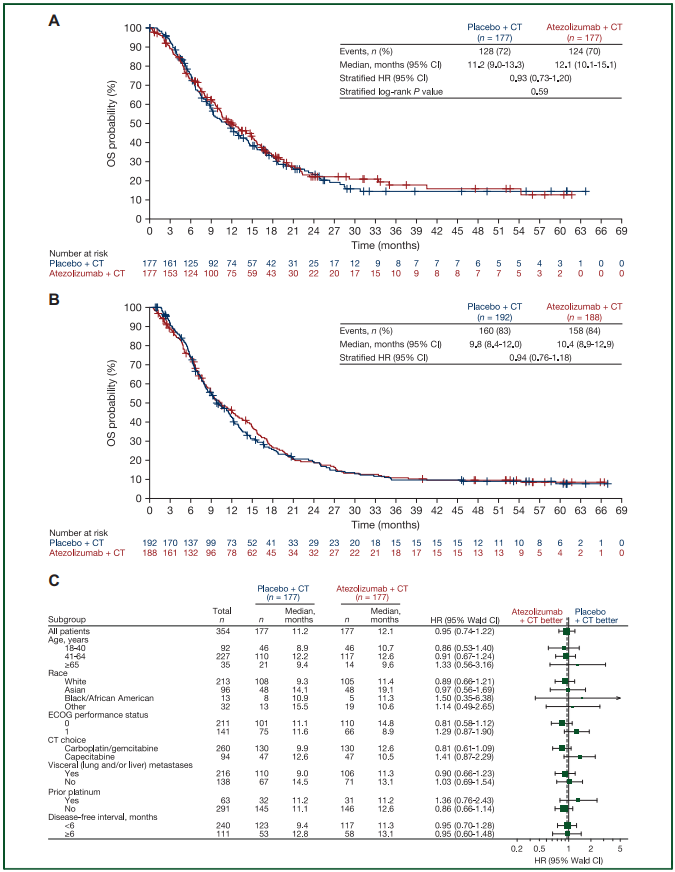
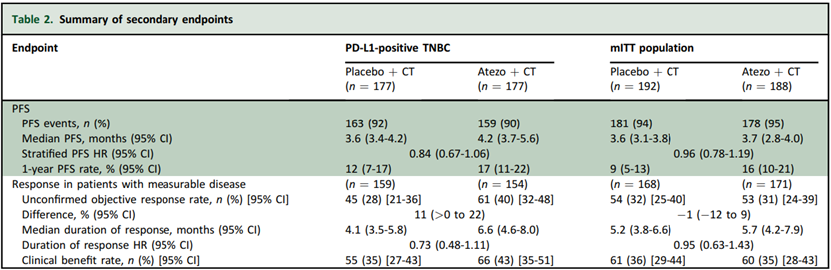
在 PD-L1 阳性 aTNBC 患者中,阿替利珠单抗联合化疗组的中位 OS 为 12.1 个月,安慰剂组为 11.2 个月 (HR 0.93, 95% CI 0.73-1.20, P=0.59),mITT 人群的分析结果与 PD-L1 阳性 aTNBC 患者一致,阿替利珠单抗并未显著改善 OS,两组患者的 PFS 中位数均为约 4 个月,安慰剂组的ORR为 28%,阿替利珠单抗组ORR为 40%。
安全性分析
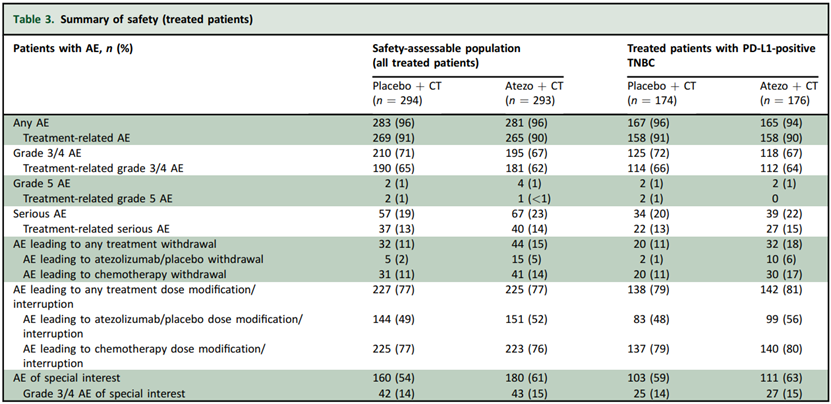
两组患者的安全性事件发生率相似,两组患者最常见的 AE 是血液学毒性和胃肠道反应,包括贫血、中性粒细胞减少、恶心、呕吐和肝酶升高,阿替利珠单抗组免疫介导的皮疹、甲状腺功能减退和甲状腺功能亢进的发生率更高,但 3/4 级免疫介导的安全性事件发生率相似。阿替利珠单抗联合化疗的安全性特征与已知的单药阿替利珠单抗或化疗的安全性特征一致,阿替利珠单抗的安全性事件可控,且未发现新的或意外的安全性信号。
结论
阿替利珠单抗联合化疗并未显著改善早期复发 aTNBC 患者的 OS,该研究结果对早期复发 aTNBC 患者的治疗提出了挑战,需要进一步探索新的治疗策略,例如肿瘤微环境调节剂或更有效的化疗方案与免疫检查点抑制剂的联合使用。
原始出处
Dent R, et al. 2024. IMpassion132 double-blind randomised phase III trial of chemotherapy with or without atezolizumab for early relapsing unresectable locally advanced or metastatic triple-negative breast cancer. Annals of Oncology 35:630-642.


