【衡道丨病例】轻松学病理——1例罕见乳腺转移性透明细胞肾细胞癌
时间:2024-07-17 16:03:24 热度:37.1℃ 作者:网络
超声引导下空心针穿刺活检在乳腺肿瘤诊断中具有非常重要的作用,通常情况下诊断还是相对简单明了的。但是由于取材的局限性,像乳头状病变、囊内病变、包裹性病变、叶状肿瘤、腺肌上皮肿瘤以及乳腺转移性肿瘤的诊断具有巨大挑战性,尤其是乳腺转移性肿瘤非常少见,在临床影像学及病史不完善的情况下,正确判断是乳腺原发还是转移性肿瘤是很有难度的。
本次由山东省聊城市人民医院病理科安风仙老师就通过1例罕见的乳腺转移性癌,带领病理萌新们一起,学习乳腺转移性肿瘤的诊断及鉴别诊断。
病例详情
简单病例资料:
患者,女性,56岁,乳腺包块待查。
临床行B超引导下空心针穿刺活检,送病理来明确肿瘤类型。
大体:
(乳腺包块穿刺活检)灰白组织两条,长0.7-1cm,直径0.1cm,全。
微观世界:
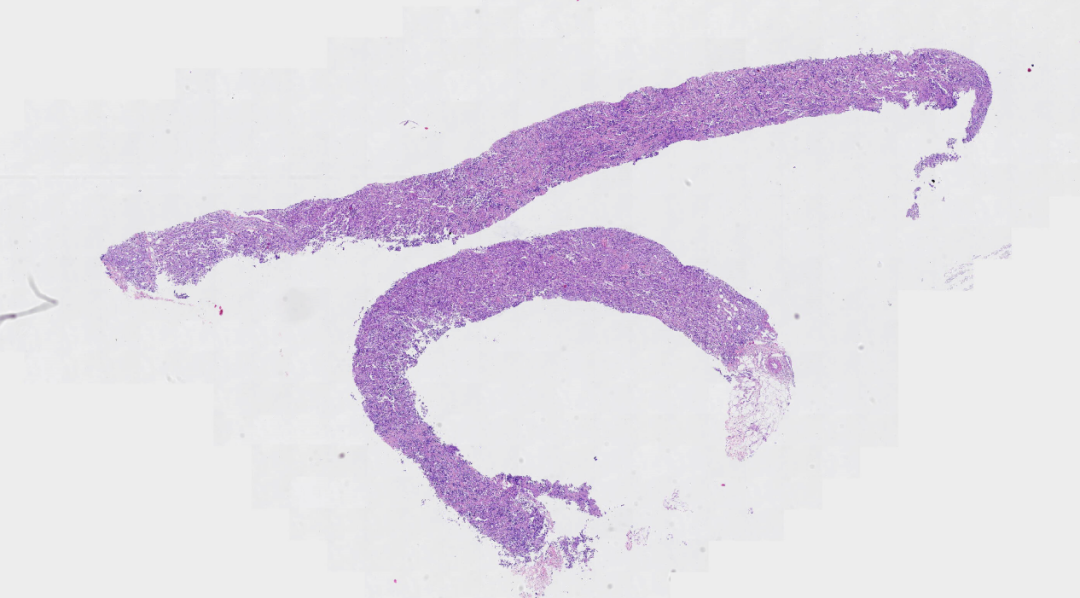
图1.低倍镜下穿刺组织2条,未见乳腺小叶及导管结构
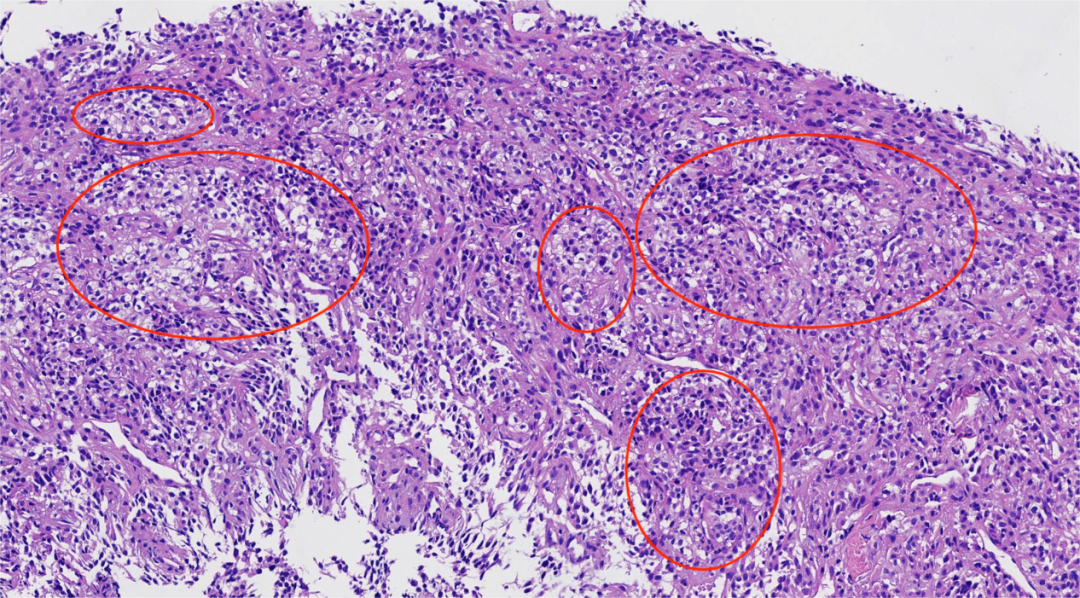
图2.肿瘤细胞呈大、小不一的巢团或片状排列
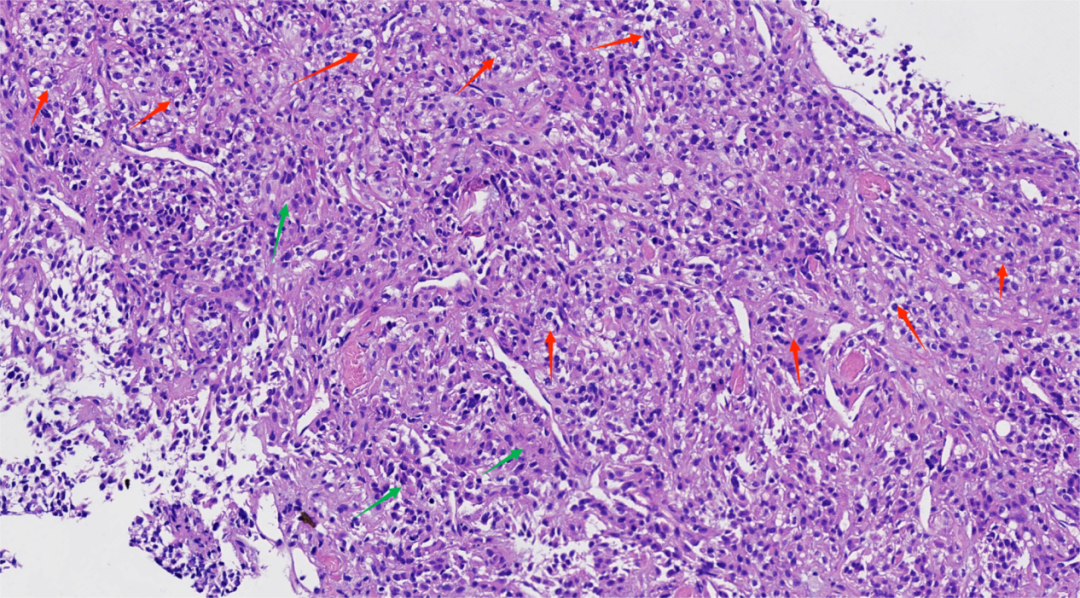
图3.肿瘤细胞形态较温和,胞浆透明(红箭头)或嗜酸染色(绿箭头)
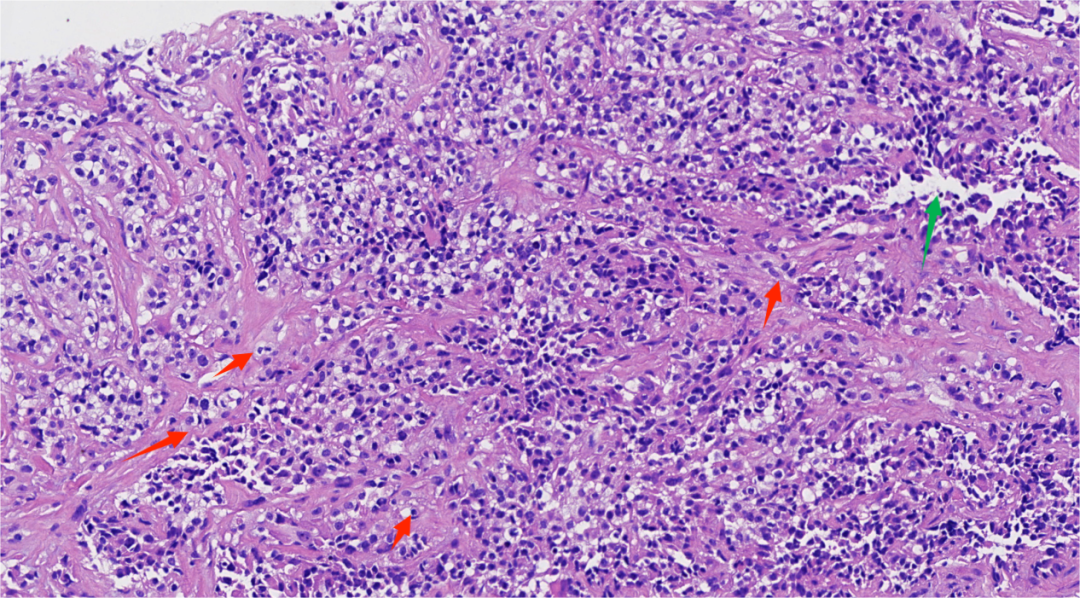
图4.肿瘤细胞形态温和,主要呈片状排列,还可见到单个或簇状(红箭头)及假腺样排列(绿箭头)
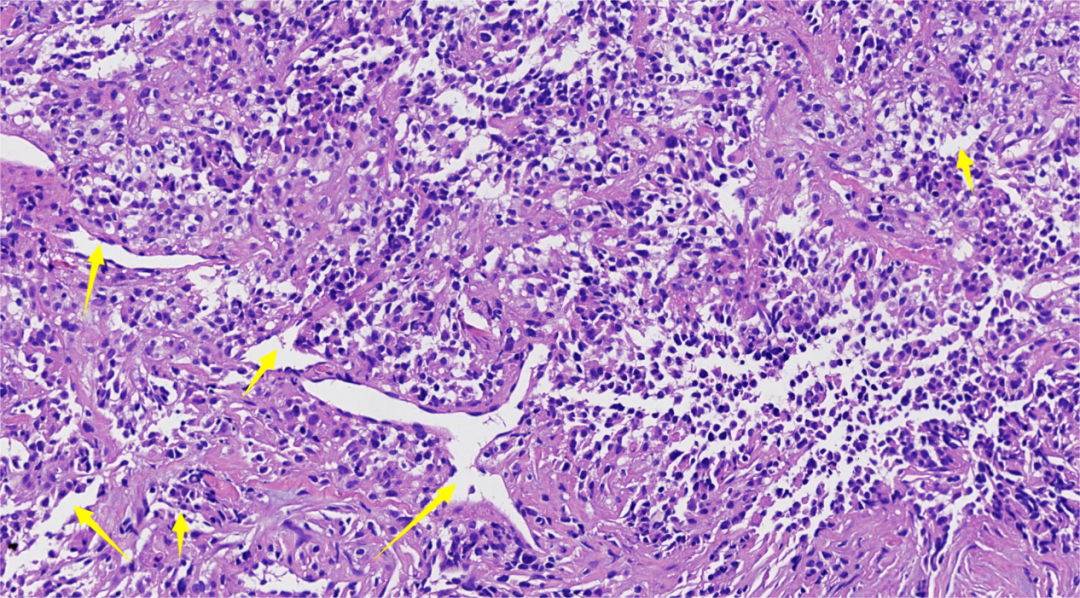
图5.仔细观察,肿瘤间见丰富薄壁分支血管
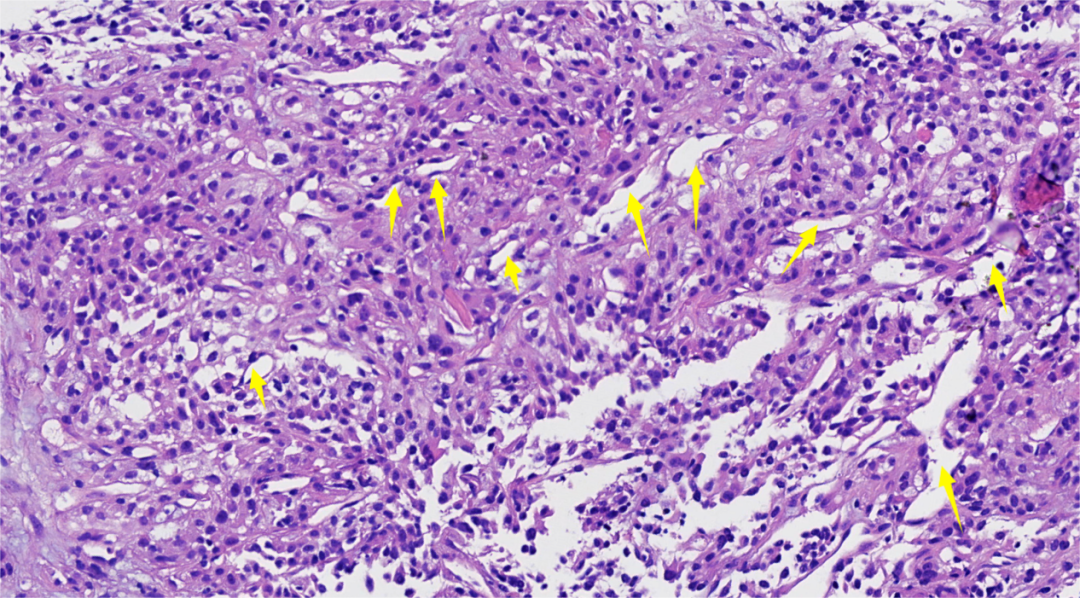
图6.胞浆透明及嗜酸的肿瘤细胞,形态较温和,间质内易见分支薄壁血管
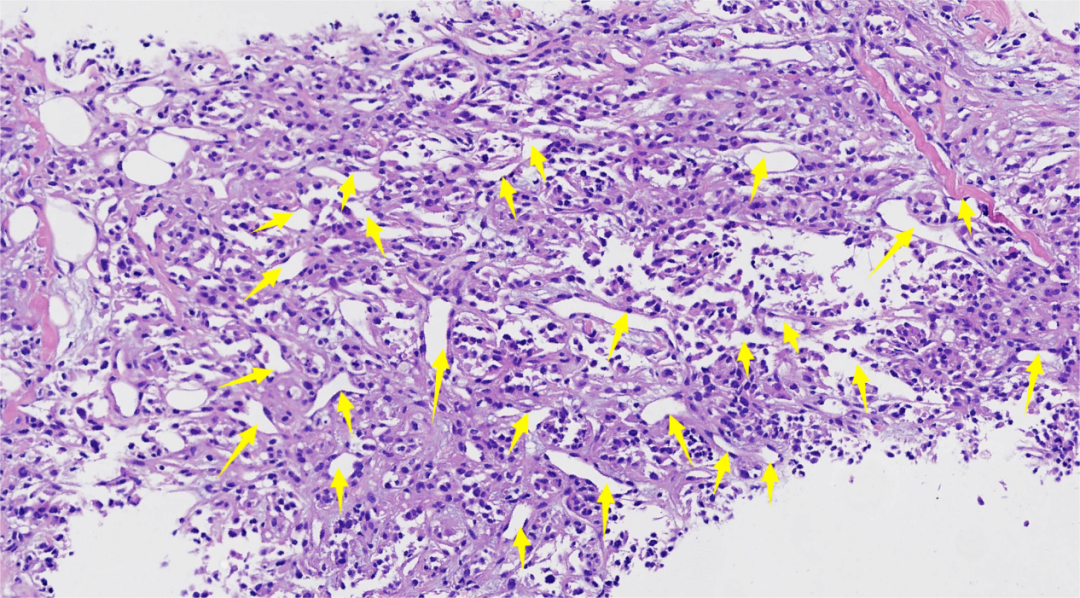
图7.该区域有更丰富的分支薄壁血管
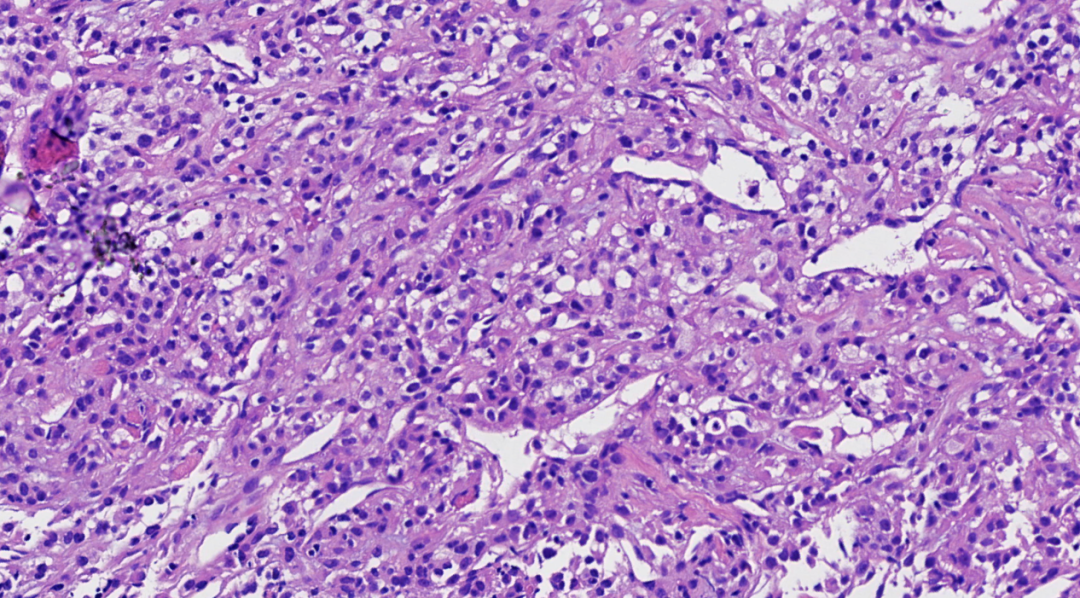
图8.肿瘤细胞形态温和,胞浆嗜酸或透明,核仁不明显,未见核分裂象,间质易见分支薄壁血管
提出问题:
1.这是乳腺原发?还是转移性的肿瘤呢?
2.如果是原发肿瘤,会是哪种类型?
3.如果是转移性肿瘤,我们会想到哪些肿瘤呢?
查找影像学资料及询问病史,对我们诊断是非常有帮助的。
经与临床沟通,病人2年前有透明细胞肾细胞癌病史。
通过以下免疫标记进行鉴别诊断
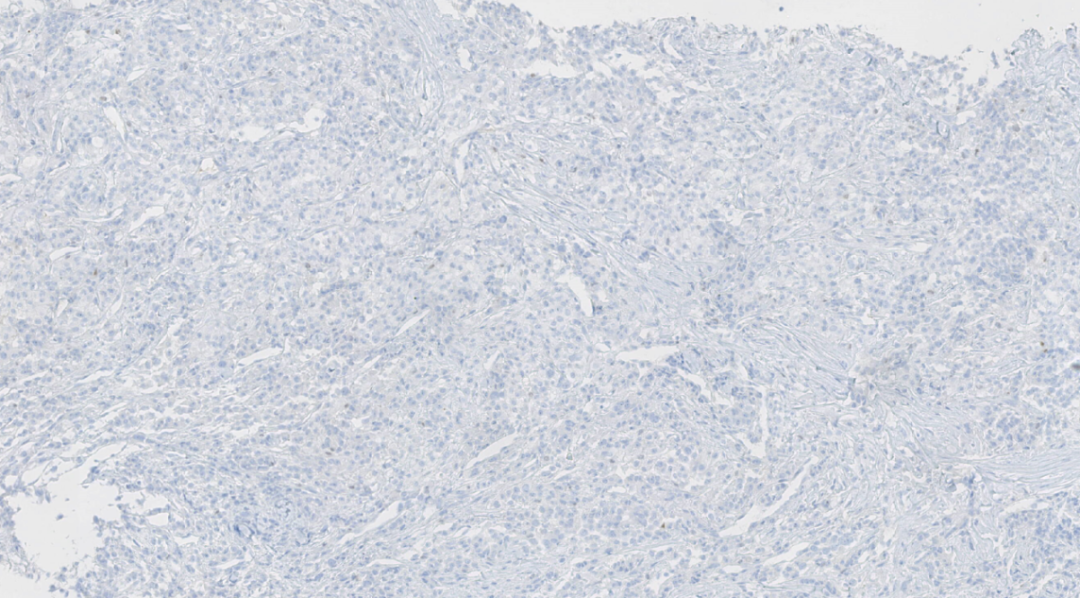
图9. ER阴性
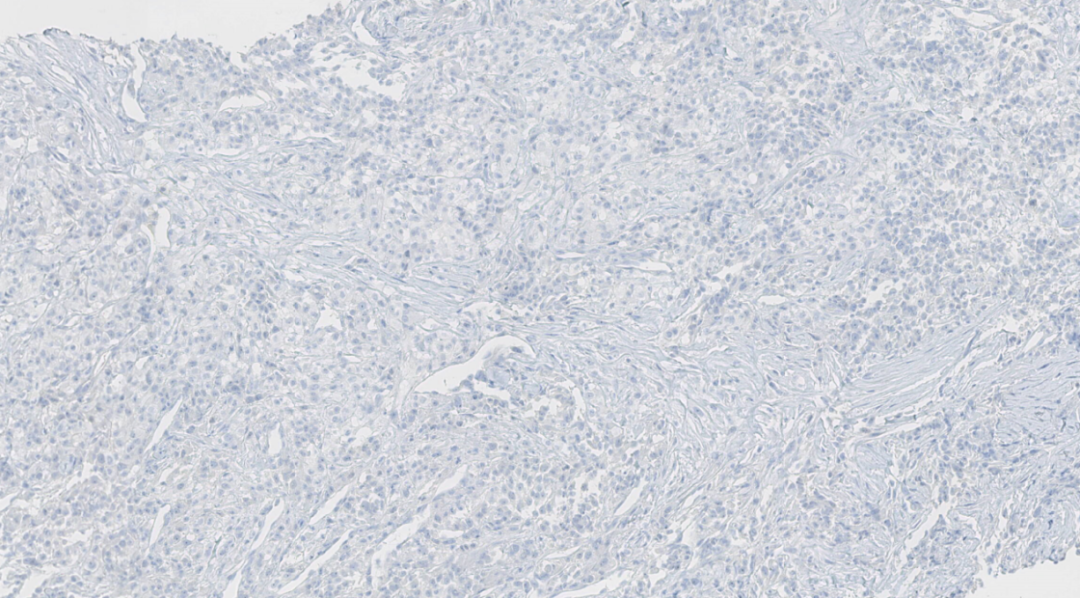
图10. PR阴性
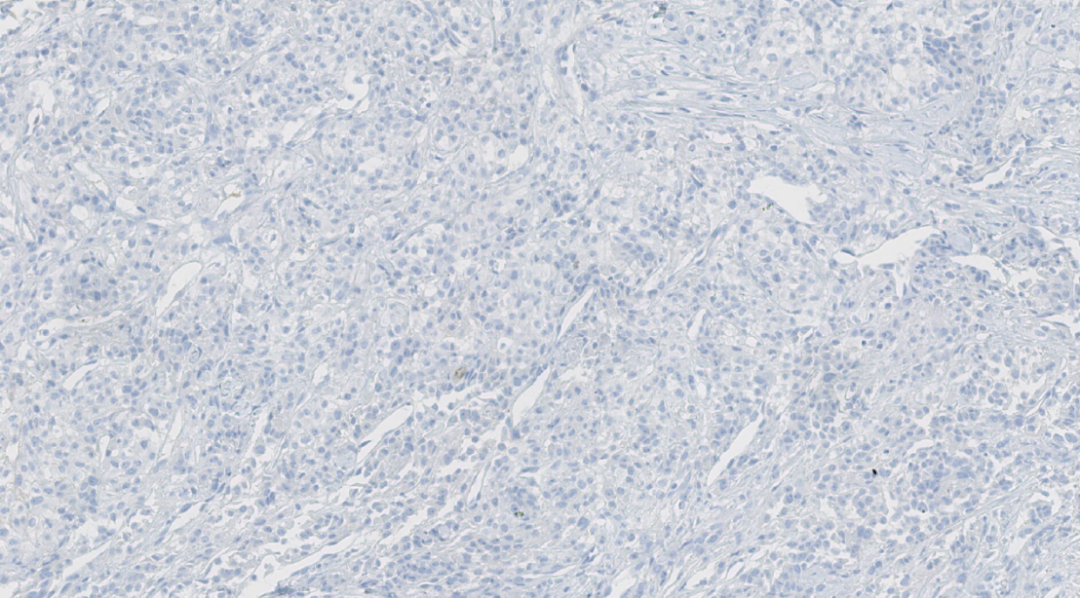
图11. HER-2(0)
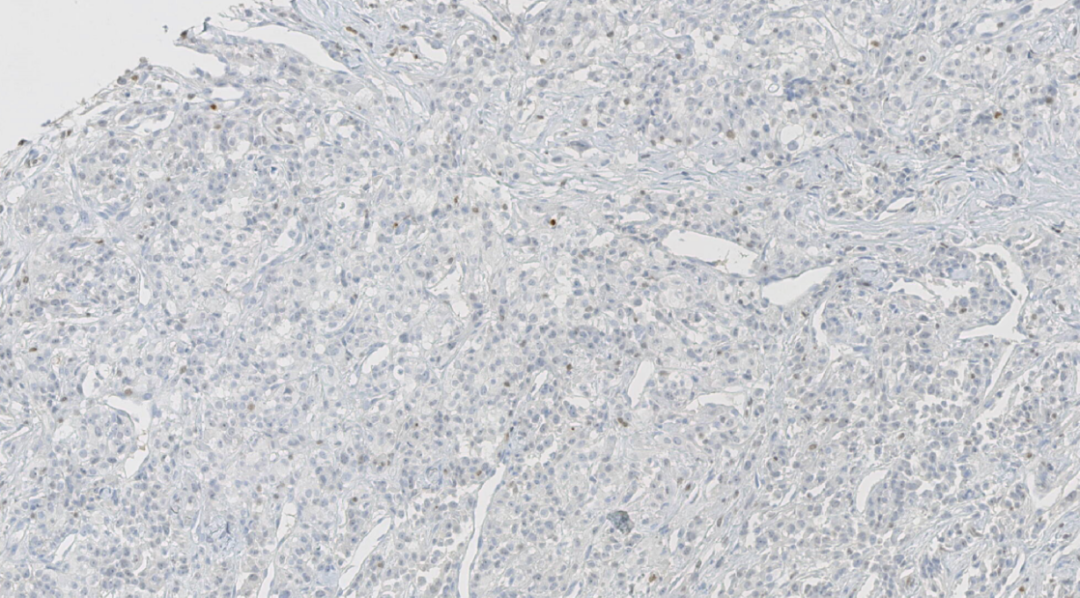
图12.GATA3阴性
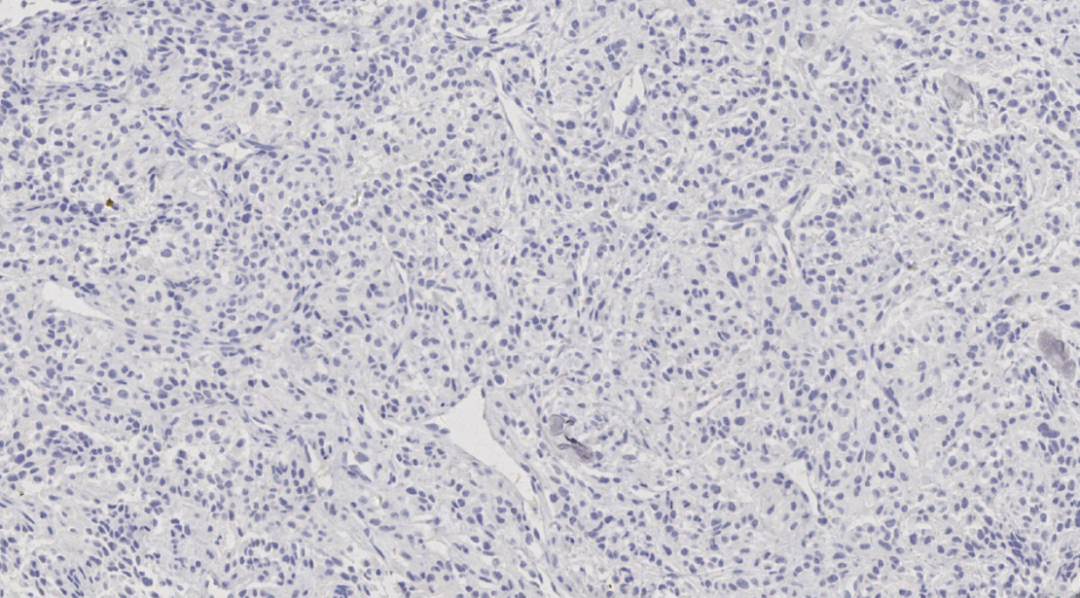
图13.TTF-1阴性
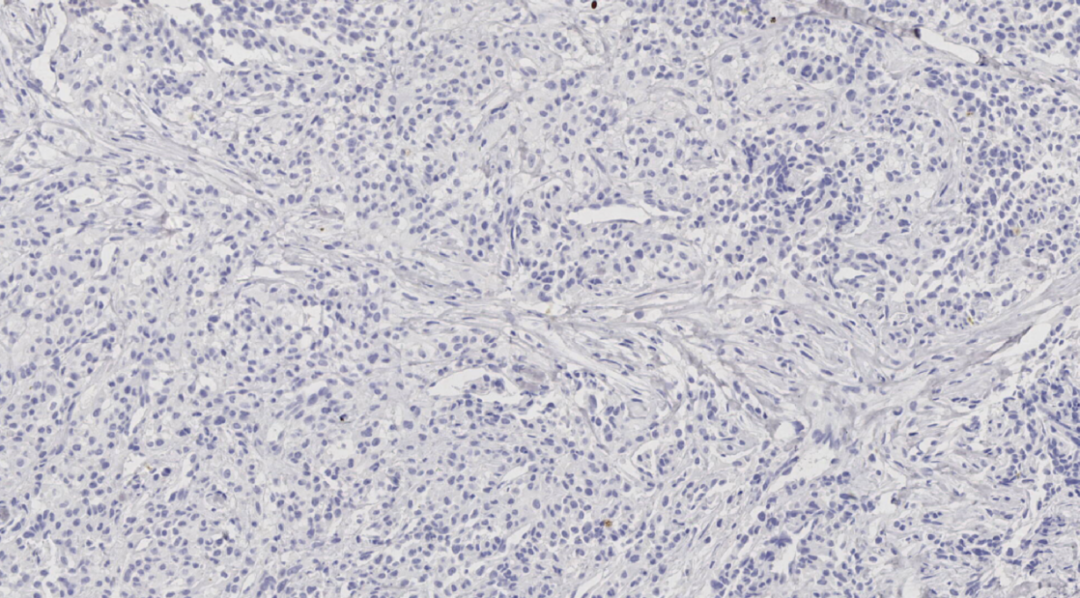
图14.Napsin A阴性
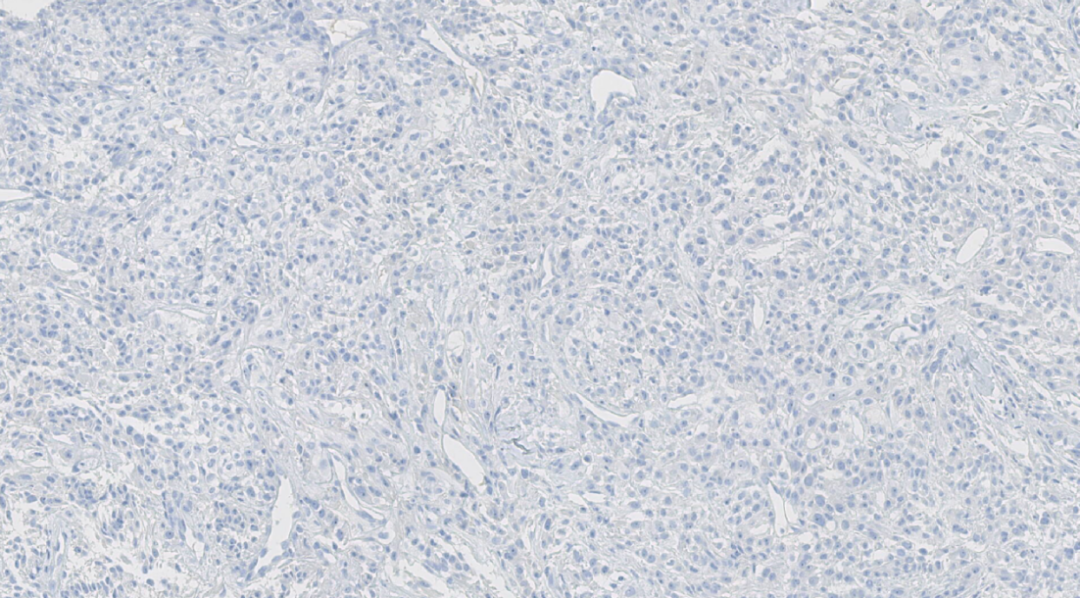
图15.HMB 45阴性
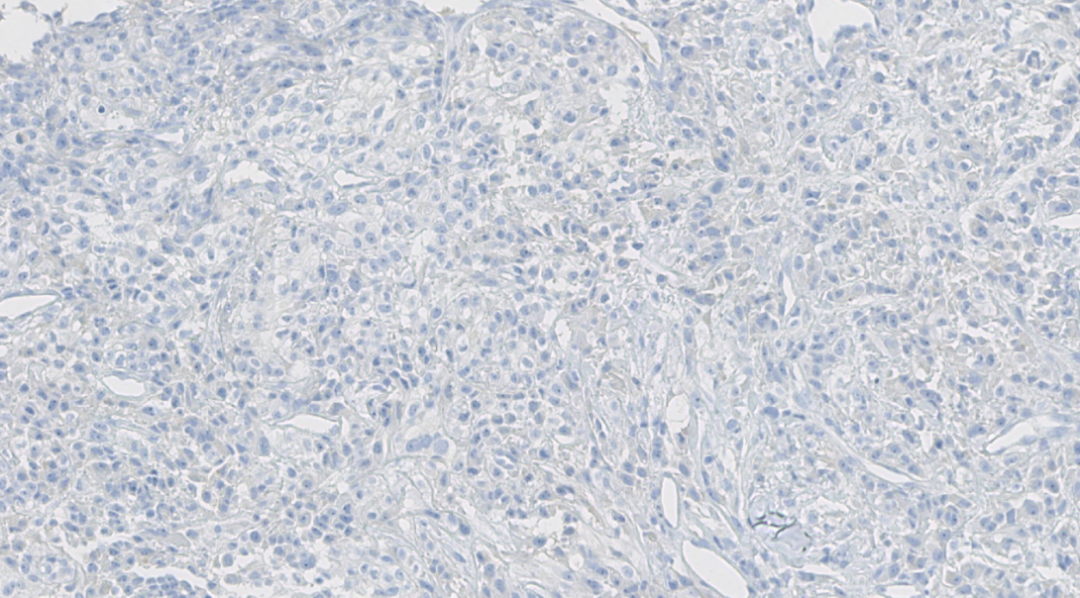
图16.Melan A阴性
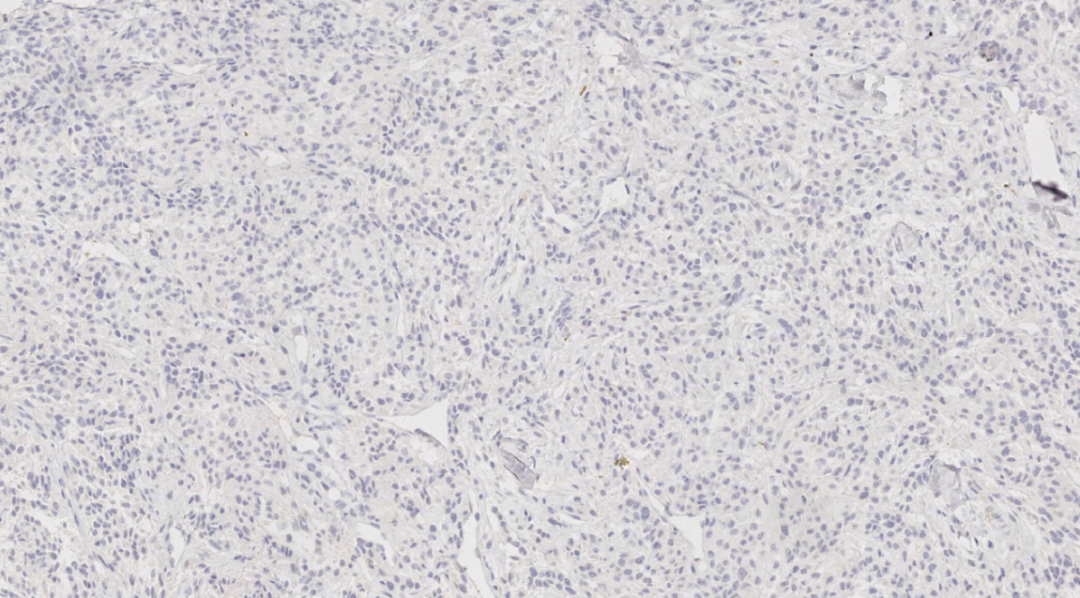
图17.CK7阴性
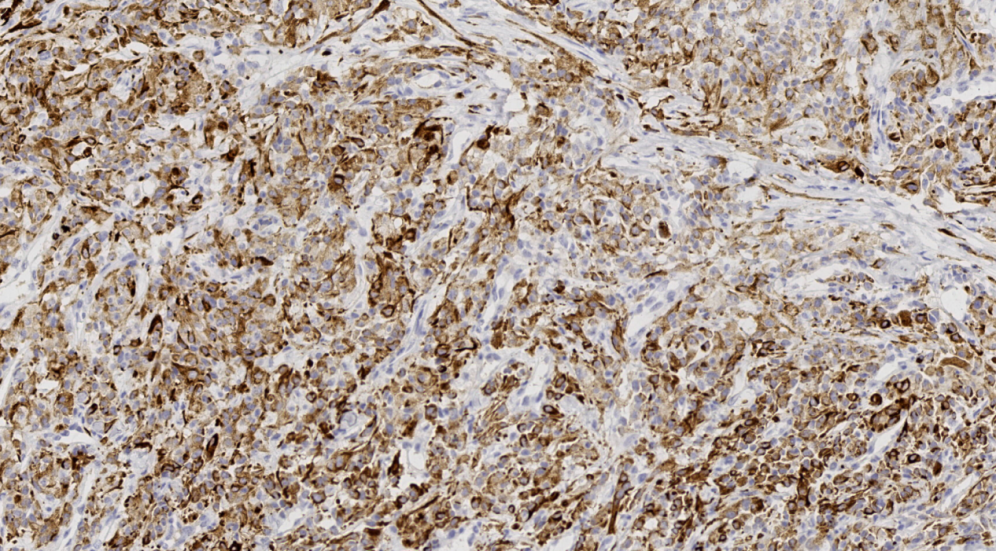
图18.CK阳性
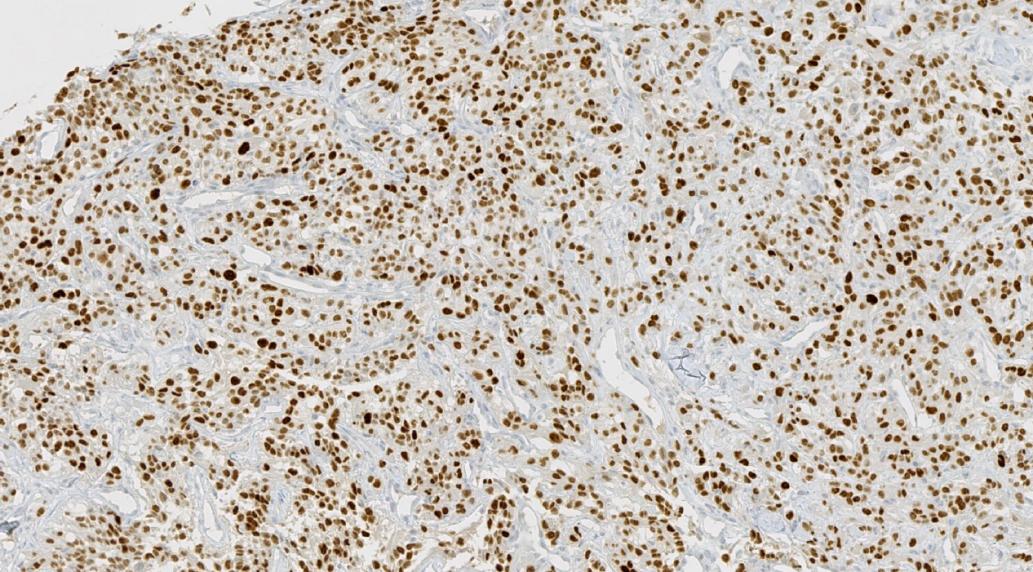
图19.PAX8阳性
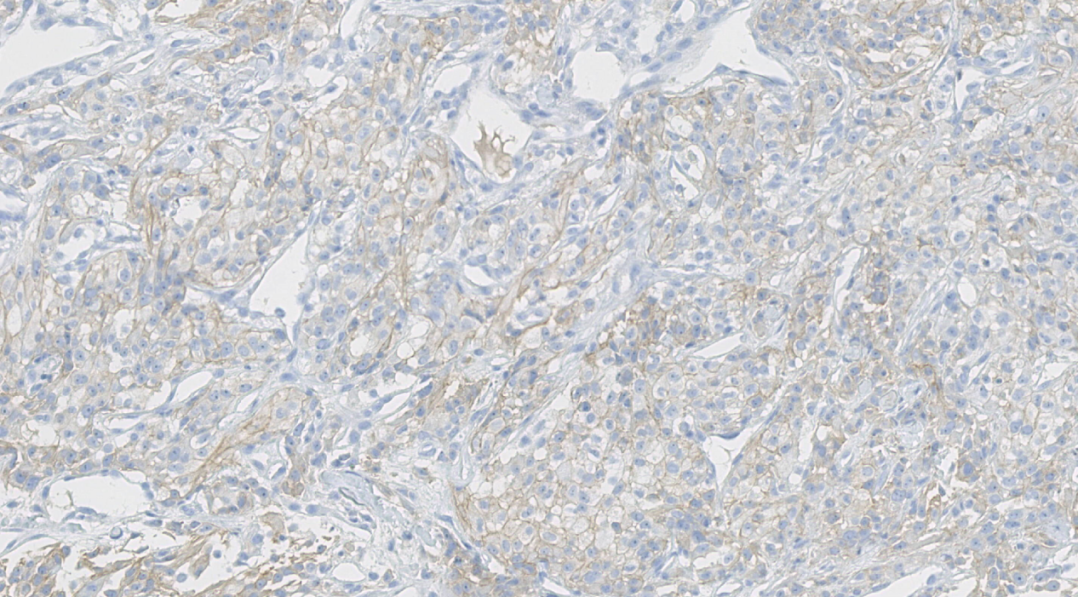
图20.CA9阳性
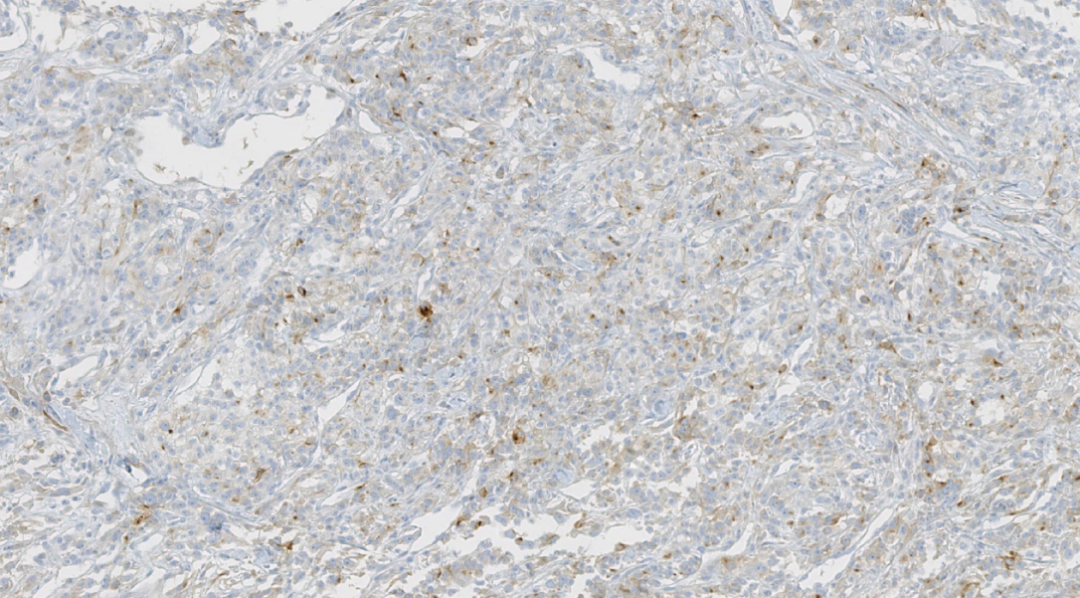
图21.CD10阳性
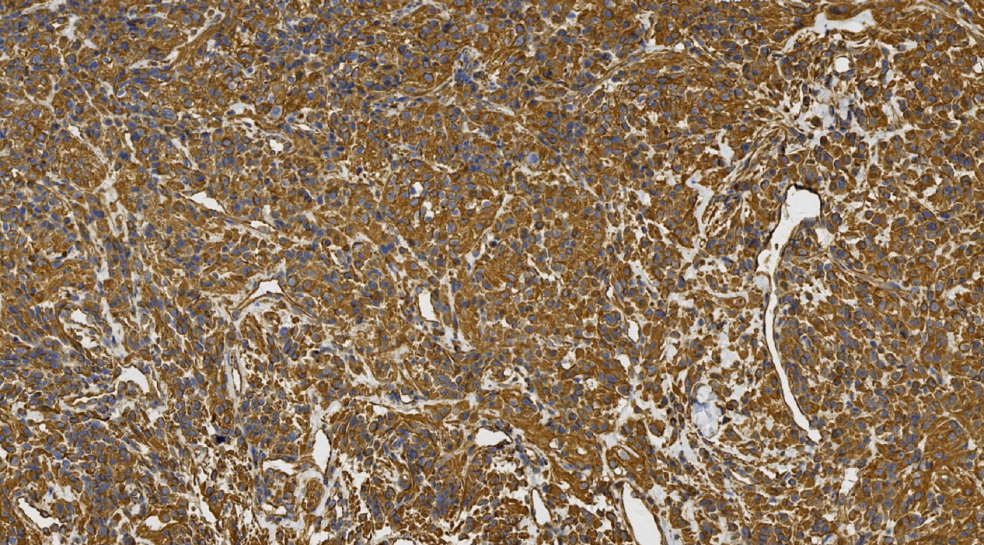
图22.Viemntin阳性
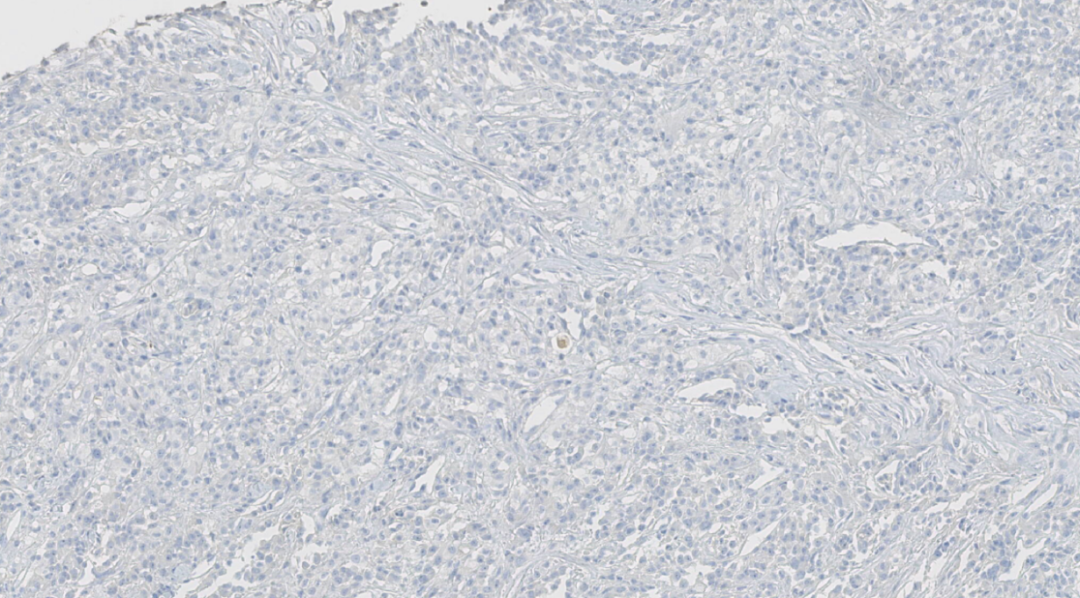
图23.RCC阴性
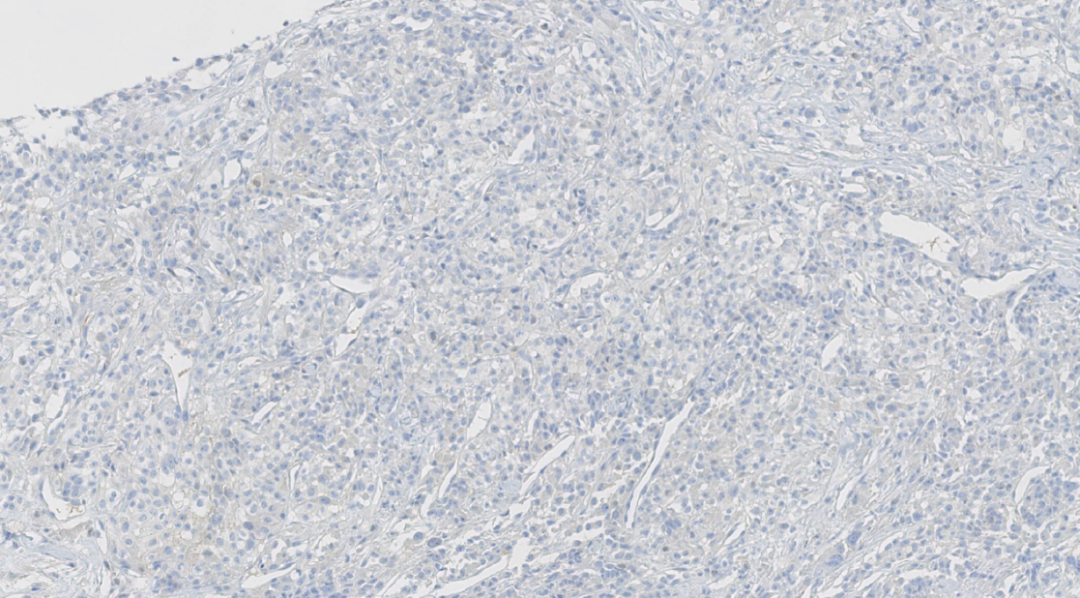
图24.TFE3阴性
总结:
HE形态小结:
1.穿刺组织2条,未见乳腺导管原位癌和小叶瘤变,亦未见正常乳腺组织。
2.肿瘤细胞异型性较小,胞浆透明、嗜酸染色,核分裂象罕见,未见坏死。
3.肿瘤细胞排列呈大小不一巢团、片状、单个或小簇状。
4.肿瘤间质成分较少,肿瘤内有丰富的分支薄壁血管。
免疫组化小结:
阳性:CK、CA9、CD10、PAX8、Viemntin
阴性:ER、PR、HER-2、GATA3、TTF-1、Napsin A、HMB 45、Melan A、CK7、RCC、TFE3
最终诊断:乳腺转移性透明细胞肾细胞癌。
讨论:
乳腺转移性恶性肿瘤罕见,占所有乳腺癌的0.21-3.00%,而且一些转移性肿瘤与乳腺原发癌形态非常相似,在术中冷冻及穿刺标本中很容易误诊。区分原发与转移对于指导正确治疗,避免不必要的手术至关重要。
肾细胞癌(RCC)是第三大最常见的泌尿生殖道肿瘤,约占所有成人肿瘤的3%,约30%的患者有转移倾向,通常转移到肺(70%)、淋巴结(55%)、骨(42%)、肝(41%)、肾上腺(15%)和脑(11%),还可以转移到一些少见部位,如皮肤,头颈部(鼻腔、腮腺等),转移至乳腺者更为罕见。
这例透明细胞肾细胞癌乳腺转移的病例,穿刺组织未见正常乳腺组织、亦未见导管原位癌及小叶瘤变,细胞异型性小,胞浆透明及嗜酸染色,未见核分裂象及坏死,肿瘤内可见丰富的毛细血管,和典型的透明细胞肾细胞癌形态一致,通过免疫组化标记及病史进一步证实其为透明细胞肾细胞癌转移。
乳腺既不是一个血流丰富的器官,也不是一个营养供应良好的肥沃“土壤”。这些特征可能解释了为什么乳腺是一个罕见的肿瘤转移部位,肾细胞癌转移至乳腺极其罕见,文献中多为个案报道。
较早的一篇英文文献于1995年报道了1例男性患者右乳腺肿块1年余,细针穿刺细胞学诊断为乳腺癌,乳腺切除后组织学诊断透明细胞肾细胞癌转移,术后行肾脏超声及CT检查发现肾脏占位。2009年《新加坡医学杂志》报道了1例接受乳腺癌治疗的患者以对侧乳腺转移为首发症状的透明细胞肾细胞癌。2014年《Journal of the Formosan Medical Association》报道了一位74岁女性,有透明细胞肾细胞癌病史,根治性肾切除术后3年因乳房肿块增大而接受右改良根治性乳房切除术,组织学检查显示一小灶具有类似于典型浸润性导管癌中包裹着透明细胞肾细胞癌的形态学特征。免疫组化显示CD10和波形蛋白均呈阳性,而周围的浸润性导管癌的两种标记物均为阴性,Her2阳性。根据组织形态和免疫组化特征,诊断为透明细胞肾细胞癌转移到乳腺浸润性导管癌,肿瘤转移至肿瘤最常见的受体肿瘤是肾细胞癌(RCC,38.8%),其次是脑膜瘤(25.4%),最常见的供体肿瘤是肺癌(55.8%),这是第一个有关乳腺肿瘤作为tumor-to-tumor metastasis受体治疗的病例。
转移至乳腺的透明细胞肾细胞癌可以有已知肾细胞癌病史,然而有些病例是以乳腺肿块为首发症状,以乳腺为首发的病例,尤其有乳腺癌病史的病例对侧乳腺出现肿块,很容易被认为是乳腺癌转移至对侧,术中或粗针穿刺活检一定要警惕诊断陷阱。
透明细胞肾细胞癌转移至乳腺需要与乳腺原发或转移的具有透明细胞特征肿瘤进行鉴别:
1、乳腺原发肿瘤:
胞质透明的浸润性导管癌、富糖原的透明细胞癌、富脂质癌、大汗腺癌、组织细胞样小叶癌等。
(1)胞质透明的浸润性导管癌
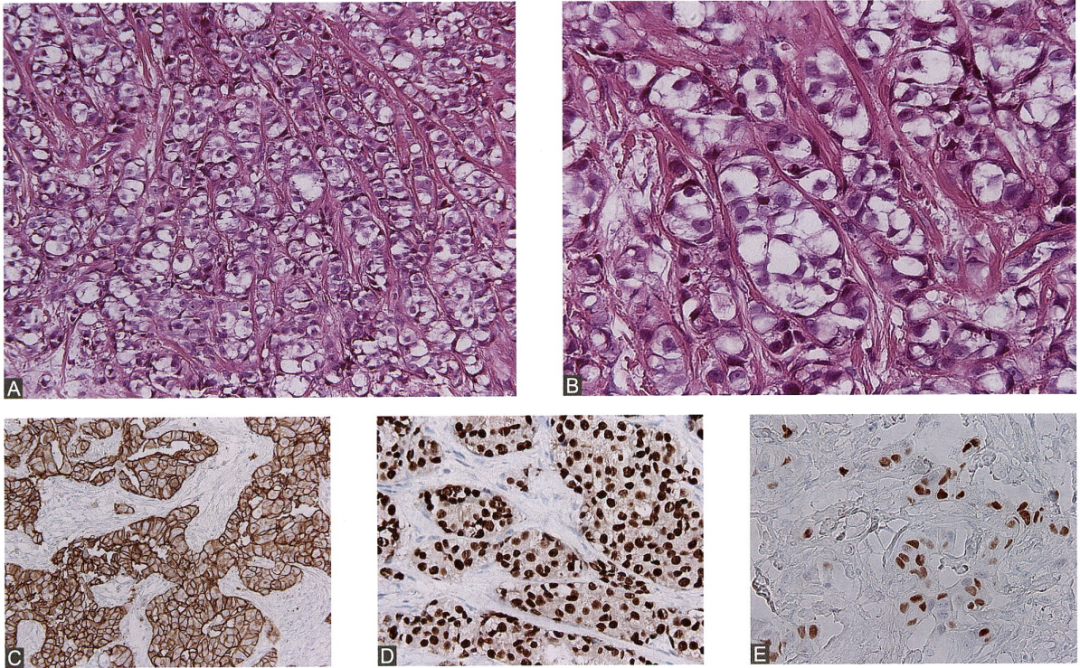
图25.癌细胞被纤细的纤维组织包绕成腺泡状或小巢状,分布密集,细胞质丰富且透亮,细胞核不规则,具有较明显异型性(A、B)。免疫组化染色显示:HER2癌细胞(3+)(C),ER弥漫强阳性(D),p63部分癌细胞呈阳性(E)
(2)富糖原的透明细胞癌
(glycogen-rich clear cell carcinoma)
是一种至少90%的细胞胞质透亮且富含糖原(PAS阳性,d-PAS阴性)的浸润性导管癌。
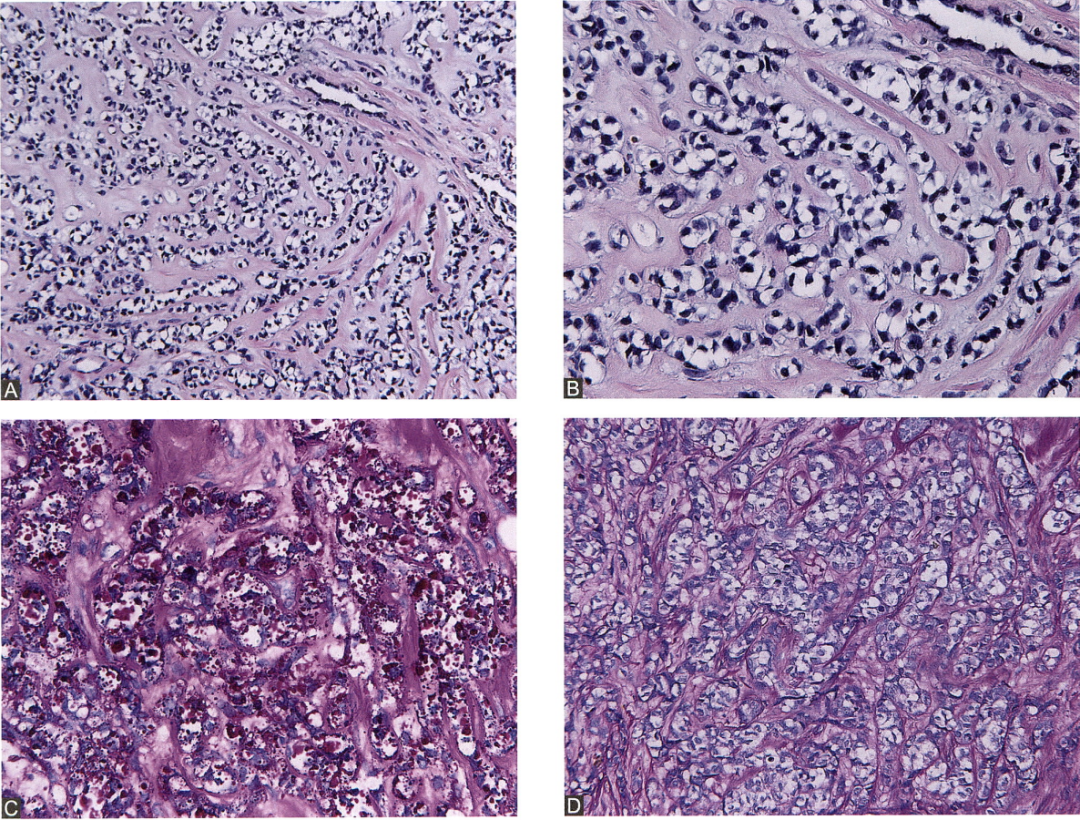
图26. 癌细胞围绕小导管呈腺泡状浸润性生长,细胞质丰富、透亮,细胞核不规则,染色深,细胞具有较明显的异型性,间质硬化(A、B)。癌细胞胞质内充满PAS染色呈阳性的糖原颗粒(C),淀粉酶消化后,PAS呈阴性(D)
(3)乳腺富于脂质的癌
(lipid-rich carcinoma)
是一种超过90%的细胞胞质内含有大量中性脂质,细胞质呈泡沫状(组织化学染色:苏丹Ⅲ或油红O阳性,AB-PAS阴性)的浸润性导管癌。证实细胞质内含有中性脂肪,需在冷冻切片上进行脂肪染色,亦可通过adipophilin免疫组化染色加以证实。
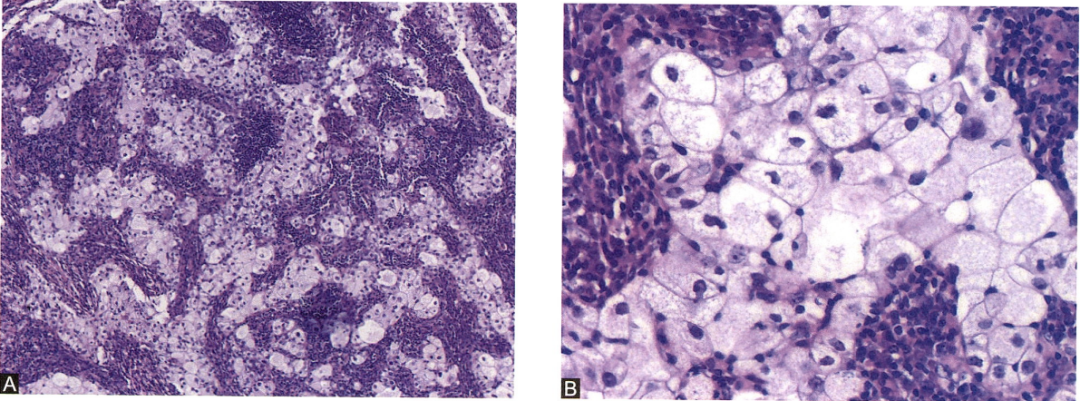
图27.癌细胞淡染,排列呈不规则的团状或片状,间质内有明显淋巴细胞浸润。肿瘤细胞宽大,界限清楚,细胞质丰富,淡染、呈泡沫状,细胞核不规则,部分可见小核仁,细胞具有较明显的异型性(A、B)。
(4)伴大汗腺分化的癌:
肿瘤细胞胞浆嗜酸或透明,胞浆宽大,细胞异型明显,常伴有大汗腺型导管原位癌成分,免疫组化表达AR、GCDFP-15、GATA3。
(5)组织细胞样乳腺小叶癌:
肿瘤细胞胞浆淡嗜酸或透明,呈组织细胞样,常伴有小叶原位癌成分,免疫组化E-cadherin异常表达(膜表达减弱或阴性、胞浆阳),P120浆阳。
2、转移性肿瘤:
黑色素瘤组织形态多样,尤其是缺乏色素,透明细胞的黑色素瘤转移至乳腺往往会误诊,通常黑色素瘤异型大,核仁明显,经全面取材观察后未见乳腺原位癌成分,我们要考虑转移瘤,详细询问病史及加做黑色素瘤免疫标记可以鉴别。
乳腺转移性恶性肿瘤还包括:黑色素瘤、肺腺癌、肺小细胞癌、卵巢高级别浆液性癌、胃腺癌、肠腺癌、胰腺神经内分泌肿瘤、前列腺癌、胰腺导管癌、肝内胆管癌、甲状腺髓样癌、腺泡状横纹肌肉瘤、胚胎性横纹肌肉瘤等。我们分别学习一下其临床病理特征,提高乳腺转移性恶性肿瘤的诊断,避免误诊。
(1)转移性黑色素瘤:
黑色素瘤是比较常见的乳腺转移性恶性肿瘤,如果患者有乳腺癌病史,术中冷冻或穿刺标本很容易先入为主将其误诊为乳腺癌转移。瘤细胞内存在黑色素或出现“大红”核仁是提示黑色素瘤转移的线索,但是对于色素缺乏的病例,特别是术中冷冻切片或活检标本,很容易误诊。2020年《Histopathology》发表了《Histological clues to the diagnosis of metastasis to the breast from extramammary》一文12例黑色素瘤乳腺转移病例,其中6例可见核内包涵体,6例核多形性明显,4例为梭形细胞,2例为浆细胞样外观,免疫组化标记CK、激素受体、GATA3和 HER2阴性,S100、SOX10、Melan A、HMB45等黑色素标志物阳性有助于黑色素瘤的诊断。
(2)转移性肺腺癌:
肿瘤在纤维间质中呈不规则腺样排列,部分腺管呈可见坏死,部分腺腔内见大量黏液,细胞核深染或呈空泡状,并伴有瘤巨细胞,病理性核分裂象易见,然而乳腺癌中良好腺管结构形成细胞通常为低-中核级。当缺乏乳腺原位癌成分,腺腔分化好而核级高时,需要仔细询问病史,寻找影像证据,并采用一组包括肺腺癌(TTF1和Napsin A阳性)和乳腺癌(GATA3和PAX8等阳性)在内的免疫组织化学进行鉴别诊断。
(3)转移性肺小细胞癌:
在形态学上与乳腺原发小细胞癌很难鉴别,乳腺原发小细胞癌更为罕见。肿瘤细胞具有典型的胡椒盐样核特征,坏死、核分裂象及核碎裂多见,神经内分泌标记阳性,临床有肺占位是提示肺小细胞癌转移的关键。
(4)卵巢高级别浆液性癌:
肿瘤细胞排列成分支乳头状或实性巢状结构,可见裂隙样腺管;细胞异型性显著,细胞核染色深、多形性明显,核分裂象易见,并可见灶性坏死,可见沙砾体,免疫组化标记WT1、Ca125、PAX8、CK7阳性、P53突变表达,GCDFP-15、GATA3阴性可进一步鉴别诊断。
(5)胃腺癌:
常为低分化腺癌,癌细胞呈不规则腺样、实性条索状或腺泡样结构,部分肿瘤细胞呈印戒细胞样单个散在分布。印戒细胞癌>50%的肿瘤细胞存在明显的细胞内黏液。免疫组化CK20、villin阳性,GATA3和GCDFP-15阴性。
(6)肠腺癌:
柱状细胞构成的腺腔,腔内可见坏死,常有黏液,与乳腺原发的黏液腺癌不易鉴别,柱状细胞构成的腺样结构,核分裂象易见,并见坏死要考虑结直肠癌转移。免疫组化CDX2、CK20阳性,ER、GCDFP-15和CK7阴性可加以鉴别。
(7)胰腺神经内分泌肿瘤:
肿瘤细胞形态相对一致,胞质呈丰富嗜酸性颗粒状,核居中、圆形或卵圆形,神经内分泌标记阳性,影像学检查胰腺有占位提示转移。
(8)前列腺癌腺泡腺癌:
老年男性患者,乳腺肿瘤镜下见融合的不规则筛状腺体,肿瘤细胞核呈圆形或卵圆形,形态较一致,细胞质,丰富嗜酸性,要考虑前列腺腺泡腺癌转移,加做免疫组化PSA、P504S、AR阳性可明确诊断。
(9)胰腺导管癌和肝内胆管癌:
肿瘤细胞异型性大、核级高且伴细胞内和/或细
胞外黏液成分;GATA3阴性或弱阳性,TRPS1阴性或弱阳性,Villin阳性,CDX2阳性,CK20阳性,CK7阳性。
(10)甲状腺髓样癌:
肿瘤细胞具有神经内分泌样肿瘤的多样性细胞学特点:圆细胞排列呈巢团状,多角形高细胞排列呈梁索状,可伴有多灶坏死、丰富纤细的毛细血管,突触素、Calcitonin和 TTF1 均阳性表达。
(11)腺泡状横纹肌肉瘤:
乳腺是横纹肌肉瘤罕见转移部位,肿瘤细胞呈圆形,巢状排列,浸润性生长方式,类似分化差的浸润性癌。详细病史资料、相关免疫组织化学和荧光原位杂交(FISH)可避免误诊。腺泡状横纹肌肉瘤广谱细胞角蛋白(CKpan)可表达阳性,与小细胞癌表型有重叠(表达 CD56、突触素和 CgA,甚至局灶表达TTF1),需要紧密结合临床病史及影像学表现,拓宽鉴别诊断思路。
(12)胚胎性横纹肌肉瘤:
分化差的肿瘤细胞弥漫浸润,片状分布,可见胞质丰富、明显嗜酸性的横纹肌母细胞,肿瘤细胞核呈不规则形,染色质呈颗粒状,核仁明显,细胞异型性明显,细胞核深染、偏位,部分区间质疏松呈黏液样,免疫组化染色desmin和MyoD1阳性。
诊断乳腺转移性恶性肿瘤的鉴别要点总结
-
多个病灶,钼靶片上缺乏钙化 ;
-
影像学、大体检查、镜下肿块边界相对清楚,缺乏原位癌,可见广泛的脉管内瘤栓;
-
无论间质还是上皮,形态学上均不具有典型乳腺癌的特点;
-
有与其它部位肿瘤相似的组织形态学特征;
-
了解临床病史是做出正确诊断的关键;
-
必要时借助免疫组化检测协助诊断。
通过乳腺转移性肿瘤临床病理特征的总结,希望可以提高我们对乳腺转移性肿瘤的认识,避免误诊,避免不必要的手术,指导临床正确治疗。
参考资料:
1.Gibbons CE, Lewi HJ, Kashif KM. Breast lump--an unusual presentation of renal cell carcinoma. Br J Urol. 1995;76(1):131.
2.Durai R, Ruhomauly SN, Wilson E, Hoque H. Metastatic renal cell carcinoma presenting as a breast lump in a treated breast cancer patient. Singapore Med J. 2009;50(8):e277-e279.
3.Chen TD, Lee LY. A case of renal cell carcinoma metastasizing to invasive ductal breast carcinoma. J Formos Med Assoc. 2014;113(2):133-136.
4.沈爱琴,凌伟江,魏建国.乳腺转移性黑色素瘤冷冻切片误诊为浸润性癌1例[J].临床与实验病理学杂志,2022,38(10):1269-1270.
5.周淑玲,于宝华,成宇帆,等.转移至乳腺的恶性肿瘤28例临床病理学观察[J].中华病理学杂志,2014,43(04):231-235.
6.谷文巧,王璐,徐静纯,等.乳腺穿刺非原发实体恶性肿瘤23例临床病理学分析[J]. 中华病理学杂志,2024,53(4): 331-336.
7.乳腺组织病理学图谱 下册_丁华野主编2023年(彩图)
8.Lee AHS, Hodi Z, Soomro I, et al. Histological clues to the diagnosis of metastasis to the breast from extramammary Histopathology. malignancies. 2020;77(2):303-313.

