Adv Sci:浙江大学任探琛/王建安/刘先宝合作研制了新型凝胶,旨在改善心肌梗死
时间:2024-07-17 17:00:25 热度:37.1℃ 作者:网络
心肌梗死(MI)是世界范围内的主要死亡原因。代谢调节是预防心肌梗死后不良重构的一种很有前景的治疗方法。然而,物质衍生的线索是否可以通过代谢调节治疗心肌梗死,目前还没有得到充分的研究。
2024年7月15日,浙江大学任探琛、王建安及刘先宝共同通讯在Advanced Science 在线发表题为“Copper-loaded Milk-Protein Derived Microgel Preserves Cardiac Metabolic Homeostasis After Myocardial Infarction”的研究论文,该研究研制了一种Cu2+负载酪蛋白微凝胶(CuCMG),旨在挽救病理性心肌内代谢,改善心肌梗死。
Cu2+是参与代谢途径的重要离子因子,心肌梗死后观察到心内铜流失,推测心肌内补充Cu2+可挽救心肌代谢。酪蛋白是乳源性蛋白,基于Cu2+的负载能力和可及性,通过分子对接筛选出Cu2+载体。CuCMG可显著减轻心肌梗死引起的心功能障碍和适应性重构不良,并伴有血管生成增加。无偏倚转录组分析和氧化磷酸化分析的结果支持了CuCMG在心肌梗死后显著恢复心肌代谢稳态的假设。这些发现增强了对缺血性心肌病代谢调节生物材料的设计和应用的理解。

心肌梗死(MI)是全世界发病率和死亡率的主要原因之一。尽管近年来在冠状动脉血运重建的治疗和技术方面取得了重大进展,但由于以下缺血性心肌病,心肌梗死仍然造成了很高的全球医疗负担。心脏功能对能量供应很敏感。心肌梗死导致局部血液和氧气供应突然停止,从而改变氧化磷酸化水平(OXPHOS)。缺血后心肌能量代谢紊乱最终导致左心室功能和结构的改变,增加心脏重构和心力衰竭的可能性。
心肌梗死后调节代谢稳态的策略是治疗心力衰竭的有希望的候选药物。虽然临床上尚未应用药物直接调节临床急性心肌梗死的心脏代谢,但越来越多的研究结果表明,通过逆转缺血性心肌病的有害代谢过程来挽救心力衰竭。某些代谢途径的抑制剂和激活剂在各种研究中显示出心脏保护作用。然而,由于改变全身代谢稳定性的风险,药物毒性仍然是一个挑战。最近,已经鉴定出某些长链非编码RNA和环状RNA可以减轻心肌梗死后线粒体功能障碍。腺相关病毒(AAV)携带某些基因来编辑心肌细胞的代谢途径,对左前降支结扎小鼠的心功能产生保护作用。然而,AAV必须在缺血事件发生前几周给药,以保证足够的转染,这可能与临床相关性较低,因为患者不能事先治疗。
基于材料的生物工程策略具有克服全身副作用的潜力,并且在代谢调节管理后立即生效。基于生物工程货物的固有代谢因子的递送可以提高组织再生的性能。Gentaro Ikeda等人通过注射富含线粒体的细胞外囊泡(EVs)直接将线粒体转移到梗死心脏组织,成功恢复心肌生物能量,并在心肌梗死后增强心功能。Peng fei Chen等人开发了一种基于包裹在细胞膜内的纳米类囊体单位的植物源光合系统,以改善变性软骨细胞的合成代谢。更人性化的材料,如支架,可以持续释放调节代谢物,即柠檬酸盐和琥珀酸盐,已经开发出调节骨再生的能量代谢。因此,推测装载代谢调节因子的材料可能对增强心脏代谢稳态和重建起积极作用。
铜(Cu)是人体必需的微量元素,在人体代谢过程中起着重要作用。它们是许多关键线粒体酶(如细胞色素c氧化酶(CCO)和超氧化物歧化酶1(SOD1))的辅助因子,在维持线粒体代谢稳态中发挥重要作用。据报道,铜缺乏会影响线粒体OXPHOS并损害肿瘤的转移。在心肌梗塞的情况下,小鼠LAD分支结扎后缺血心肌中Cu水平明显下降,28天内未随时间恢复。强调补充铜的治疗方法已经显示出有希望的结果。在这些研究中,Cu的功能涉及多种机制,如抑制成纤维细胞向肌成纤维细胞的转化,增加缺氧诱导因子-1(HIF-1)的稳定性,作为催化剂促进氮氧化物的局部释放,从而提高内皮细胞的活性。然而,补充Cu2+是否能挽救梗死后心肌代谢尚不清楚。
由于心肌梗死后血清铜水平升高,口服补铜或血管内注射可能引起潜在的副作用,即全身毒性。此外,铜的剂量很难通过膳食摄取来控制。饲粮中Cu超载引起内质网应激和线粒体损伤,甚至导致心肌细胞凋亡。局部给药是提高治疗效果、减少全身副作用的有效方法。然而,由于心脏递送困难,需要高度可控的Cu释放,以单次剂量挽救长期Cu缺乏。
负载铜的乳蛋白衍生微凝胶的示意图(图源自Advanced Science )
天然蛋白质作为药物载体具有许多优点,例如良好的生物相容性、丰富的来源、安全性、用于相互作用预测的明确成分和结构,以及通常与金属离子的强相互作用。基于蛋白质的生物材料具有多个反应位点,可以制成各种形式用于体内组织工程。其中,微凝胶作为治疗因子的载体,因其具有微创给药的可行性和可控制释放的稳定滞留性而受到广泛关注。微凝胶的大小、形状、表面性质和组成可以根据各种应用的要求通过制备工艺来控制。戊二醛、吉尼平等交联剂通常用于制备蛋白质微凝胶,不需要进行分子预修饰,但残留的交联剂通常具有细胞毒性,植入后可能导致不良反应。
甲基丙烯酸酯修饰的蛋白质由于其高可控性而被广泛应用于微凝胶制备,但侧链修饰可能改变蛋白质结构,导致制备时间和精力的增加。在此之前,使用钌/过硫酸钠(Ru/SPS)光交联体系通过在蛋白质分子中的酪氨酸残基之间形成双酪氨酸键来形成水凝胶,而无需预先修饰。因此,推测Ru/SPS系统也可以用于微凝胶的形成。
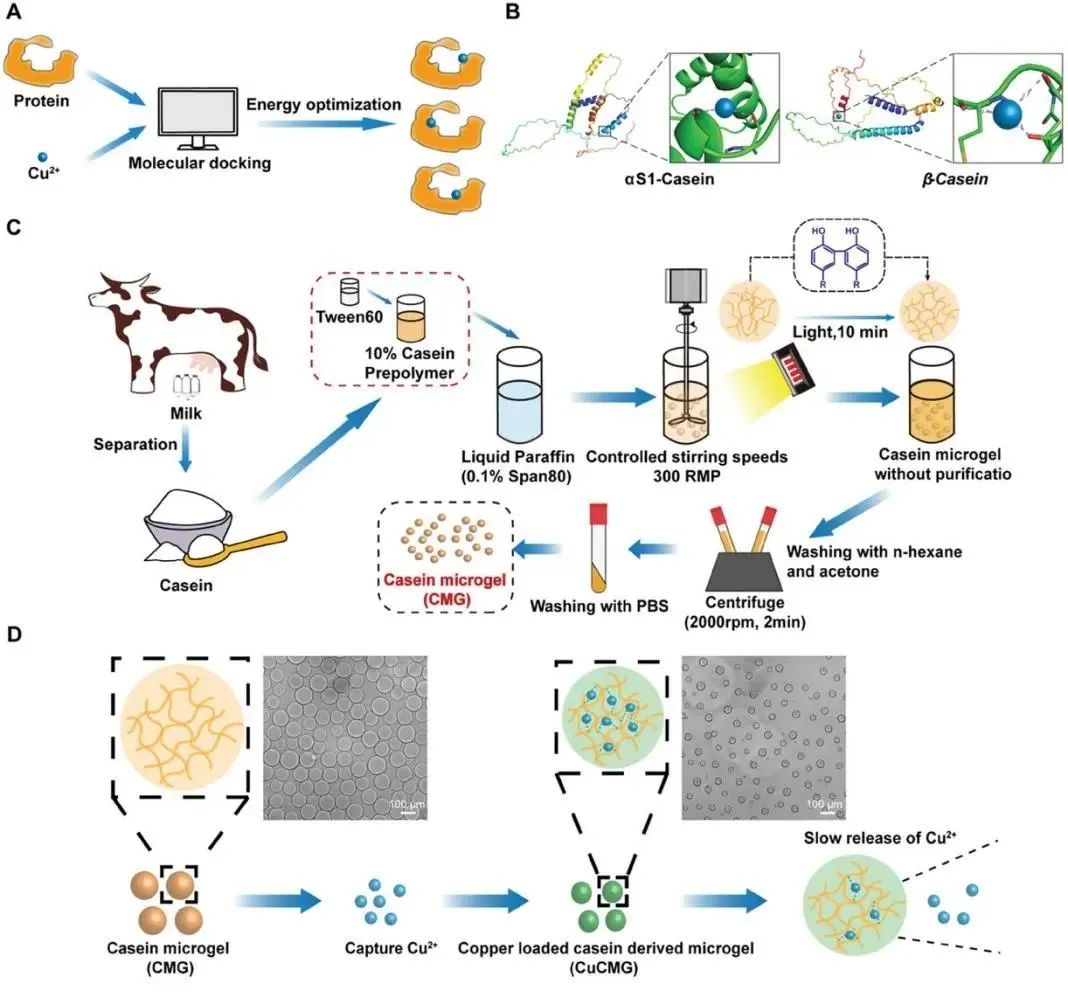
为了筛选合适的Cu载体,选择了几种生物工程中常用的蛋白作为候选物,并通过理论分子对接和实验比较对其进行了鉴定。首先利用分子刺激技术研究了酪蛋白、牛血清白蛋白(BSA)、人血清白蛋白(HSA)、胶原蛋白、乳球蛋白、丝胶蛋白和丝素蛋白等7种蛋白的Cu结合能力(图1A)。最终选择了具有最高Cu负载能力的酪蛋白(主要由αS1-酪蛋白和β-酪蛋白组成)作为载体材料(图1B;图S1,支持信息)。酪蛋白是牛奶中的主要蛋白质(约占80%),具有广泛的资源和良好的质量控制。酪蛋白还具有良好的生物相容性、低免疫原性和较长的体内降解期(>35天),使其具有较长的体内药物释放能力。为了便于心肌内注射,通过Ru/SPS氧化还原系统制备了酪蛋白微凝胶(cmg)(图1C)。
进一步研究了酪蛋白的Cu2+加载和释放能力(图1D),以及Cu2+诱导的cmg结构和力学变化,以反映Cu与酪蛋白的相互作用。体外研究了Cu2+负载CMGs (CuCMG)对心肌细胞、成纤维细胞和内皮细胞的生理功能,探讨了CuCMG在病理环境下对细胞的保护作用。在大鼠急性心肌梗死模型中研究了CuCMG的治疗作用和代谢调节功能。进行了全基因组测序,以确定CuCMG参与心肌梗死后治疗的重要途径。强调代谢调节,进一步分析了CuCMG对利用心脏组织线粒体电子传递链(ETC)功能的影响。在本研究中,制备了一种心肌内注射微凝胶CuCMG,它具有维持心肌梗死后的代谢稳态以保护心脏的功能,为心脏保护生物材料的开发提供了新的见解(图1E)。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202401527


