Adv Sci:杭州师范大学陈健翔团队发现SNRPD2是肝细胞癌中剪接体程序的关键剪接轴
时间:2024-07-19 19:00:21 热度:37.1℃ 作者:网络
RNA剪接是响应环境刺激的动态分子过程,受剪接体的严格调控。剪接体的Sm蛋白是介导剪接反应的关键成分;然而,它们在肝细胞癌(HCC)中的潜在作用尚不清楚。
2024年7月17日,杭州师范大学陈健翔团队在Advanced Science 在线发表题为“Intron Retention of DDX39A Driven by SNRPD2 is a Crucial Splicing Axis for Oncogenic MYC/Spliceosome Program in Hepatocellular Carcinoma”的研究论文,该研究中,SNRPD2 (PD2)被发现是HCC中最高调的Sm蛋白,并作为癌基因发挥作用。
PD2与HNRNPL一起调节DDX39A内含子保留以维持DDX39A短变异体(39A_S)的表达。在机制上,39A_S可以介导MYC mRNA核输出以维持MYC蛋白的高表达,而MYC反过来增强PD2转录。重要的是,地黄素可以直接与PD2相互作用,对HCC具有显著的抑癌作用。该研究揭示了DDX39A在HCC中感知致癌MYC信号并通过PD2剪接形成正反馈回路的新机制,该机制可被洋地黄毒苷靶向。

肿瘤异质性一直是成功治疗包括肝细胞癌(HCC)在内的癌症的主要障碍。前mRNA的选择性剪接(AS)是真核细胞中精确调节的转录后过程,是对环境刺激的反应,有助于RNA,蛋白质和细胞多样性。AS网络的失调与癌变有关。因此,迫切需要深入探索AS在肝癌发生过程中的潜在分子机制。
超过90%的人类蛋白质编码转录本经历AS,导致外显子和内含子盒的差异包含或排除,从而产生多个mRNA亚型,以确保细胞特异性时空蛋白质组多样性。这个进化上必不可少的过程是由一个高度动态的多亚基复合物——剪接体催化的,剪接体由五个小的核核糖核蛋白(snRNP;U1, U2, U4, U5和U6),每个都由一个特定的小核RNA(snRNA)和超过150个辅助蛋白组成。
通过这些辅助蛋白的突变或表达改变,癌症中AS的破坏会影响癌症特征。Sm蛋白是剪接体snRNP的核心成分。虽然Sm蛋白(包括SmD1和SmE)的预后潜力已被报道,但这些蛋白在癌症中的表达谱及其功能的详细机制在很大程度上尚不清楚。通过对癌症基因组图谱(TCGA)的分析,发现7个Sm基因在癌症中存在差异表达;SNRPD2 (PD2)是最高表达的Sm基因,提示其在Sm环不依赖的机制中潜在的致癌作用。在HCC细胞系中,沉默PD2与增殖受损和G2/M细胞周期阻滞有关。然而,PD2在HCC中的具体机制尚未完全确定。
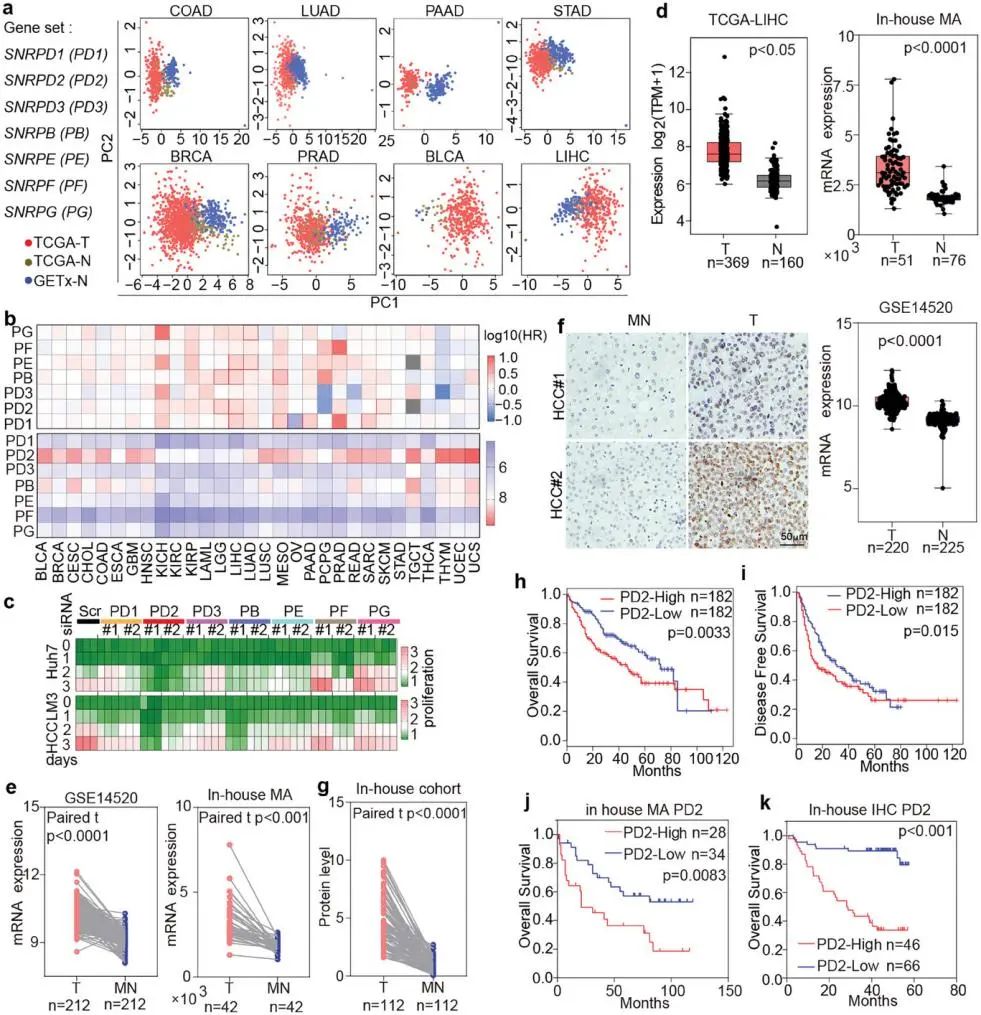
PD2在HCC中高度表达并且与OS负相关(图源自Advanced Science )
MYC失调发生在50%以上的肿瘤中,通常与预后不良有关。然而,由于缺乏小分子结合位点,直接靶向MYC在临床上已被证明是困难的。因此,进一步的研究集中于确定MYC驱动癌症生长所需的潜在途径。为此,前mRNA剪接已成为myc驱动癌症的潜在易感性因素。MYC通过调节剪接体蛋白来调节AS。相反,MYC在mRNA表达、蛋白稳定和转录活性水平上也受到AS的调节。此外,myc驱动的癌症依赖于不同的剪接体成分。在HCC中,myc诱导的SNRPB、MTR4和hnRNPH1/2的上调对于myc驱动的肿瘤发生是必要的。这些发现表明MYC和癌症剪接机制之间存在复杂的联系。然而,HCC中MYC/剪接调节信号的关键传感器尚不清楚。
在该研究中,证明了DDX39A短转录物39A_S作为一个关键的下游剪接事件,通过调节MYC mRNA核输出和维持其表达,感知Sm蛋白的完整性来上调PD2。这种PD2/39A_S/MYC电路作为检查点调节高效转录和剪接之间的平衡,并维持HCC细胞的增殖。此外,FDA批准的药物洋地黄毒苷被评估并证实可直接与PD2结合,干扰PD2/39A_S/MYC通路,有效预防HCC的发生。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202403387


