JCI:新靶向药增强中线弥漫性胶质瘤放疗敏感性
时间:2024-07-21 06:00:43 热度:37.1℃ 作者:网络
H3K27突变的中线弥漫性胶质瘤是一种侵袭性强且治疗效果不佳的脑肿瘤类型,辐射治疗是唯一有效的治疗方式,经辐射治疗的患者的5年生存率仅为1%。已有几项临床试验尝试使用放射增敏剂来增强辐射抗肿瘤的活性,但效果不佳,因此亟需新的治疗方法。
近日,来自美国西北大学范伯格医学院的研究人员在 Journal of Clinical Investigation 上发表了题目为 BET Bromodomain Inhibition Potentiates Radiosensitivity in models of H3K27-Altered Diffuse Midline Glioma 的文章,发现BET溴结构域抑制剂可以减少DMG细胞增殖,并通过抑制DNA修复来增强放射诱导的DNA损伤。RNA-seq和CUT&RUN结果显示,BET溴结构域抑制剂通过H3K27乙酰化在增强子上调控DNA修复基因的表达。此外,BET溴结构域抑制剂还可增强患者来源的异种移植模型和基因工程小鼠模型中的DMG对放射治疗的反应。这项研究揭示了BET溴域抑制剂作为放射敏化剂的潜力,并为开发与放射治疗结合的DMG治疗方法提供了理论依据。这是一项非常重要的研究,可能会对DMG的治疗产生深远影响。

为了寻找能够增强DMG细胞对放射治疗敏感性的方法,研究人员进行了一系列的实验。作者首先进行了高通量放射敏感性筛选,结果发现BET溴域抑制剂是对DMG细胞强有效的放射敏化剂。这意味着,当DMG细胞暴露于BET溴域抑制剂时,细胞对放射治疗的反应增强。
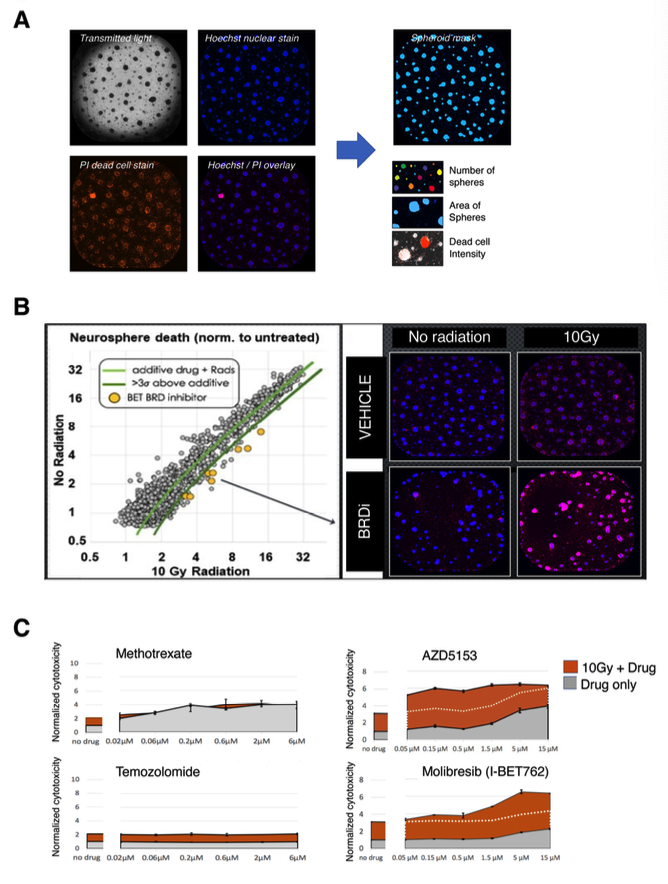
图1 在DMG细胞中进行高通量药物筛选,发现BET溴结构域抑制剂是放射增敏剂:在GEMM-DMG小鼠中,分离肿瘤细胞,作为神经球体外培养,用于放射增敏剂的药物筛选。(a)神经球在透射光、Hoechst染色(核)、PI染色(死细胞)和Hoechst/PI叠加中的代表性图像。评估神经球的数量、面积和死细胞强度。(b)在存在或不存在10 Gy辐射剂量的情况下,对1280种FDA批准的药物和1600种临床候选药物进行了筛选。(c)甲氨蝶呤(Methotrexate)、AZD5153、替莫唑胺(Temozolomide)和莫利布(Molibresib,I-BET762)的放射增敏作用(橙色)和细胞毒性作用(灰色)。
为了确定K27M突变的DMG细胞生长是否需要BET溴结构域活性,研究人员使用CRISPR-Cas9基因敲除(KO)的方法,在K27M突变的DMG细胞系中,研究了BRD4蛋白缺失对DMG细胞增殖的影响。发现在SF8628和DIPG007中,敲除或者敲降BRD4,显著降低细胞的生长。BRD4敲低表达也抑制了DMG细胞中的克隆的形成。DMG细胞中的BRD4缺失减少了S期的BrdU阳性细胞群。这些结果都表明BRD4活性是DMG细胞增殖所必需的,并为DMG中寻找合理的治疗靶点提供了可能性。
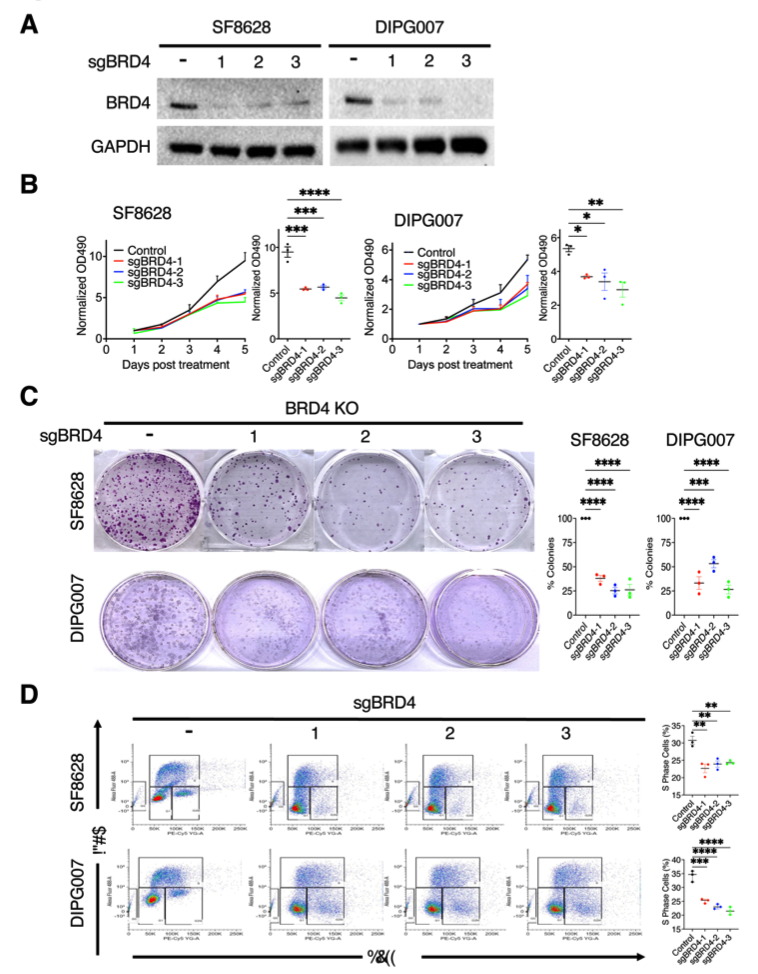
图2 敲低BRD4抑制DMG细胞的生长:(a)在蛋白质水平检测SF8628和DIPG007细胞中由sgRNAs介导的BRD4敲低效率。(b)在SF8628细胞和DIPG007细胞中,敲低BRD4,影响细胞增殖作用的生长图。(c)敲低BRD4对DMG细胞中克隆形成的影响。(d)在DMG细胞中敲除BRD4对BrdU掺入的影响。
接下来,研究人员通过药理学手段抑制BET溴域的活性,发现抑制溴结构域的活性可以减少DMG细胞的增殖。作者扩大了研究范围,以测试临床级BET溴结构域抑制剂在SF8628 DMG细胞中的疗效,包括Molibesib(I-BET762),PLX51107、BMS-986158和AZD5153。其中,AZD5153和BMS-986158对SF8628细胞显示出强大的生长抑制作用,在0.41μM和0.69μM时分别具有50%的生长抑制(IC50)值,这与JQ1的IC50值(0.50μM)相似。
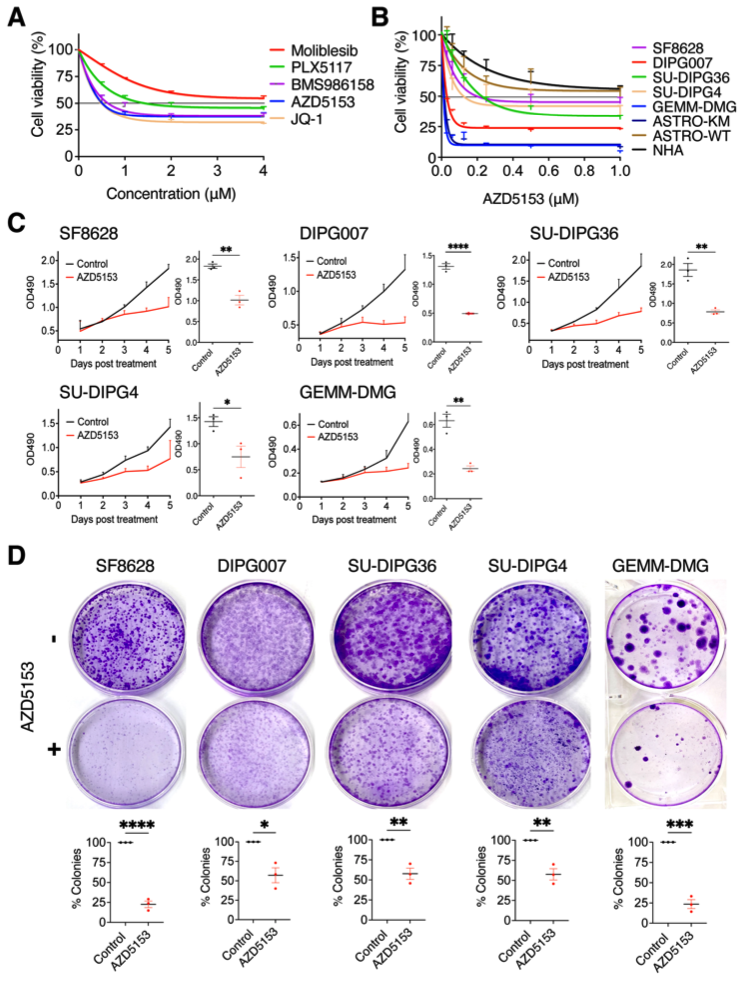
图3 溴结构域抑制剂抑制DMG细胞的生长:(a)细胞生长图显示临床级BET溴结构域抑制剂对SF8628细胞增殖的影响。(b)在AZD5153不同浓度下,DMG细胞、Astro KM、Astro WT和NHA细胞的增殖反应图。(c)DMG细胞在AZD5153(IC50值)处理下的细胞生长曲线图。(d) AZD5153(IC50值)处理对DMG细胞克隆形成的影响。
为验证BET溴结构域抑制在K27M突变的DMG细胞中的放射增敏作用,作者在三种DMG细胞系中同时用AZD5153和电离辐射(IR)处理,进行了克隆生存实验、BrdU掺入实验、Annexin V凋亡检测实验。AZD5153处理显示出辐射增强效果。与对照组相比,AZD5153治疗导致BrdU阳性S期细胞群减少,AZD5153+IR联合治疗进一步降低处于S期的细胞比例。Annexin V凋亡测定显示,与对照组相比,AZD5153或IR单药治疗增加了Annexin V阳性细胞,AZD5153+IR的联合治疗增加了Annexin V阳性细胞,优于每种单药治疗。这些结果表明,与单药治疗相比,AZD5153+IR的联合治疗通过减少耐辐射的S期细胞群和干性,以及增加DMG细胞的凋亡和衰老,进一步增加了DMG细胞的放射敏感性。
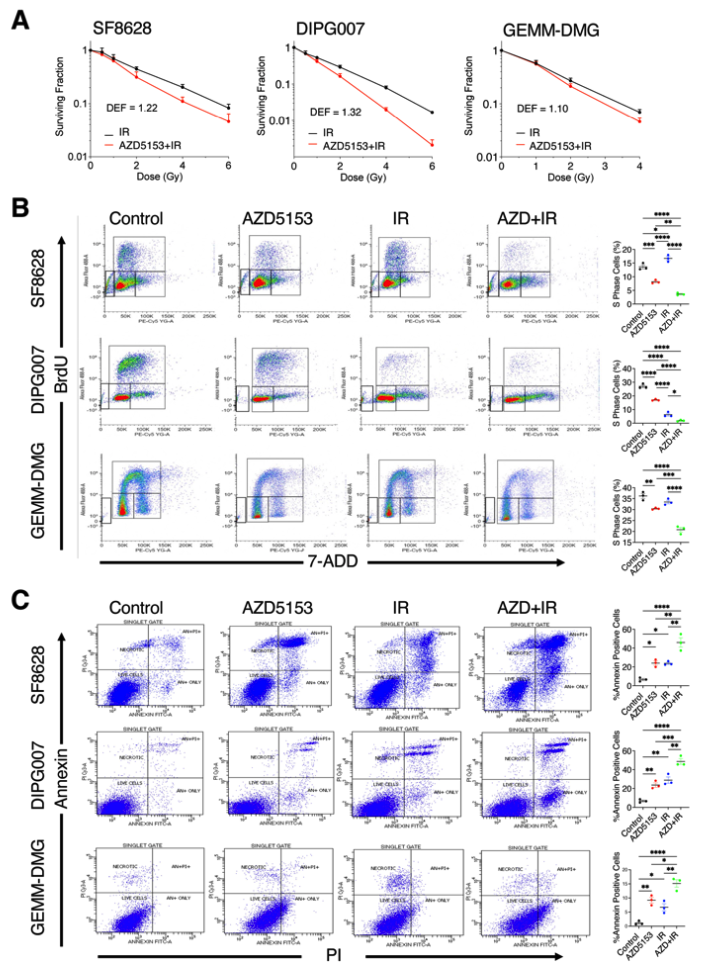
图4 溴结构域抑制剂增加了DMG细胞对放射的反应和细胞凋亡:(a)AZD5153处理K27突变的DMG细胞(SF8628、DIPG007、GEMM-DSG)12小时后,加不同剂量的电离辐射,检测细胞克隆存活率。(b)以BrdU掺入实验检测AZD5153处理对细胞增殖的影响。(c)通过检测Annenix V,分析AZD5153对细胞凋亡的影响。
作者在之前研究发现,JQ1处理可以引起K27M突变的DMG细胞中促进肿瘤生长的基因表达的变化。在本文章中,作者用BET溴结构域抑制剂(AZD5153,JQ1)处理SF8628 DMG细胞,开展RNA-seq测序并进行PCA分析。与DMSO处理的样品相比,AZD5153处理的DMG细胞中的整体基因表达发生了变化。作者将用DMSO和AZD5153处理的样品之间的RNA-seq数据与用JQ1处理的样品的RNA-seq数据相比较,差异表达基因在用JQ1和AZD5153处理的样品之间高度相关,包括3301个响应BET溴结构域抑制剂的上调和3591个下调基因。基因集富集分析(GSEA)和GO(Gene Ontology)信号通路分析显示,细胞周期(如CDK6、CDCA7和UHRF1)和DNA双链断裂(DSBs)修复途径(如BRCA1、RAD51、XRCC1、XRCC4和POLQ)是BET溴结构域抑制剂治疗中最显著下调的途径之一。AZD5153和JQ1处理还上调了参与自噬的基因途径(如ATGA4、MAP1LC3B)和分解代谢途径,包括糖酵解和蛋白质/大分子分解代谢途径(如SIRT1、MTOR)。
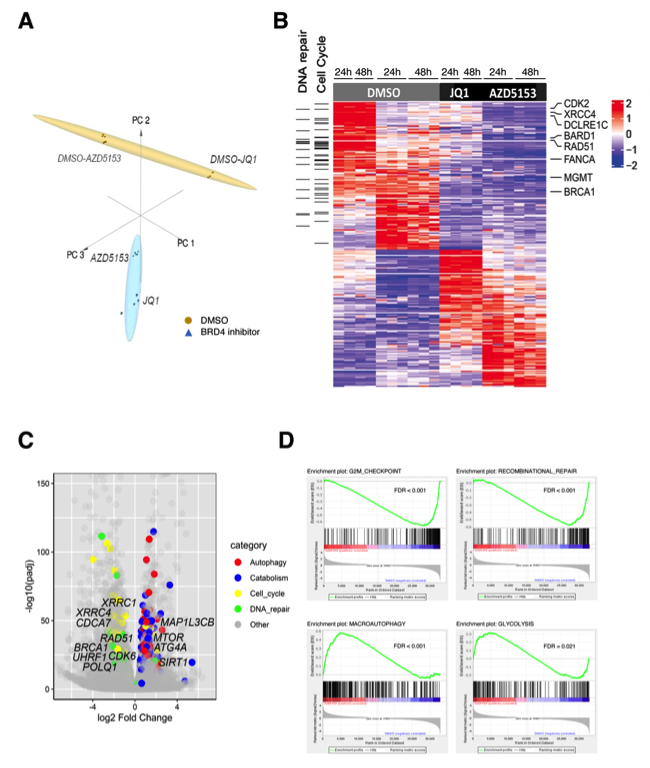
图5 溴结构域抑制改变了DMG细胞中的基因表达:(a)对DMG细胞不同处理下的RNA-seq数据进行PCA分析。(b)对RNA-seq数据进行富集分析,在不同处理下有差异表达的基因,包括DNA修复和细胞周期信号通路的相关基因。(c)对AZD5153处理过的SF8628细胞中产生的RNA-seq数据,按不同信号通路分类,并形成火山图。(d)AZD5153处理后的SF8628 DMG细胞的GSEA通路分析。
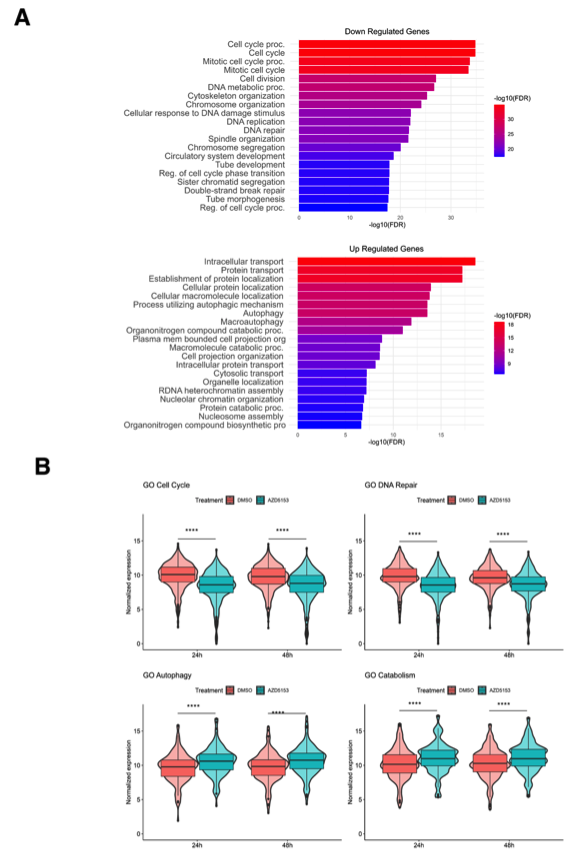
图6 溴结构域抑制改变了DMG细胞不同信号通路的基因集:(a)AZD5153处理SF8628细胞后,前20个下调信号通路(上图)和上调信号通路(下图)的GO富集分析。(b)Violin图对比不同条件下的基因表达特征,如细胞周期、DNA修复、自噬、分解代谢。
BET溴结构域抑制通过将BRD蛋白与激活的染色质组蛋白H3K27ac解离来抑制基因表达。之前的研究表明,在DMG细胞中,H3K27ac的基因组占有和BRD增强子活性是基因表达所必需的。为了确定BET溴结构域抑制对基因表达和H3K27ac占有率的影响,作者在AZD5153处理后的DMG细胞中进行了CUT&RUN实验。数据显示,大多数H3K27ac富集在内含子(第一个内含子:13.47%,其他内含子:28.97%)和基因间区域(38.8%)中发现。Meta Plot和热图显示DMG细胞中H3K27ac信号富集在增强子区域附近。AZD5153处理显著降低了增强子区域H3K27ac的占有率。与对照组相比,AZD5153处理SF8628细胞后,H3K27ac在DNA修复基因BRCA1和RAD51的峰值下降。在RNA-seq分析中,这些DNA修复基因在AZD5153处理的样品中的表达显著下调。总之,研究结果表明,BET溴结构域抑制通过减少H3K27ac在基因组中的分布比例来促进染色质的转录沉默状态,并抑制K27M突变DMG细胞中涉及DNA DSB修复的基因的表达。
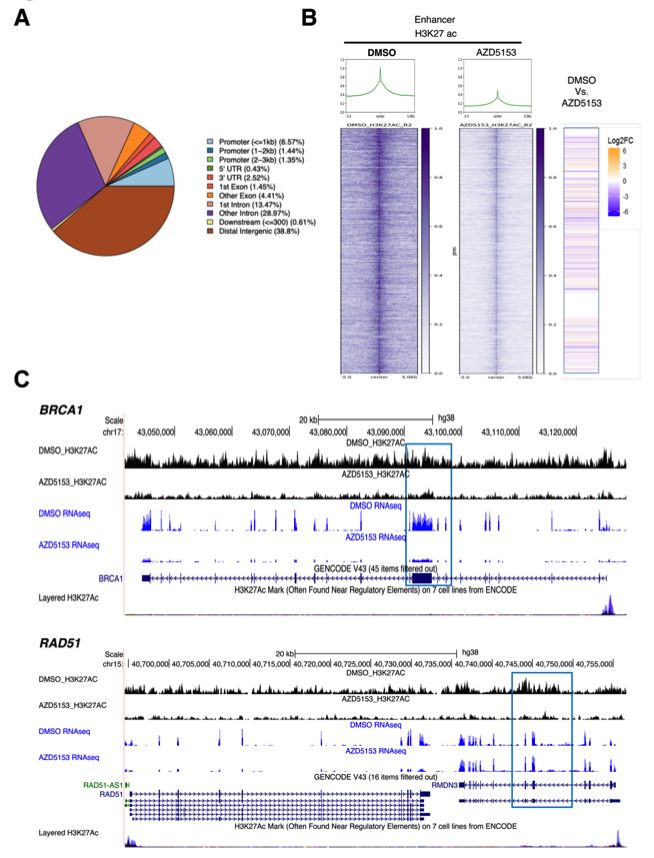
图7 溴结构域抑制改变DMG细胞中全基因组H3K37ac的占有率和基因转录:(a)饼图显示H3K27ac在DMG细胞的基因组不同位置的分布。(b)AZD5153处理细胞后,H3K27ac在启动子区分布的变化。(c)以基因BRCA1(上)和基因RAD51(下)为例,AZD5153处理细胞后,H3K27ac的分布和基因表达的基因轨迹注释图的变化。每个基因的增强子区域用正方形突出。
接下来,作者分析了BET溴结构域抑制对DMG细胞中辐射诱导的DNA损伤和修复途径的影响。在BET溴结构域抑制剂AZD5153处理下,检测DNA DSB标记物γH2AX和修复标记物53BP1的变化,以量化DMG细胞SF8628中DNA损伤和修复的程度。γH2AX和53BP1病灶在IR后1小时增加,表明IR增加了DNA DSB损伤和修复。在IR后24小时,由于成功修复了DNA损伤,这些细胞中的γH2AX或53BP1灶大大减少。然而,与单独用IR处理的细胞相比,用BET溴结构域抑制剂处理的辐照DMG细胞在24小时内保持高水平的γH2AX,同时53BPI病灶减少。类似地,彗星分析显示,IR增加了SF8628和DIPG007 DMG细胞系中彗星尾的形成,表明未修复的DNA损伤增加。与用IR单独处理的细胞相比,用AZD5153处理的辐照DMG细胞中的DNA损伤进一步增加了彗星尾的形成。这些结果表明,BET溴结构域抑制可能作用于DNA修复过程,以增强辐射诱导的DNA损伤。
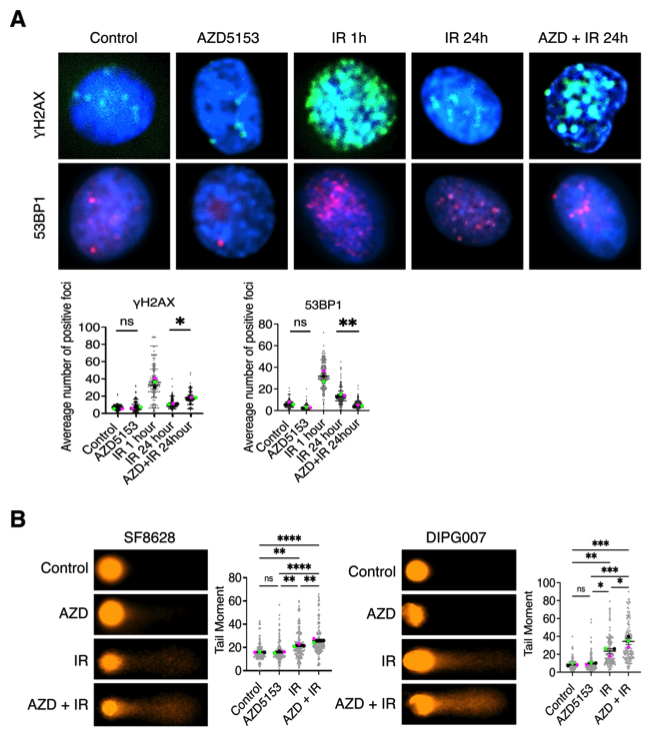
图8 溴结构域抑制增强了DMG细胞中辐射诱导的DNA损伤:(a) 在DMG细胞中,AZD5153处理对γH2AX和53BP1焦点形成的影响。(b)用AZD5153处理的DMG细胞中,碱性彗星测定的代表性图像。
蛋白质印迹显示,AZD5153处理降低了DMG细胞系中DNA修复标记物BRCA1、RAD51和XRCC1的表达。AZD5153也以剂量依赖的方式降低H3K27ac。辐射诱导的γH2X表达在辐射后1小时达到峰值。BRCA1、RAD51和RAD50的表达也由辐射诱导,并在辐射后3-6小时达到峰值。BET溴结构域抑制剂在辐射后6小时内延长了辐射诱导的γH2X表达。相反,BRCA1、RAD51和RAD50的表达随着辐射时间的推移被BET溴结构域抑制剂降低。这些结果表明,BET溴结构域抑制通过抑制DNA修复途径延长了辐射诱导的DNA损伤信号传导。
DNA损伤主要通过两个途径修复;同源重组(HR)和非同源末端连接(NHEJ)修复。HR在S期和G2期修复DNA DSB,并为无错误修复提供模板;NHEJ在整个细胞周期中都有活性,并且直接涉及DNA末端的连接而没有同源性。作者分析了DMG细胞中的DNA损伤修复途径,AZD5153处理细胞通过HR和NHEJ DNA修复途径降低了DMG细胞中的DNA修复能力,这与RNA-seq结果一致,AZD5153下调了参与HR和NHEJ修复途径的基因。总之,在K27M突变的DMG细胞中,BET溴结构域抑制通过抑制HR和/或NHEJ DNA修复途径增加了辐射诱导的DNA损伤。
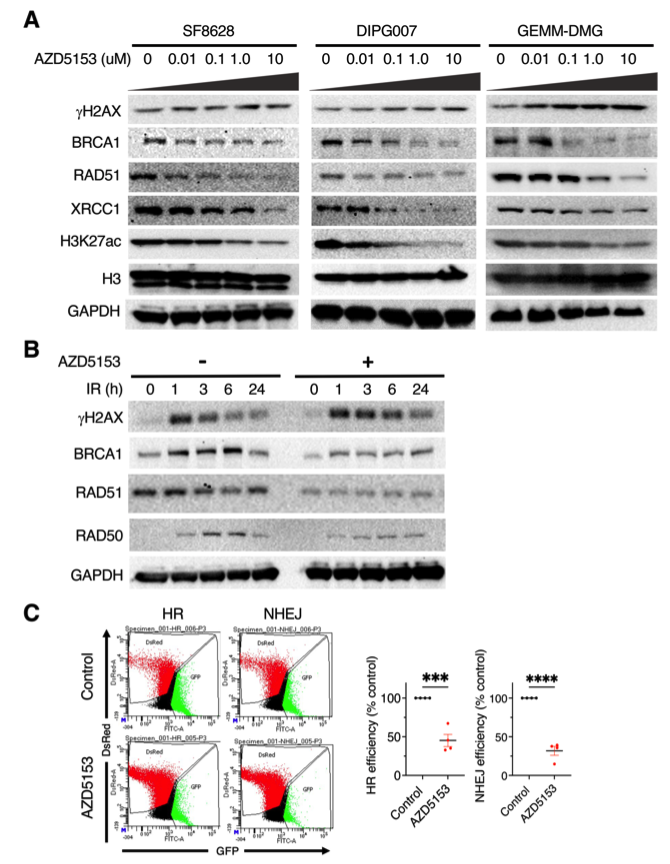
图9 在DMG细胞中溴结构域抑制剂处理,可诱导DNA损伤并抑制DNA修复:(a) AZD5153处理细胞,以Western blot检测DNA修复标记物(BRCA1、RAD51和XRCC1)和DNA损伤标记物(γH2AX)、H3K27ac、GAPDH、H3,在细胞内的表达变化。(b)AZD5153处理DMG细胞后,以Western blot检测相应蛋白的表达随照射时间的变化。(c)AZD5153处理,对DMG细胞中DNA修复信号通路HR和NHEJ的影响。
基于BET溴结构域抑制对K27M突变的DMG细胞的放射增敏作用,作者接下来检测了在DMG小鼠模型中,BET溴构域抑制是否会增加辐射抗肿瘤活性和小鼠的生存期。将SF8628或GEMM-DMG细胞植入小鼠脑桥,并用AZD5153(50mg/kg)或JQ1(30mg/kg)处理两周,辐射总剂量为9 Gy(每天1.5 Gy,每周3天,持续2周)。在SF8628 DMG PDX小鼠模型中,BET溴结构域抑制剂给药,抑制了肿瘤生长并延长了小鼠的生存期,AZD5153、JQ1和放射治疗(RT)的联合治疗显著延长了动物的生存期。
在治疗结束时对小鼠实施安乐死,获得脑干肿瘤样本,分析肿瘤细胞的增殖(Ki-67)、凋亡(TUNEL)。肿瘤内Ki-67染色分析显示,与对照组相比,所有疗法都显著减少了SF8628 DMG细胞的增殖。与任一单药治疗相比,联合治疗的样本中Ki-67阳性细胞显著减少,联合治疗的小鼠肿瘤中凋亡阳性细胞比例最高,而小鼠肿瘤周围的正常脑细胞没有明显的TUNEL阳性。
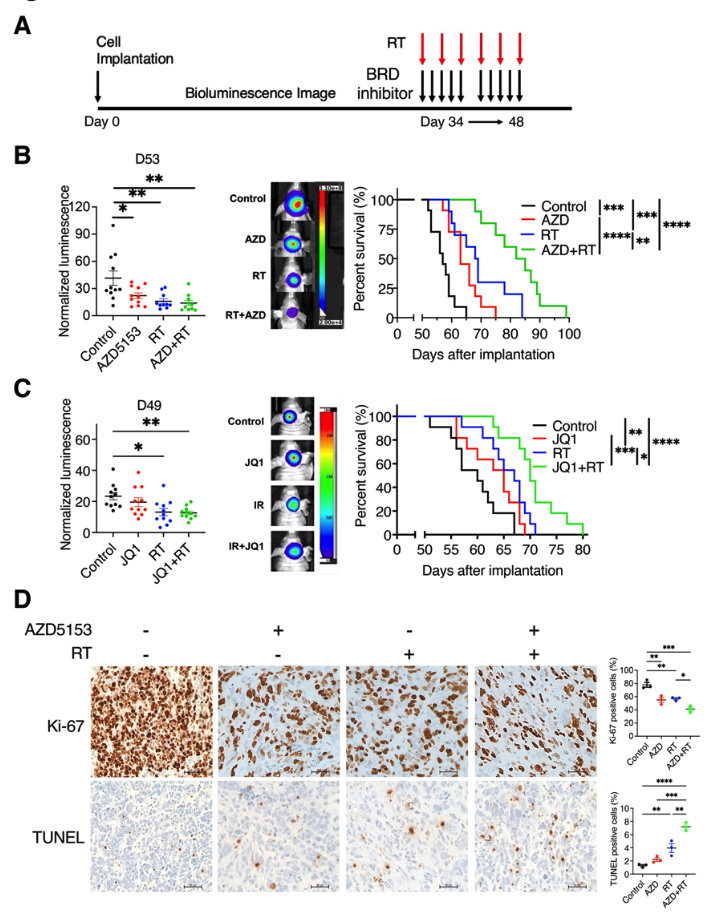
图10 在DMG-PDX模型中,溴结构域抑制增强了辐射抗肿瘤活性:(a)溴结构域(BRD)抑制剂与放射治疗(RT)联合应用于DMG动物模型体内疗效研究的实验设计。(b,c)将DMG-PDX小鼠随机分为四个治疗组:对照组、单独的AZD5153或JQ1、单独RT和AZD5153+RT或JQ1+RT,左图:第53天(AZD试验)和第49天(JQ1试验)的生物发光值的点图表示。右图:每种治疗的相应存活图。(d)治疗结束时,小鼠颅内肿瘤用Ki-67和TUNEL染色。
总之,文章讨论了BET溴结构域(Bromodomain and Extra-Terminal domain, BET)抑制剂在增强H3K27突变的中线弥漫性胶质瘤模型对放射治疗敏感性方面的作用。研究表明BET溴域抑制剂可以通过调节肿瘤细胞的基因表达,使其对放射治疗更加敏感,从而提高放疗的效果,为这种致命性脑肿瘤提供了一种新的潜在治疗策略。该研究结果为将BET溴域抑制剂应用于临床治疗H3K27M突变的中线弥漫性胶质瘤提供了强有力的理论依据和实验数据支持。未来的临床试验将进一步验证这种联合治疗策略的安全性和有效性。


