JAMA Oncol | 新辅助阿替利珠单抗联合化疗放疗治疗不可切除性 III 期 NSCLC 的疗效和安全性
时间:2024-07-28 18:00:14 热度:37.1℃ 作者:网络
对于不可切除的 III 期 NSCLC 患者,传统的化疗放疗方案 (CRT) 治疗效果有限,5 年生存率约为 15%,PACIFIC 试验证实了辅助性度伐利尤单抗在 CRT 后的疗效,将 5 年生存率提高了约 10%,然而,该研究仅纳入了CRT 后病情稳定且无进展的患者,新的研究表明,在 CRT 前给予免疫检查点抑制剂 (ICI) 可能会提高更多患者的疗效,该研究旨在评估在不可切除的 III 期 NSCLC 患者中,在 CRT 前后给予阿替利珠单抗治疗的安全性及有效性。

方法
该研究是一项单队列、II 期、非随机对照试验,纳入了病理确诊的不可切除性 III 期非小细胞肺癌 (NSCLC) 患者,ECOG 体能状态良好 (0-1 分), 具有可测量疾病,患者接受新辅助治疗: 4 个周期的阿替利珠单抗 (1200 mg,静脉注射,每 21 天一次); 化疗放疗: 阿替利珠单抗完成后,进行放疗 (60 Gy,照射野) 联合每周卡铂 (曲线下面积 2) 和紫杉醇 (50 mg/m²),随后进行巩固化疗 (卡铂曲线下面积 6 和紫杉醇 200 mg/m²,每 21 天一次,共 2 个周期) ;辅助治疗: 放疗完成后,继续使用阿替利珠单抗 (1200 mg,每 21 天一次) 完成 1 年的治疗。主要终点为12 周疾病控制率 (DCR), 次要终点为无进展生存期 (PFS) 、总生存期 (OS)、 客观缓解率 (ORR)和 安全性。
研究结果
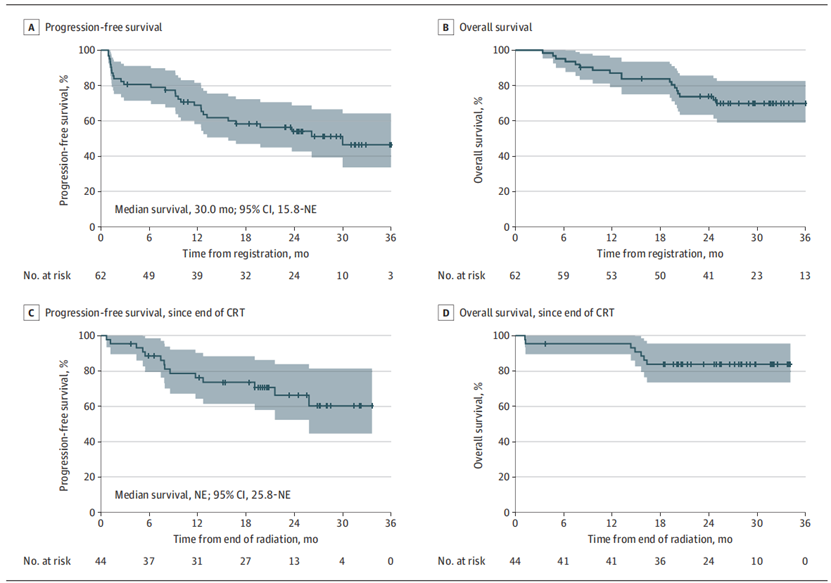
75.8% 的患者完成了新辅助治疗,71.0% 的患者完成了化疗放疗,41.9% 的患者完成了所有研究治疗。新辅助治疗 12 周后的 DCR 为 74.2%,客观缓解率 (ORR) 为 66.2%,中位无进展生存期 (PFS) 为 30.0 个月,中位总生存期 (OS) 未达到,24 个月生存率为 73.7%。
安全性分析
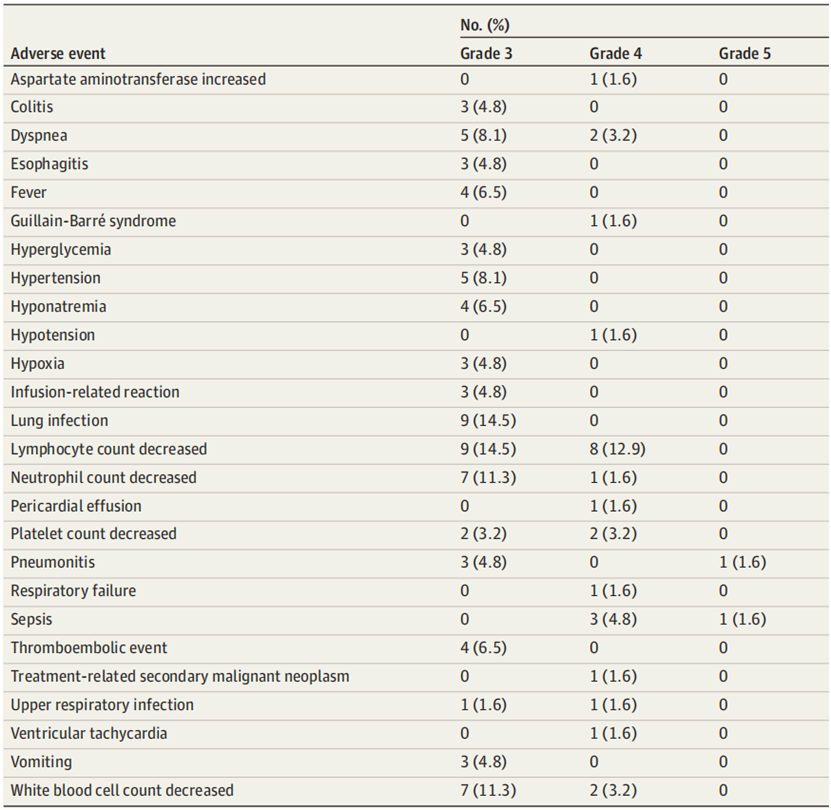
27.4% 的患者出现 3 级或更高的免疫相关不良事件,包括 1 例 5 级肺炎和 1 例 4 级吉兰-巴雷综合征,48.4% 的患者出现 3 级或更高的治疗相关不良事件,12 名患者因不良事件停止治疗。
结论
这项 II 期非随机对照试验表明,新辅助阿替利珠单抗在不可切除性 III 期 NSCLC 患者中具有良好的安全性,并显示出令人鼓舞的疗效,未来需要开展随机对照试验,进一步验证新辅助阿替利珠单抗的疗效和安全性。
原始出处
Ross HJ, Kozono D, Wang XF, et al. Atezolizumab Before and After Chemoradiation for Unresectable Stage III Non–Small Cell Lung Cancer: A Phase II Nonrandomized Controlled Trial. JAMA Oncol. Published online July 25, 2024. doi:10.1001/jamaoncol.2024.1897.


