Bone Res:南方医科大学黄文华等团队合作发现基质硬化促进软骨细胞衰老和骨关节炎发展的作用机制
时间:2024-08-01 17:00:52 热度:37.1℃ 作者:网络
细胞外基质(ECM)硬化是软骨老化的典型特征,是膝关节骨关节炎(KOA)的典型特征。然而,人们对ECM硬化如何影响软骨细胞和下游其他分子知之甚少。
2024年5月24日,南方医科大学黄文华和西南医科大学刘欢共同通讯在Bone Research 在线发表题为“Matrix stiffening promotes chondrocyte senescence and the osteoarthritis development through downregulating HDAC3”的研究论文,该研究使用聚二甲基硅氧烷(PDMS)基质模拟了人类软骨的生理和病理僵硬。结果表明,组蛋白去乙酰化酶3(HDAC3)对Parkin的表观遗传调控代表了一种新的机械敏感机制,通过这种机制,僵硬基质影响软骨细胞生理。
该研究发现ECM硬化加速了体外培养的软骨细胞衰老,而僵硬的ECM下调了HDAC3,促使Parkin乙酰化激活过度的线粒体自噬,并加速小鼠的软骨细胞衰老和骨关节炎(OA)。相反,关节内注射表达HDAC3的腺相关病毒可恢复由ECM硬化刺激的老化软骨细胞的年轻表型,并减轻小鼠的OA。研究结果表明,机械ECM特性的变化启动了致病的机械传导信号,促进了Parkin乙酰化和线粒体自噬过度活跃,并损害了软骨细胞的健康。这些结果可能为ECM的机械特性对软骨细胞的调节提供新的见解,表明改变物理ECM特性可能是一种潜在的OA治疗策略。

骨关节炎(OA)是最常见的与年龄相关和创伤后退行性关节疾病。全球膝骨关节炎(KOA)患者超过3亿,预计到2030年将成为全球致残率最高的疾病。虽然大部分病因仍在研究中,但高龄和机械超负荷被认为是OA发展的两个最重要危险因素。人体所有细胞都会受到机械影响。关节软骨尤其如此,因为它的主要作用是将力量传递到下面的骨头并减少关节内的摩擦。适当的机械负荷对关节软骨的健康至关重要,而机械超负荷会导致关节软骨的退行性病变,从而导致OA的发生和发展。
然而,机械超负荷在软骨退行性病变中的作用的具体机制仍不清楚。这部分是由于几个因素造成的。(1)目前研究的OA力学模型是否能够概括人类疾病还存在认识上的差距。迄今为止,大多数力学研究都采用了软骨细胞的压缩、拉伸和剪切力模型,而对OA患者日常静息状态下软骨细胞的应力探索有限;(2)对驱动疾病发展的分子机制的认识尚不完整,尤其是对于KOA。KOA的特点是细胞与其所在的细胞外基质(ECM)之间相互干扰,导致合成代谢和分解代谢失衡。大多数情况下没有明显的诱发事件。
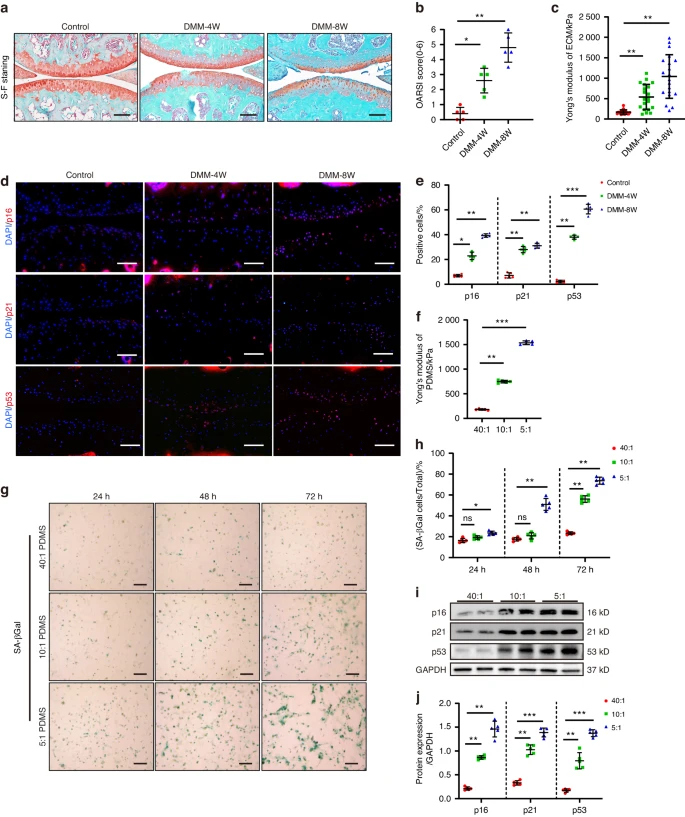
ECM硬化诱导体外和小鼠体内软骨细胞衰老(图源自Bone Research )
软骨的主要成分是软骨细胞及其ECM。它们对于维持软骨稳态至关重要,但在与OA相关的功能障碍软骨中,它们经常受到损害。先前的研究表明,关节老化中上调的晚期糖基化终产物(AGE)和软骨损伤中增加的赖氨酰氧化酶(LOX)均加速了体外基质的硬化,这是由于基质交联和糖胺聚糖(GAG)的损失。事实上,已经证明基质硬度可以直接调节体外细胞的行为和表型。由于软骨细胞是关节软骨中唯一的细胞类型,因此当它们表现出代谢功能障碍时会导致软骨损伤。OA软骨病变显示出比年轻、健康软骨更高的衰老软骨细胞水平,这表明软骨细胞衰老与OA严重程度之间存在很强的相关性。有趣的是,从小鼠关节中去除衰老细胞不仅可以防止疾病进展,还可以维持组织结构。然而,ECM硬度在软骨细胞衰老和骨关节炎进展的调控机制尚不明确。此外,骨关节炎软骨细胞中与ECM僵硬直接相关的特定分子靶点尚未发现。因此,需要进行研究以确定ECM僵硬刺激下的软骨细胞表型以及维持软骨稳态的分子靶点。
在本研究中,作者试图阐明ECM的生物力学和软骨细胞机械转导在OA的启动和进展中的作用。鉴于ECM-细胞接触的即时性,作者假设ECM僵硬是OA启动的最早事件之一,从而导致软骨细胞的机械调节。因此,ECM僵硬在损伤后的明确时间范围内发生变化,并研究其软骨细胞表型调节。作者发现ECM硬化会刺激软骨细胞和关节软骨的衰老,并确定组蛋白去乙酰化酶3(HDAC3)是基质硬化调节软骨细胞衰老表型的关键因素。基质硬化会下调HDAC3,从而激活磷酸酶和张力蛋白同源物诱导激酶1(PINK1)和Parkin(PINK1/Parkin)介导的线粒体自噬,从而刺激软骨细胞衰老并加速骨关节炎的发生和发展。针对HDAC3或PINK1/Parkin信号传导可能代表一种治疗OA的新方法。
参考消息:
https://www.nature.com/articles/s41413-024-00333-9


