eGastroenterology:基于空间转录组学揭示HBV及其与HDV和HIV共感染的生物学特征
时间:2024-08-06 12:01:02 热度:37.1℃ 作者:网络
导读
作为一种全球性疾病,全球约有2.57亿人感染慢性乙型肝炎(chronic hepatitis B,CHB),并且每年约80多万人因此死亡。该病主要由乙型肝炎病毒(hepatitis B virus,HBV)感染所致,而HBV和丁型肝炎病毒(hepatitis delta virus,HDV)或艾滋病毒(human immunodeficiency virus,HIV)合并感染会导致严重的病毒性肝炎,极大提高相关死亡风险。目前,关于HBV与HDV和HIV共感染的生物学特征目前尚不清楚。
近日,来自剑桥大学和英国伦敦大学学院的科研团队在eGastroenterology上发表了,题为“Characterisation of HBV and co-infection with HDV and HIV through spatial transcriptomics”的原创研究,该研究首次利用空间转录组技术解析HBV及其与HDV和HIV共感染的生物学特征。

研究背景
乙型肝炎病毒(hepatitis B virus,HBV)感染是一个全球性的健康问题,据统计,全球约有2.57亿人感染HBV。尽管有有效的疫苗和抗病毒药物可供使用,但慢性乙型肝炎(chronic hepatitis B,CHB)仍然是导致肝硬化和肝细胞癌的主要原因之一。当前CHB治疗方法包括核苷(酸)类似物,可抑制病毒复制,但很少能清除感染。除此之外,HBV和丁型肝炎病毒(hepatitis delta virus,HDV)或艾滋病毒(human immunodeficiency virus,HIV)的共感染会增加肝脏疾病的进展和死亡风险。因此迫切需要新的和/或个性化治疗策略来治疗CHB。近年来,单细胞测序和空间转录组学等高通量技术的发展为深入研究HBV感染提供了新的工具。然而,目前关于HBV及其与HDV和HIV共感染的生物学特征还知之甚少。因此,Upkar S Gill教授和Dimitra Peppa教授团队首次利用空间转录组学技术,探究CHB患者及其与HDV或HIV共感染状态下肝脏内的基因表达模式和细胞类型分布,识别与HBV感染及其共感染状态相关的特定细胞类型和生物功能,以其为理解疾病发病机制和开发新的治疗策略提供新的线索。
研究材料与方法
本研究分析了三名患者的福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded,FFPE)的肝活检样本:(1)1位慢性HBV患者(PT1);(2)1位HDV/HBV共感染患者(PT2);(3)1位HIV/HBV共感染患者(PT3)。每位患者都进行肝脏活检,由病理学家根据Ishak评分标准评估纤维化程度和肝炎活动指数。研究者利用NanoString GeoMx数字空间分析(digital spatial profiling,DSP)平台评估肝组织的基因表达情况。整个分析包含如下五部分:(1)质量控制和标准化;(2)主成分分析;(3)过表达分析;(4)细胞反卷积;(5)加权基因共表达网络分析(weighted gene correlation network analysis,WGCNA)。具体的方法和参数请参见原文。
小知识1:何为Ishak评分?
1. Ishak评分,也被称为Ishak纤维化评分系统,是一种用于评估慢性肝炎患者肝纤维化程度的评分系统。该系统通过病理学检查,对肝脏组织的纤维化程度进行分级。
2. Ishak评分系统通常将肝纤维化程度分为0到6级,具体如下:0级:无纤维化; 1级:扩大化的汇管区纤维化,无小叶内间隔形成;2级:汇管区周围纤维化,伴有少数小叶内纤维间隔形成,但无桥接纤维化;3级:汇管区周围纤维化及小叶内间隔形成,有桥接纤维化,但无肝硬化;4级:肝硬化,可能伴有门静脉高压,但无肯定的门静脉高压证据;5级:肯定的肝硬化,伴有门静脉高压,有或无食管胃底静脉曲张,但无腹水;6级:肝硬化,伴有腹水或食管胃底静脉曲张出血等失代偿表现。
3. 根据Ishak评分结果,医生可以判断患者的肝纤维化程度,从而决定是否需要进行抗病毒治疗、抗纤维化治疗或其他干预措施。该评分有助于评估患者的长期预后,为制定随访计划提供依据。
研究参与者具有与病毒和免疫特征相关的离散空间特征
该研究比较了三名CHB未经治疗患者的FFPE肝组织:HBV单一感染(PT1);HDV/HBV共感染(PT2)和HIV/HBV共感染(PT3)。PT1在HBeAg-慢性肝炎阶段,ALT和HBV DNA水平波动。PT2未治疗的HBV/HDV共感染18年,有HBeAg+慢性肝炎,中度HBV DNA和HDV RNA水平,以及提示肝硬化转变和中度炎症的证据。PT3 HIV/HBV共感染诊断1年前,有HBeAg+慢性肝炎,ALT水平波动,并伴有明显炎症和保留的肝脏结构。在每位患者的活检样本中选定的感兴趣区域(ROI)中评估免疫浸润和HBsAg表达(见图1A–C)。ROI平均大小为96,871 μm²(±44,284 μm² SD),估计平均核数为412(±238 SD),显示出优异的测序质量和整个基因组图谱/管家基因转录物的最小变异。
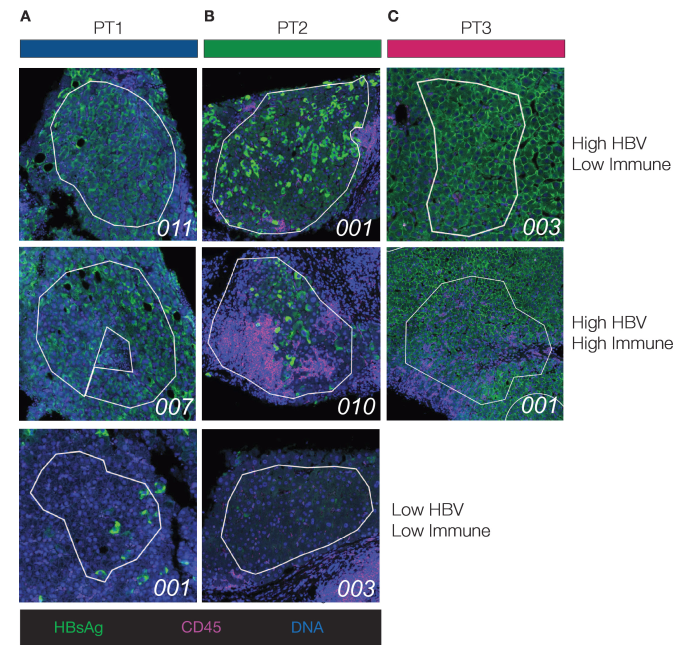
图1:该图表示感兴趣区域(ROIs)及其分类。展示了来自每位患者的代表性ROIs的多重免疫荧光图像(A-C)。根据乙型肝炎病毒(HBV)表面抗原(HBsAg)+和CD45+细胞的丰度,将区域分类为HBV或免疫浸润的“低”或“高”。此分类用于所有下游分析。在每幅图像的左下角,标注了ROI标识符。在患者(PT)3中,存在广泛的HBsAg染色,未识别到HBsAg低区域。
来源:原文图1
小知识1:医学研究中的ROI是什么?
1. 在科研中,ROI通常指的是“感兴趣区域”(Region of Interest)。这一概念主要应用于机器视觉、图像处理以及生物学、医学等科研领域。
2. 在生物学和医学研究中,ROI同样指代研究者特别关注的区域。例如,在空间转录组学研究中,ROI可能是空间上的某亚群、亚群的边界区域、某基因(集)集中表达的区域、轨迹及其沿途区域,或者是H&E(苏木精-伊红染色)或荧光染色下有特征的区域。这些区域的选择往往基于研究者的研究目的和假设,旨在深入探讨这些区域的生物学特性或功能。
3. ROI的选择并不是随意的,而是基于研究者的知识储备和研究目的。一个区域之所以被选为ROI,往往是因为它更接近研究者的研究目标,或者包含了研究者特别关注的信息或特征。ROI的目的论本身也反映了在选定之前它不是一个恒定的区域,可能会随着研究的深入和目的的变化而发生改变。
差异基因表达识别患者内的免疫活跃特征
研究者对在空间异质性HBsAg表达区域中的途径进行了差异表达分析(见图2A,B)。未观察到HBsAg+区域与HBsAg-区域之间的差异表达基因(differentially expressed genes,DEGs),表明当前样本数量不足以捕获肝脏中由病毒诱导的细微变化。因此,研究人员评估了未对多重比较进行校正的DEGs,以识别可能受HBV感染影响的潜在基因候选者。
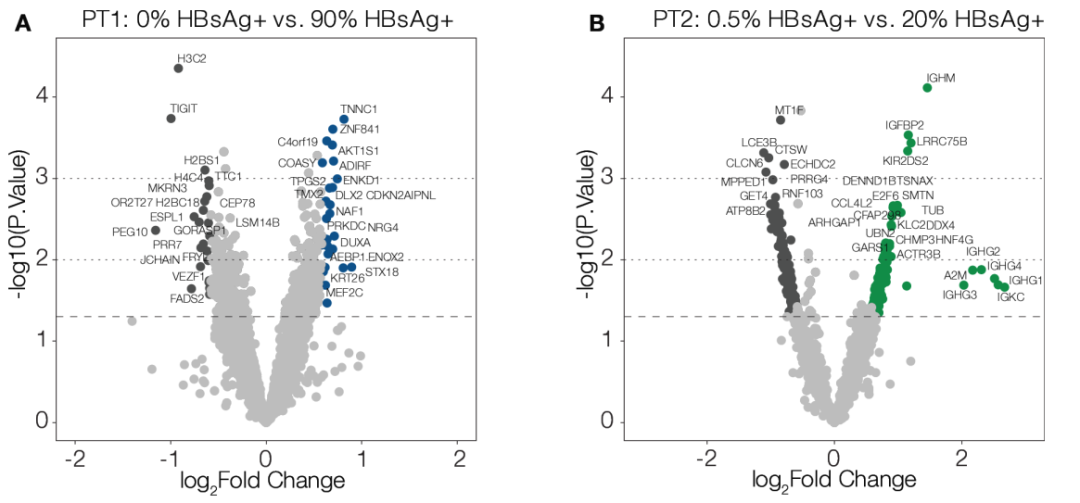
图2:该图表示HBV表面抗原(HBsAg)表达高低区域之间的转录差异很小。每组ROI的HBsAg+细胞阳性率的视觉评估结果显示在每位患者活检样本的差异基因表达之上:患者(PT)1(A)和PT2(B)。比较了患者相对低和高HBsAg蛋白表达区域。显示了未调整的p值;经多重比较调整后,无p值低于0.05。从上到下,水平虚线分别表示p=0.001、0.01和0.05。
来源:原文图3
探索与免疫细胞浸润相关的基因富集
在PT1中,CD45+区域显示出与免疫球蛋白重链保守区相关的基因上调(IGHG1,IGHG2,IGHG3,IGHG4),这是所有样本测试免疫丰富区域的共同特征。PT2的特征是额外富集与病毒感染和凋亡过程调控相关的基因(USP17L3,USP17L15,USP17L17,CASP1),以及细胞处理/主要组织相容性复合体(MHC)II类呈递(CD74,HLA-DQB1)和趋化因子基因(CXCL9,CCL19),涉及炎症反应。PT3(HIV/HBV共感染)的免疫丰富区域显示出MHC II类基因(HLA-DQB1,HLA-DRB1)的上调,包括经典和非经典MHC I类基因(HLA-B,HLA-A,HLA-E,HLA-F)。
分析区域内细胞表型的独特分布以及无偏评估组织中的多样转录组模式
为了评估宿主免疫反应的组成,研究者基于人类肝脏细胞图谱的单细胞测序数据训练矩阵,对分析区域内存在的细胞表型进行了无偏分析,解析了反卷积基因表达模式。估计的不同细胞类型的比例显示肝细胞和非实质细胞的贡献,免疫细胞分布在高免疫区域/HBsAg+区域。
最后,研究者使用WGCNA确定了8个共表达基因模块(每个模块包含157–2280个基因)。每个组织显示出独特的转录特征和模块特征关系(见图3A,B)。PT1(HBeAg-)以全组织表达棕色模块为特征,与肝细胞功能和代谢相关,包括脂肪酸、胆固醇代谢过程、脂质分解代谢和有氧呼吸。PT2(HDV/HBV共感染,HBeAg+;高纤维化)显示出全组织表达与核糖体转录物富集的蓝绿色模块。PT3(HIV/HBV共感染;HBeAg+)以与B细胞介导的免疫和吞噬作用相关的红色模块为特征。
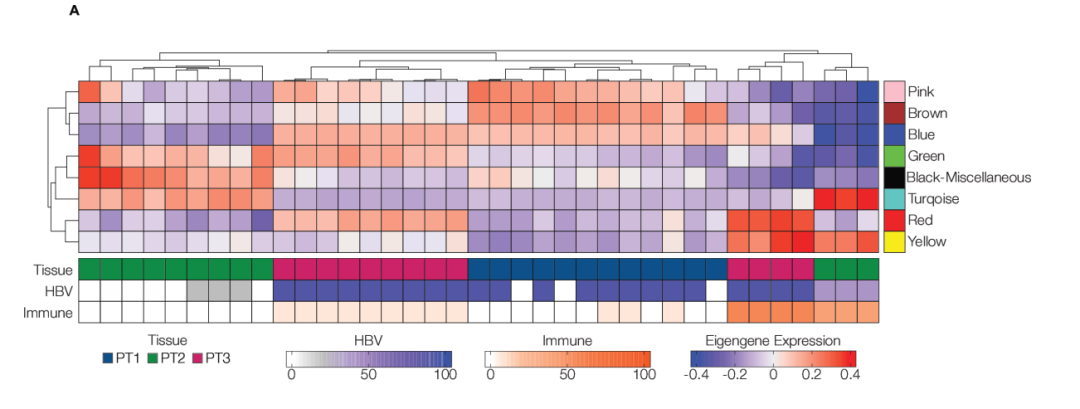
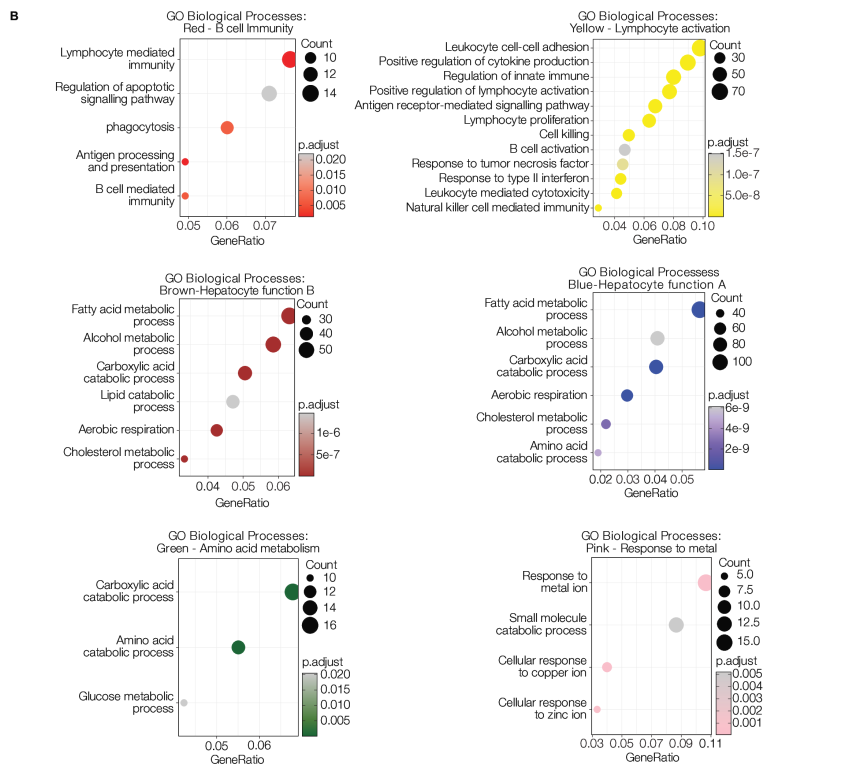
图3:该图表示慢性乙型肝炎(CHB)活检样本中的不同转录组特征。通过WGCNA得到的每个模块(n=8)的特征基因表达。特征基因表达由估计的每组ROI和组织来源的HBsAg+和CD45+细胞频率进行注释(A)。对共表达基因的彩色标记模块进行了GO富集分析,其中6/8个模块富集于已知的GO通路(B)。
来源:原文图6
该研究首次应用空间转录组学技术,详细分析了HBV及其与HDV和HIV共感染患者肝内的复杂生物学过程。通过NanoString GeoMx数字空间分析平台,研究者生成了高分辨率的空间图谱,揭示了不同感染状态下肝脏基因表达的空间异质性。
研究发现,HDV/HBV共感染患者肝内与凋亡过程和免疫细胞招募相关的基因上调,而HIV/HBV共感染患者则表现出与B细胞介导的免疫和吞噬作用相关的基因上调。这些发现不仅突出了空间转录组学在探索疾病发病机制方面的实用性,还确定了不同感染状态下的共性和特性。同时,此研究还揭示了不同感染状态下肝细胞功能和代谢途径的转录差异,这对理解HBV感染及其共感染的发病机制具有重要意义。特别是,HDV/HBV共感染样本中核糖体活动相关基因的上调可能与HBsAg诱导的内质网应激信号通路激活有关,这可能进一步影响肝细胞的存活和恶性转化。
此外,我们也需要注意到此研究的局限性,包括样本量较小和未关注的HBcAg的表达等。因此,未来的研究应扩展至更大的队列,并结合多组学方法和更精细的空间分辨率技术,以更全面地理解HBV及其共感染的发病机制,并开发新的个性化治疗策略。同时,我们也建议未来的研究进一步探索空间转录组学在识别纤维化相关基因和途径方面的应用,以及HBV感染对肝内免疫细胞亚群的具体影响。
最后,该研究对我们深入理解HBV及其与HDV和HIV共感染的生物学特征提供了基础,同时该研究采用的相关技术也值得应用于后续更进一步的慢性肝病的研究中。
引证本文
Cross A, Harris JM, Arbe-Barnes E, et al. Characterisation of HBV and
co-infection with HDV and HIV through spatial transcriptomics. eGastroenterology 2024;0:e100067. doi:10.1136/egastro-2024-100067
https://egastroenterology.bmj.com/content/2/3/e100067


