西南大学明建教授/许志刚教授ACS Materials Letters:姜黄素与光热剂共递送的纳米平台发挥协同抗肿瘤作用
时间:2024-08-09 19:00:25 热度:37.1℃ 作者:网络
光热治疗(PTT)因其无创性、对正常组织毒性低、治疗效率高而成为一种有前景的肿瘤治疗策略。然而,PTT通过破坏肿瘤细胞的完整性,诱导细胞坏死和凋亡从而释放细胞内容物,这会促进巨噬细胞募集和促炎细胞因子分泌,加速肿瘤转移和发展。此外,PTT产生的光热效应会导致生物体热休克蛋白(HSPs)的过表达,从而增强肿瘤细胞的耐热性,限制PTT的疗效。
环氧化酶-2(COX-2)是催化前列腺素生物合成的关键酶,在核转录因子-κB(NF-κB)活化调控的炎症级联反应中发挥重要作用。高水平的COX-2与炎症和癌症进展相关。PTT已被证可进一步促进肿瘤细胞中的NF-κB和COX-2的上调,以激活基质金属蛋白酶-9(MMP-9)来降解细胞外基质,促进肿瘤转移。姜黄素(Cur)是一种从姜黄中提取的植物多酚类化合物,具有多种生物活性,对人体的副作用很小。它可以通过下调NF-κB介导的信号通路来抑制肿瘤细胞转移和炎症反应。此外,Cur是一种典型的HSP-70抑制剂。鉴于这些特性,将Cur与PTT联合是一种有前途的策略,以增强光热消融和减弱PTT诱导的炎症反应。
基于以上背景,本研究利用多活性小分子姜黄素(Cur)和二区光热剂IR-1061自组装制备了一种无载体纳米颗粒(CI-NPs),以实现协同抗肿瘤作用。相关工作以“Self-Assembled Chemo/Photothermal Nanoplatform for Enhanced Cancer Therapy: Sensitizing Photothermal Ablation and Reprogramming Inflammatory Microenvironment”为题发表在ACS Materials Letters。已毕业2019级博士研究生陈媛媛为论文第一作者,西南大学食品科学学院明建教授和材料与能源学院许志刚教授为共同通讯作者。
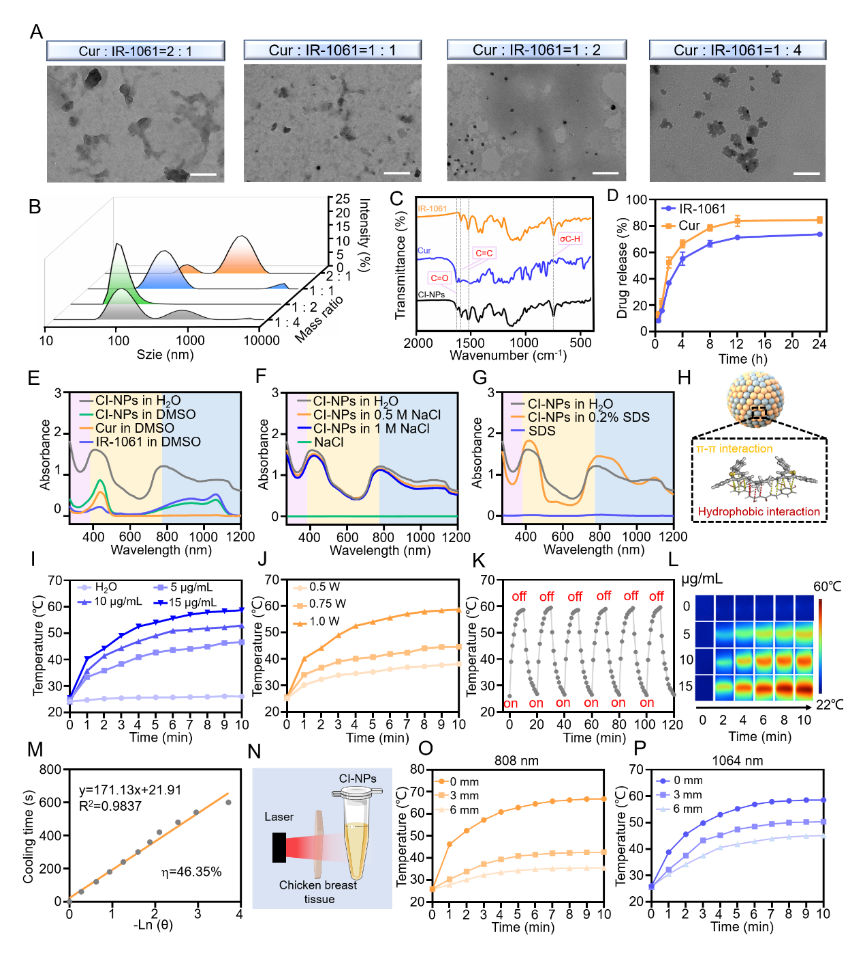
图1 CI-NPs的表征与体外光热性能
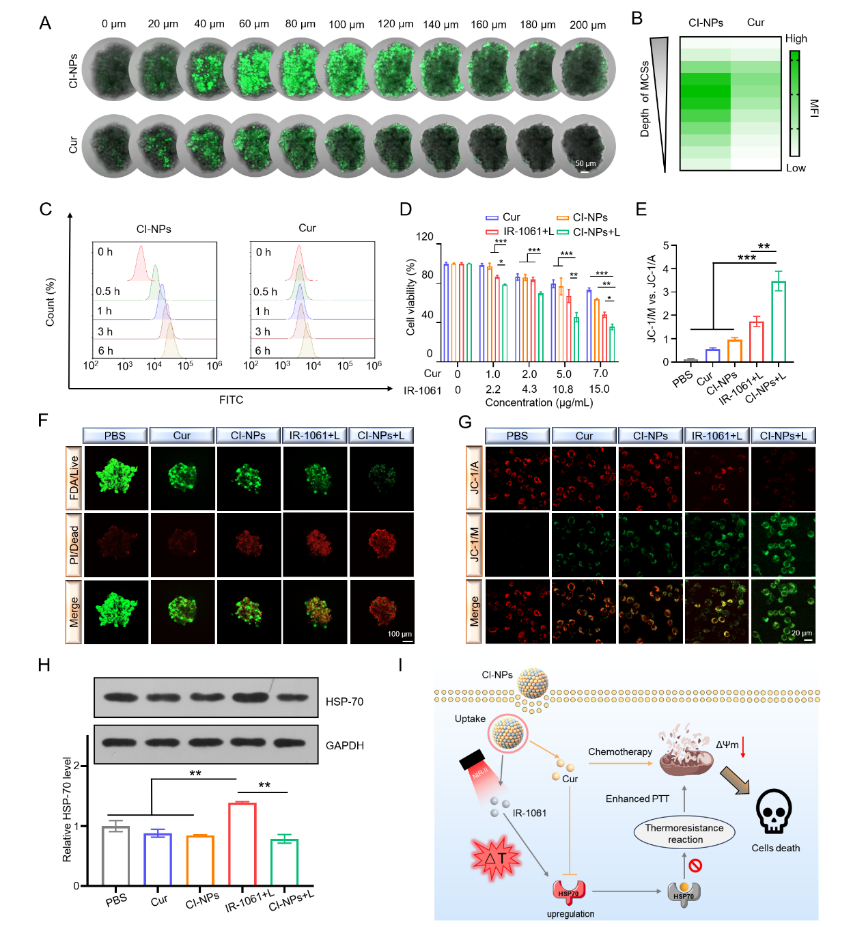
图2 CI-NPs的细胞摄取及毒性机制
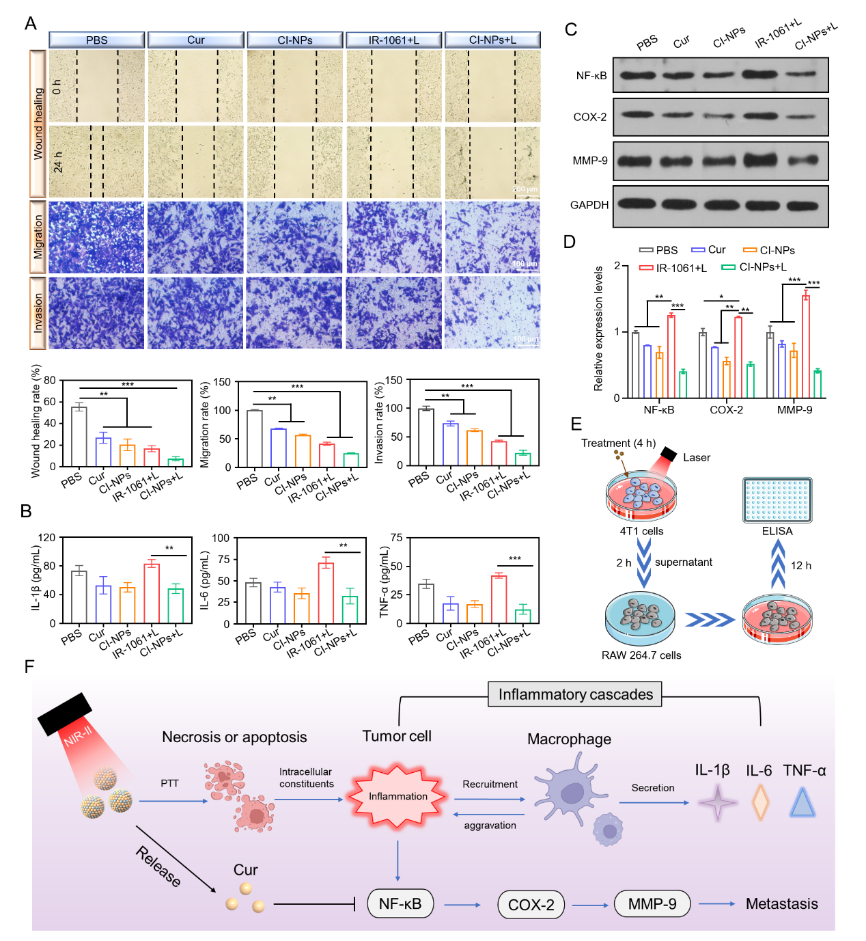
图3 CI-NPs体外抗转移和抗炎作用及机制
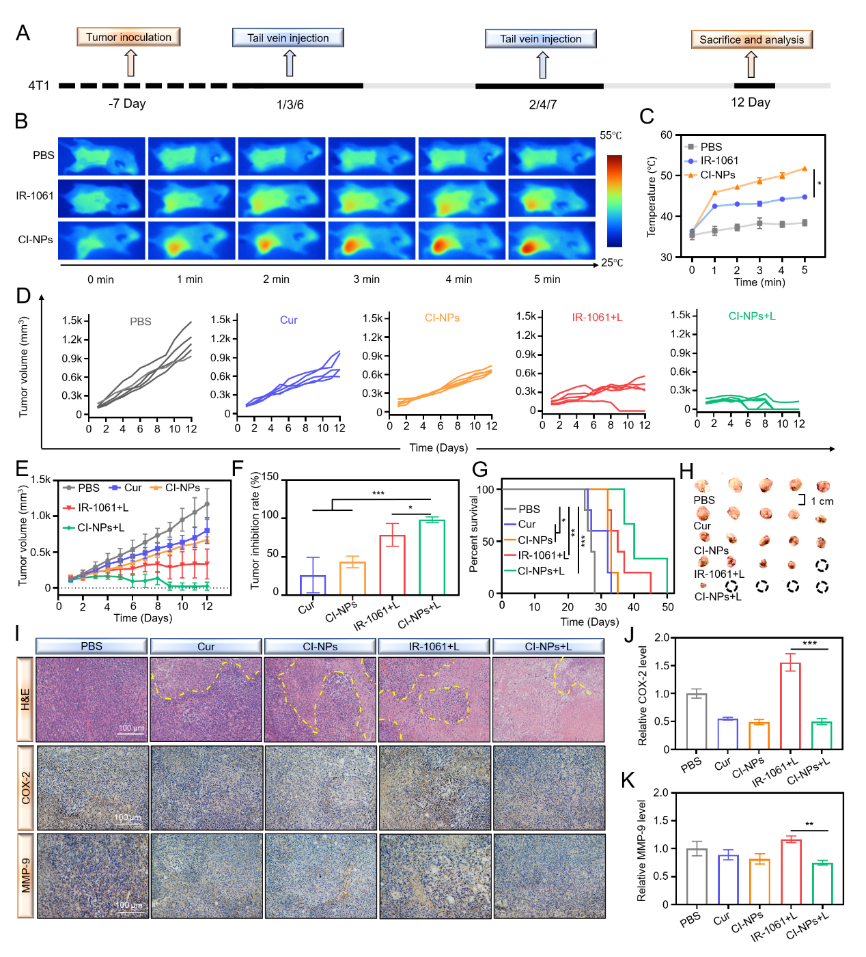
图4 CI-NPs体内光热效应和抗肿瘤活性
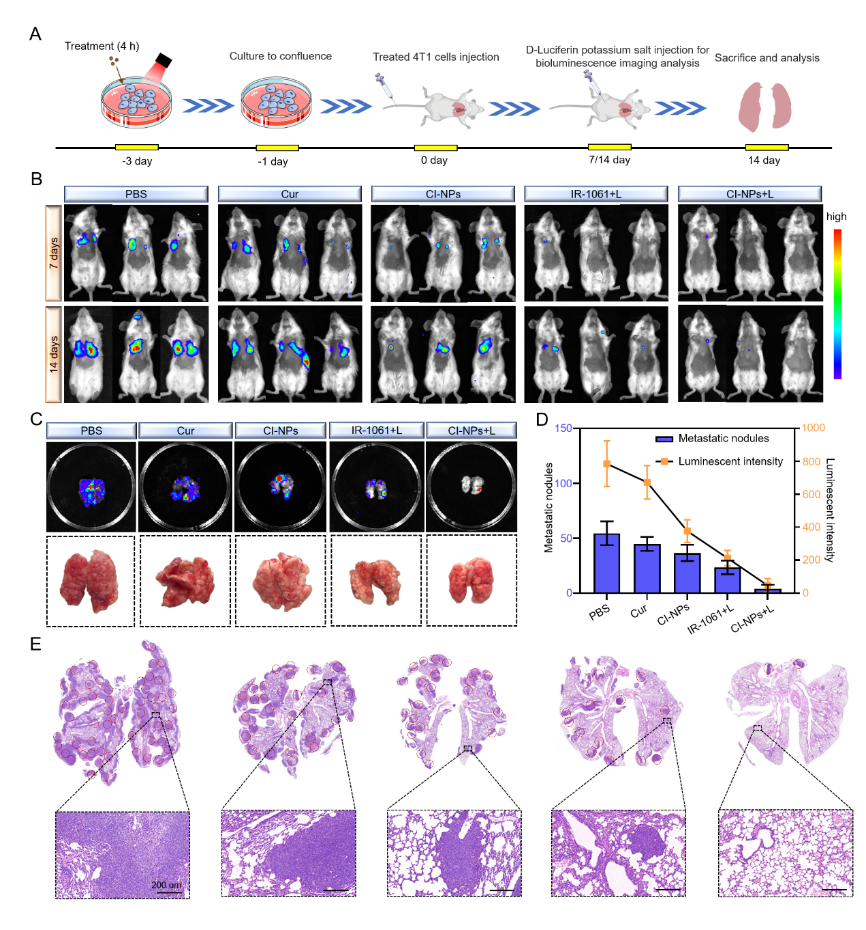
图5 CI-NPs体内抗转移作用
综上所述,该研究开发了一种无载体化疗-光热治疗纳米平台以增强肿瘤治疗。通过疏水作用和π-π堆积效应,Cur和IR-1061通过纳米沉淀以2:1进料比组装形成稳定的纳米颗粒(CI-NPs)。CI-NPs在NIR II激光(1064 nm)照射下产生光热效应,展现出比NIR I激光(808 nm)更优越的组织穿透性。CI-NPs中的Cur可通过抑制NF-κB信号通路来抑制PTT诱导的炎症级联反应,并下调过表达的HSP-70来增敏PTT,这使得CI-NPs能够在体外和体内显着抑制肿瘤的生长和转移。综上所述,这项研究提供了一种有前途的自组装策略,将光热治疗与天然小分子相结合,为增强肿瘤治疗提供了新思路。
原文链接:
https://doi.org/10.1021/acsmaterialslett.4c01066


