eGastroenterology:AI赋能内镜技术:评估炎症性肠病的深层愈合情况
时间:2024-08-17 22:00:26 热度:37.1℃ 作者:网络
内镜缓解是炎症性肠病(inflammatory bowel disease,IBD)的主要长期治疗目标,而这一治疗目标的评估通常依赖于白光内镜(white light endoscopy,WLE,也即普通内镜)结合组织学采样。然而,普通内镜下很难在组织学层次鉴定炎性肠病的活动状态。近期的研究表明,将高级内镜技术和人工智能(artificial intelligence,AI)技术结合,能克服普通内镜的不足并有效评估IBD活动性。
炎症性肠病(inflammatory bowel disease,IBD),即克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),是慢性复发性炎性肠病,严重影响患者的生活质量。全球发病率和患病率的增加,加上疾病进程的高度可变性和对治疗的反应,给患者和医疗保健系统带来了重大负担。近年来,开发的多种新型药物,包括新的生物制剂和新型口服小分子药物,有望打破IBD的治疗“天花板”,并实现该疾病的长期缓解。然而,关于IBD患者需要达到的缓解深度仍然存在争议。尽管最新的国际指南表明IBD的主要长期治疗目标是实现内镜缓解,然而治疗目标正在从内镜缓解转向新兴的组织学缓解、肠壁愈合和肠道屏障深层愈合等。这些深度缓解可能有助于更好地对患者进行分层,改善预后并增强疾病管理。
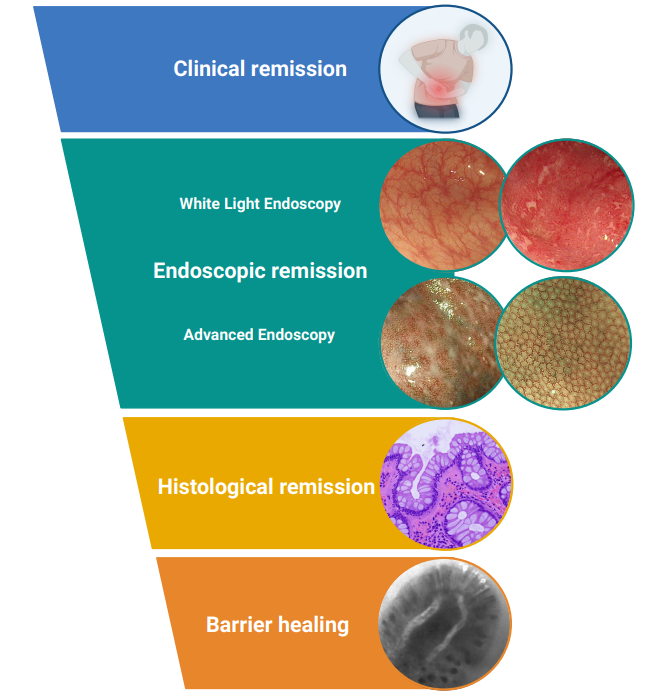
图1:炎症性肠病(IBD)的不同愈合水平。临床缓解(clinical remission):无腹痛、腹泻和直肠出血等炎症性肠病症状。内镜缓解(endoscopic remission):结肠镜检查期间肠道内无可见的炎症迹象。组织学缓解(histological remission):活检样本中无炎症的微观证据(主要是中性粒细胞浸润)。屏障愈合(barrier healing):恢复肠道屏障功能,防止有害物质穿过肠壁。
来源:原文图1
高级内镜增强成像以评估黏膜愈合和预测IBD临床结局
在过去二十年里,高级成像技术,包括图像增强内镜和超高倍率内镜,已广泛应用于内镜常规实践中。这些技术可以更准确地评估疾病活动性,并预测IBD的临床结果。
-
图像增强内镜:包括化学染色内镜(dye-chromoendoscopy,DCE)和虚拟染色内镜(virtual chromoendoscopy,VCE)。DCE使用如亚甲蓝和靛胭脂等染料来增强结肠黏膜的对比度,从而揭示微小的黏膜缺陷。因此,其临床应用主要集中在检测癌症病变而非评估IBD的活动性。相反,VCE在IBD疾病评估中的应用日益普遍。VCE是一种电子内镜成像模式,无需使用染料即可提供结肠和直肠黏膜表面及血管的全面对比度。VCE技术可分为光学和数字两类,在光学VCE中,与内镜照明源集成的光学透镜选择性地过滤白光以产生窄带光。相反,在数字染色内镜中,数字后处理增强了实时图像。
-
超高倍率内镜:包括细胞内镜(endocytoscopy,EC)和基于探针的共聚焦激光显微内镜(probe-based confocal laser endomicroscopy,pCLE)。EC在评估UC的黏膜愈合方面显示出巨大潜力。通过不同的评分系统(如ECSS和Erlangen内镜检查结肠炎评分),EC能够准确评估黏膜愈合情况,并与组织学活动性具有高度相关性。此外,未染色的EC技术(如使用窄带成像的微血管图像)进一步简化了检查过程,并缩短了检查时间。pCLE能够实现对疾病活动性和治疗反应的实时体内全面动态评估,深入到屏障和分子愈合层面。这种技术在预测疾病结局和指导IBD患者管理方面具有巨大潜力。然而,这些研究目前仅在专家中进行,图像解读需要专业培训,且pCLE所需的荧光素和探针成本也是临床实践中的障碍。
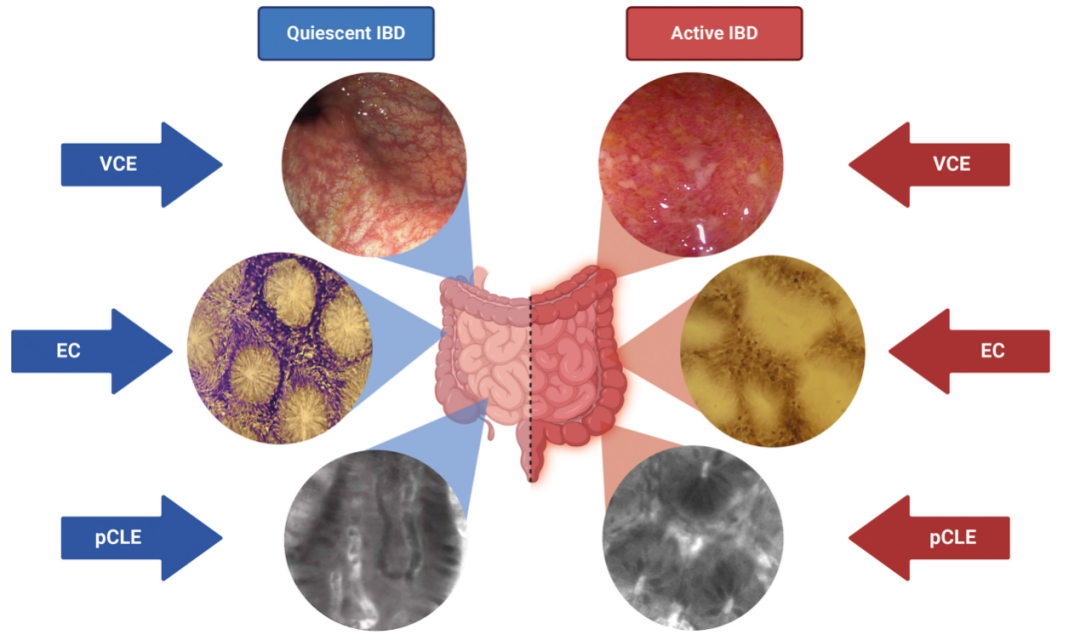
图2:评估炎症性肠病(IBD)活动的高级内镜技术。图的左侧显示静止期的IBD,而右侧显示活动期的IBD。这些图像通过虚拟电子染色内镜(VCE)、细胞内镜(EC)和基于探针的共聚焦激光显微内镜(pCLE)获得。
来源:原文图2
AI在IBD中的作用
现有内镜工具在评估黏膜愈合和治疗目标方面存在局限性,这促使研究者对相关技术进行标准化,以实现快速、准确和客观的疾病评估。AI已显示出在黏膜愈合评估方面具有良好的预测能力,并有望深入到组织学愈合层面。
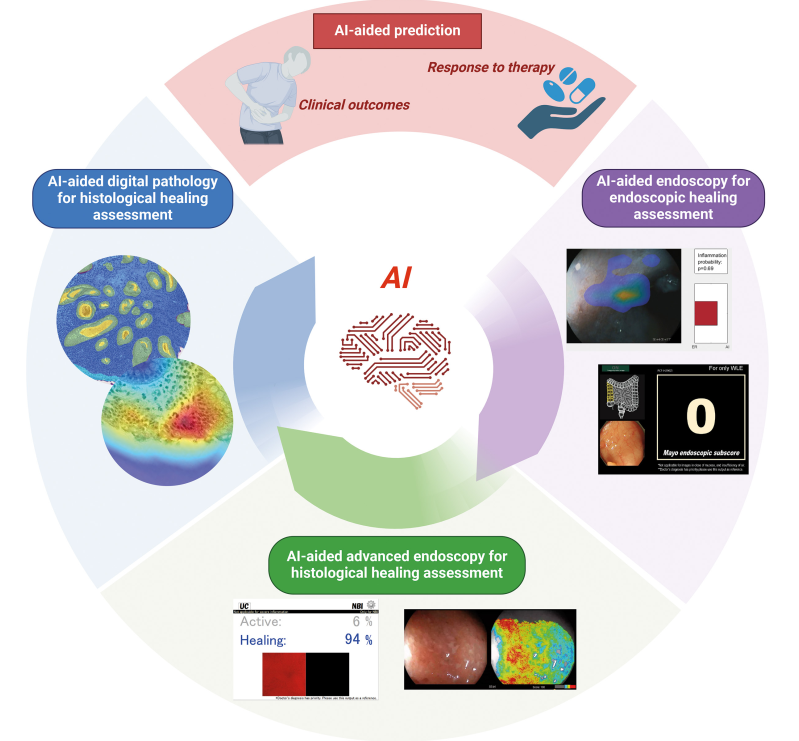
图3:AI辅助的IBD内镜和组织学愈合。AI可辅助内镜和组织学愈合目标及IBD的准确评估。AI模型可应用于内镜视频,以辅助评估IBD的内镜和组织学愈合情况。同时,AI也可用于组织切片以预测组织学愈合。AI具有预测结局和治疗反应的潜力,推动IBD个性化医疗的发展。
来源:原文图3
AI辅助的内镜评估愈合
AI最初应用于普通内镜技术,为IBD疾病活动提供客观且快速的评估。AI在UC的诊断和管理中展现出巨大潜力。通过深度学习增强的卷积神经网络模型,AI能够准确分类UC的内镜图像,预测内镜和组织学缓解。尽管现有研究多基于静态图像,但AI在处理视频数据方面也表现出色,有助于减少主观性并提高评估可靠性。此外,AI还能更全面地评估炎症的分布,对治疗选择和结直肠癌筛查具有重要意义。在临床试验中,AI的应用不仅限于图像分析,还涉及疾病活动评分的标准化,有助于提高研究效率。类似地,在CD中,AI已主要用于胶囊内镜图像分析,识别与IBD相关的黏膜病变,包括溃疡和狭窄,显著提高了图像分析的效率和准确性,有助于早期发现和监测疾病进展。AI系统不仅能够识别不同类型的黏膜病变,还能预测患者的治疗需求和预后,为CD的临床管理提供了有力支持。
胶囊内镜全称为智能胶囊消化道内镜系统,是一种先进的消化道检查技术。它通过患者口服内置摄像与信号传输装置的智能胶囊,借助消化道蠕动拍摄图像,为医生提供小肠的影像学资料。其适应症包括不明原因的消化道出血、肠道炎症性疾病等。胶囊内镜的优势在于无创、无痛、无辐射,但存在漏诊风险且不能取活检,需根据具体情况和医生建议选择。
AI辅助的高级内镜成像评估组织学愈合
随着新型高级内镜技术的发展,这些技术能够更精确和深入地评估肠道黏膜,从而促使AI被应用于改进对组织学愈合的评估。Iacucci教授及同事开发了一种基于AI的开创性工具,该工具使用iSCAN视频计算PICaSSO评分,结果显示,对于Robarts组织病理学指数(Robarts Histopathology Index,RHI)≤3、Nancy组织病理学指数(Nancy Histological Index,NHI)≤1和PICaSSO组织学缓解指数=0的准确度分别为83%、81%和83%。此外,AI-PICaSSO模型还显示了基于AI的疾病评估与不良结局之间的强相关性。另一项创新举措是开发了一种使用短波长单色发光二极管(富士胶片)照明的自动化诊断工具,使Bossuyt等人(Gastroenterology 2021;160:23–5)能够实时评估血管结构。该算法表现出显著的有效性,以79%的敏感性和90%的特异性识别组织学缓解。进一步的研究表明,基于AI的实时EC能够对临床缓解期的UC患者的临床复发风险进行分层。关于探针式共聚焦激光显微内镜(pCLE),已经开发了基于计算机的先导模型,这些模型通过评估隐窝、血管结构和荧光素渗漏来评估黏膜愈合,显示出良好的前景。总之,AI增强的高级内镜技术能够客观地评估IBD更深层次的愈合情况,达到组织学缓解,并预测结局,这种方法有可能彻底改变IBD患者的精准医疗。
AI辅助的数字病理评估组织学愈合
AI在评估IBD黏膜愈合方面的作用不仅限于内镜检查,当应用于组织学检查时,也展现出了巨大的潜力。与内镜检查类似,用于评估IBD中组织学疾病活动性的评分系统通常很复杂,并且样本间的变异性很高。尽管已广泛鼓励使用经过验证的评分系统和标准化报告,尤其是在随机临床试验中,但由于对现有评分系统的认知和培训不足,疾病评估仍然面临极大的主观性和挑战性。人工智能有可能彻底改变这一领域,其在临床试验和实践中实施的一个关键步骤是将数字切片整合到全切片成像中。这一转变允许将载玻片上的组织样本数字化为高分辨率图像,以便进行计算机辅助查看和分析,从而能够应用先进的计算机视觉技术。AI在组织学中的另一个潜在应用是预测治疗反应。有研究者阐述了一种创新方法,即基于机器学习算法来预测儿童UC的治疗疗效,确定哪些个体可能仅通过美沙拉嗪治疗就能实现无类固醇缓解。因此,AI在组织学中的应用对于评估IBD中的组织学缓解、预测结局和治疗反应具有重要意义。然而,尤其令人鼓舞的是AI整合内镜、组织学和组学(称为endo-histo-omic方法)的前景,以全面评估IBD患者,标志着IBD个性化医学新时代的到来。
“组学”(Omics)是一种系统生物学的研究方法,专注于对生物体内某一类分子族群的全面研究。这种方法突破了传统的单分子研究限制,为生命科学提供了一个全新的视角。组学领域包含多个分支,每个分支都针对不同的分子类型进行研究,主要包括以下几个方面:
-
基因组学(Genomics):研究生物体的基因组,包括基因的结构、功能与演化。通过基因组作图、核苷酸序列分析、基因定位和基因功能分析,揭示整套基因及其产物在疾病和健康状态下的作用方式。
-
转录组学(Transcriptomics):研究RNA分子,特别是mRNA,以了解基因表达的调控。通过高通量测序技术,全面分析和识别细胞或组织中的转录本,揭示基因的表达调控网络和相关生物学功能。
-
蛋白质组学(Proteomics):探索蛋白质的表达、结构、功能和相互作用。以蛋白质组为研究对象,深入研究蛋白质的表达水平、经过翻译后的修饰以及蛋白质之间的相互作用,有助于理解蛋白质在生物体中的功能。
-
代谢组学(Metabolomics):分析生物体内的代谢物,了解代谢途径和代谢网络。通过定性和定量分析生命体在面对外界刺激、生理或病理变化以及基因突变时体内代谢物水平的复杂动态反应,揭示表型背后的分子机制。
此外,组学领域还包括表观遗传组学、脂质组学、免疫组学、糖组学等多个分支,每个分支都有其特定的研究对象和研究方法。
AI在临床实践中的挑战与未来展望
尽管AI在IBD管理中展现出巨大潜力,其临床应用仍面临多重挑战,包括可靠性、鲁棒性验证、数据隐私、患者安全及伦理问题。AI通过整合临床、内镜、组织学及组学数据,能系统评估黏膜炎症,预测疾病进展,推动个性化医疗。然而,目前AI研究多局限于专家中心,缺乏广泛验证,需在不同环境下进行外部验证以确保性能。此外,AI模型的可靠性受数据质量影响,需持续验证和完善,并建立标准化数据收集与分析流程。同时,AI驱动的发现需通过随机对照试验验证其临床效用。尽管存在挑战,AI结合高级内镜技术如探针式共聚焦激光内镜和细胞内镜,为IBD管理带来变革性希望,能实时检查肠道深层结构,预测治疗反应,促进精准医疗发展。未来需解决数据隐私、伦理等问题,建立国际指南,以规范AI在IBD中的应用,最终实现日常临床的广泛接纳与信任。
本文综述了内镜技术在IBD管理中的应用进展,特别是高级内镜技术和AI的整合。文章指出,内镜缓解是IBD的主要治疗目标,但评估这一目标的传统方法存在局限性。高级内镜技术,如图像增强内镜和超高倍率内镜,提供了更准确的黏膜和组织学评估能力。AI的应用进一步提高了疾病评估的客观性和准确性,并有望推动个性化医疗的发展。然而,AI在临床实践中的应用仍面临诸多挑战,需要进一步的研究和验证来克服。
论文信息
https://egastroenterology.bmj.com/content/2/3/e100090


