Clin Epigenetics:特发性中枢性性早熟女孩的甲基组分析
时间:2024-08-18 13:00:21 热度:37.1℃ 作者:网络
青春期是发育达到完全生殖能力的关键生物学过程。这一阶段开始于脉动性GnRH释放的增加,导致下丘脑-垂体-性腺(HPG)轴复杂信号通路的激活,最终在青春期开始。女孩正常进入青春期的年龄差别很大,从8岁到13岁不等。这一重要现象发生的时间受到遗传背景以及营养、污染和应激等环境因素的强烈影响。最近,covid-19大流行与全球女性中枢性性早熟发病率的重要增加有关,表明环境对青春期时间的强烈影响。

令人信服的证据证明,表观遗传学为调节HPG轴激活的机制提供了额外的调节水平。Ojeda的工作有助于阐明青春期表观遗传控制的分子基础,通过鉴定两个转录调控大家族的活性,抑制[如polycomb (PcG)]或激活[如thritorax (TrxG)]功能,通过表观遗传机制控制KISS1基因表达,主要是在ARC神经元中,在青春期过渡期间。然而,PcG复合物并不是唯一集中调节青春期开始的抑制因子。有研究认为,作为ZNF转录抑制因子家族的一员,GATAD1通过募集组蛋白去甲基化酶(KDM1a)直接抑制KISS1(和TAC3)的人类转录,从而降低其启动子的激活。此外,全基因组研究已经证明,位于某些ZNF基因附近的单核苷酸多态性所表示的遗传变异与女性月经初潮年龄的变化之间存在关联,这加强了这种表观遗传机制与青春期发病控制的翻译相关性。针对GnRH神经元激活所需基因的表观遗传抑制机制最近被确定为青春期中央控制的分子机制的关键组成部分。先前对恒河猴基底下丘脑GnRH神经元的动物研究表明,GnRH神经元发育过程中GnRH基因表达的增加与CpG甲基化状态的降低之间存在联系。此外,CpG岛的甲基化复杂地参与了印迹基因的调控,以亲本特异性的方式决定了它们的表达模式,并在各种发育过程中起着至关重要的作用。在一大批欧洲女性中,有几个印迹基因与月经初潮的年龄有关。特别是,父系表达的印迹基因makorin3 (MKRN3)和delta-样1同源基因(DLK1)的功能缺失突变已被证明会导致中枢性性早熟,这表明印迹基因在调节青春期时间方面发挥着重要作用。
在人类中,全球甲基化变化已经在青春期被证实,在女性和男性中都有,这进一步支持了表观遗传修饰可能与青春期发育有关的证据。另一方面,青春期开始的时间以及发育过程中发生的激素和代谢变化有助于在以后的生活中对多种疾病的易感性,如肥胖、糖尿病、多囊卵巢综合征和某些类型的肿瘤。特别是,女性青春期开始的年龄较早可能对她们未来的生活产生负面影响,表观遗传变化也可能导致这种现象。据我们所知,关于青春期发作中断(即CPP)患者整体DNA甲基化的科学文献很少。在本研究中,我们分析了特发性中枢性性早熟的高加索女孩的外周血白细胞DNA甲基化谱,并将其与年龄和青春期相匹配的健康女孩进行了比较;此外,我们通过比较青春期前和青春期阶段的健康女孩来检查正常青春期的变化。
本研究旨在研究基因组DNA甲基化谱与青春期发病相关的变化,分析来自三组不同受试者的人外周血白细胞:19名中枢性性早熟(CPP)女孩,14名按年龄匹配的健康青春期前女孩和13名按青春期分期匹配的健康青春期前女孩。为此,在青春期前和青春期控制之间进行比较,以确定正常青春期过渡和CPP与青春期前和青春期控制之间的变化。
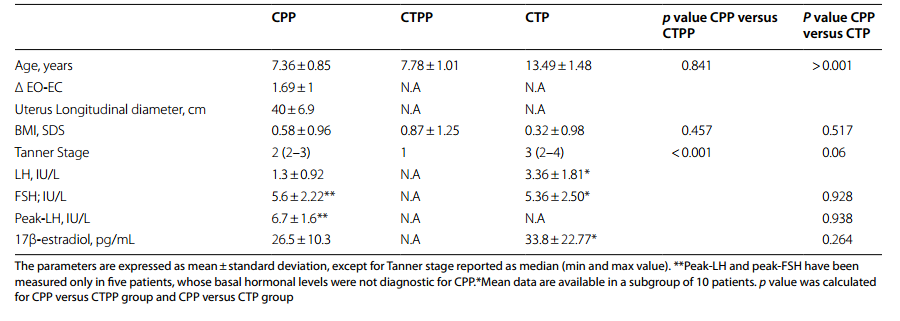
中枢性性早熟(CPP)患者与对照组(CTPP和CTP)的临床和实验室特征
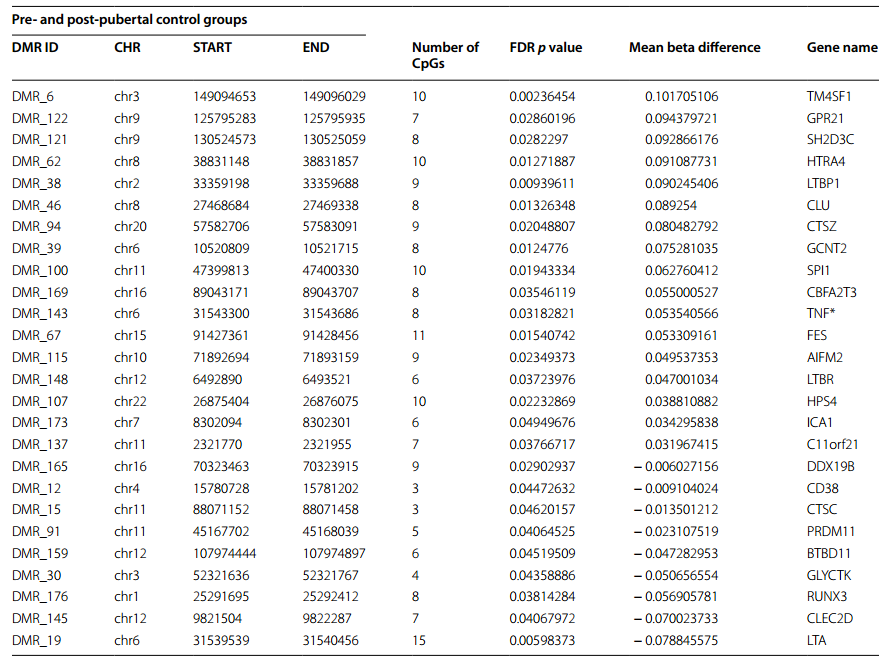
本研究中DMR与生理性青春期过渡相关,这是Almstrup之前报道的
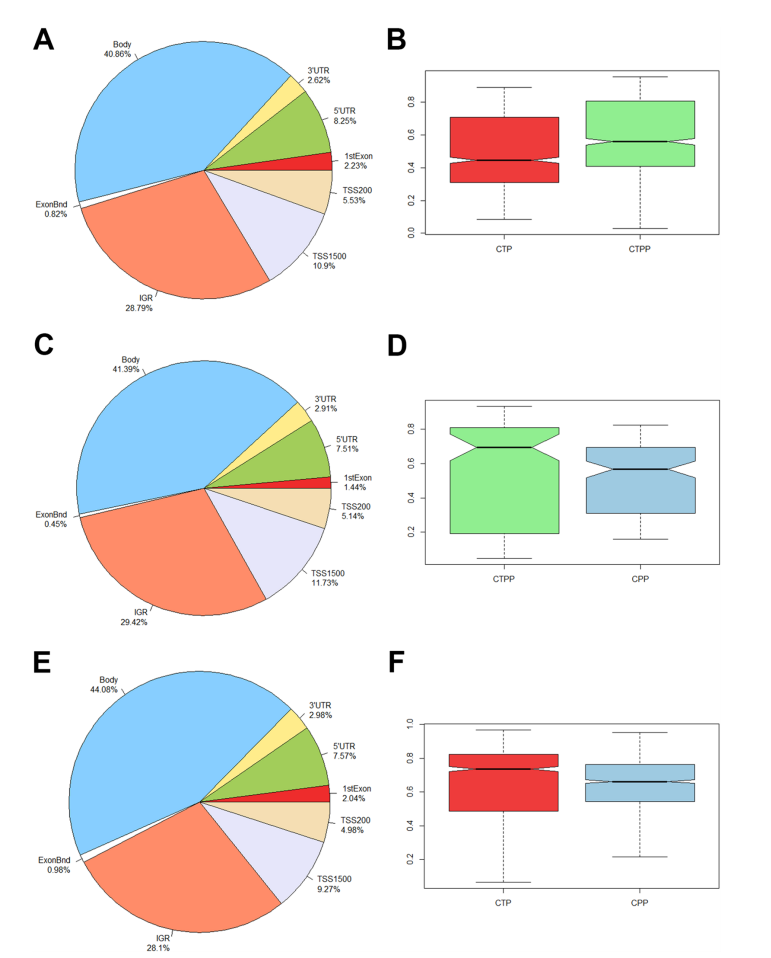
分布差异甲基化的CpG位点鉴定沿几个基因组特征的每个比较。在左边(A: CTP vs. CTPP, C: CTP vs. CPP, E: CTP vs. CPP),饼状图显示了每个基因组定位的dmp百分比。在右侧(B, D, F),箱形图显示了每组的β值分布(红色代表CTP,浅蓝色代表CPP,绿色代表CTPP)
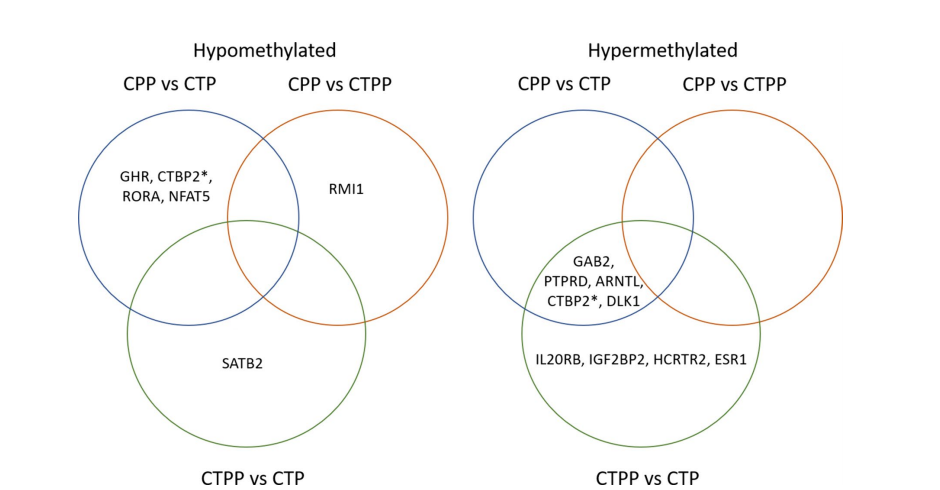
维恩图显示了与月经初潮年龄相关的基因甲基化状态。交叉区域显示两个或多个群体共有的差异甲基化基因。*CTBP2在5'UTR区域有一个低甲基化的CpG,在TSS1500有一个高甲基化的CpG
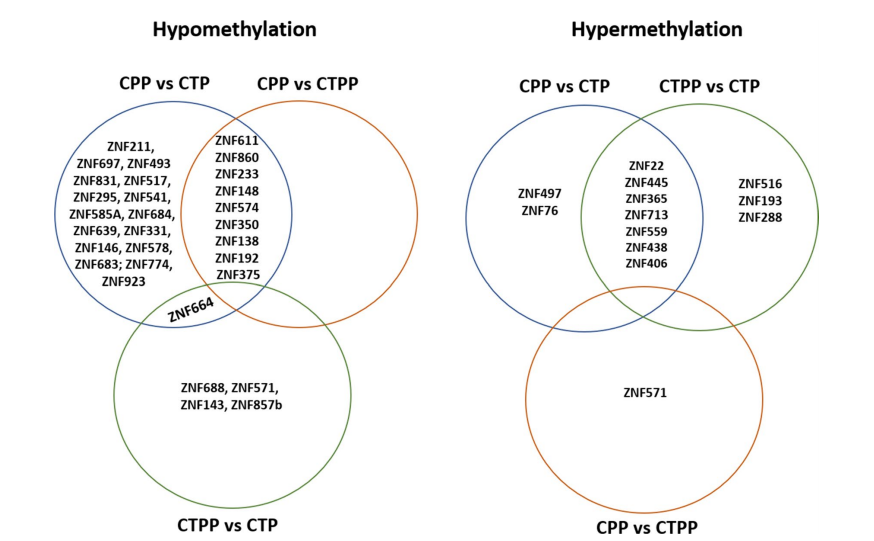
维恩图显示ZNF基因的甲基化状态。交叉区域显示了两个或多个基团共同存在的差异甲基化ZNFs

热图显示了检测到的差异甲基化CpG位点的前20个相关转录因子。从浅红色到深红色表示与该转录因子相关的log FDR的增加。灰框是特定比较中没有出现的tf
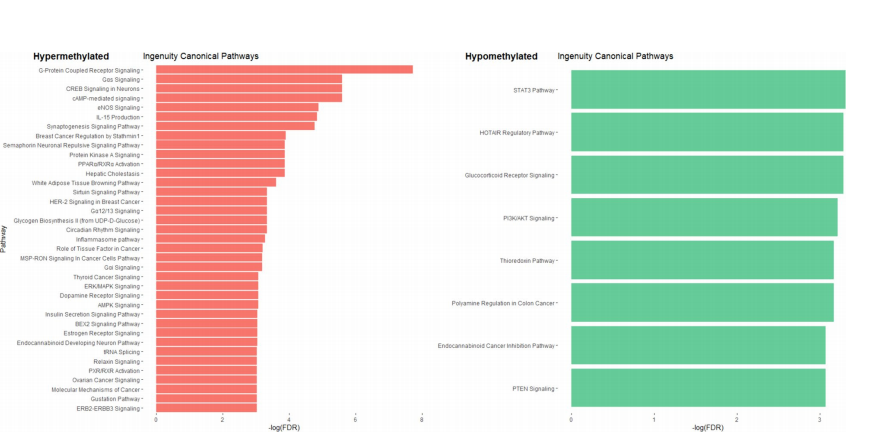
直方图显示了比较CTPP和CTP确定的独创性规范通路。红色表示具有高甲基化CpGs的基因参与的途径,而绿色表示具有低甲基化CpGs的基因参与的途径。该图仅显示了全部路径的一部分
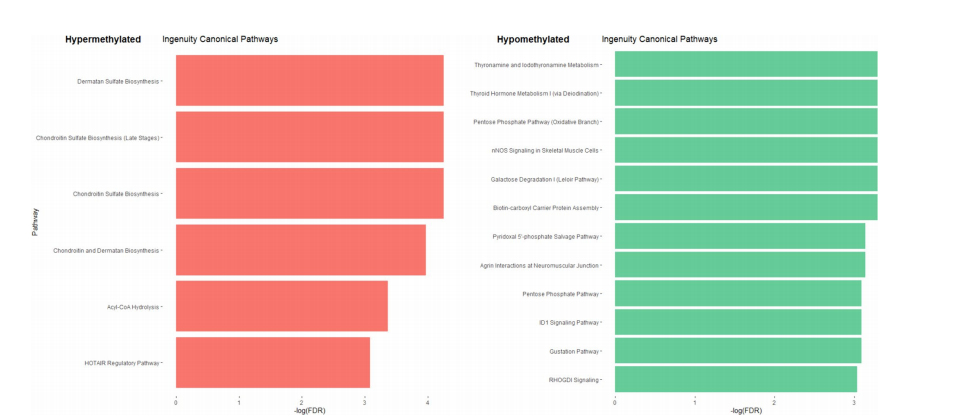
直方图显示独创性的典型途径确定比较CPP和CTPP。红色表示具有高甲基化CpGs的基因参与的途径,而绿色表示具有低甲基化CpGs的基因参与的途径


