【AJRCMB】STING 通过调控F2RL3 介导干扰素和BMPR2信号通路参与肺动脉高压的发生
时间:2024-08-26 23:00:30 热度:37.1℃ 作者:网络


研究背景
肺动脉高压(PH)特征在于远端肺动脉的进行性重塑,导致肺动脉压增加和右心衰竭。疾病的启动是由PAECs(肺动脉内皮细胞)的损伤和凋亡引发的,这可以由炎症和缺氧等病理性压力介导。BMPR2(骨形态发生蛋白受体2)突变在大约70%-80%的遗传性PAH(肺动脉高压,PAH)患者和大约20%的特发性PAH患者中被发现。然而,只有大约20%携带BMPR2基因突变的个体会出现PAH症状。因此,“第二次打击”假说提出了额外的因素可能需要以引发PH的血管病理。炎症被强烈证实是涉及PH疾病进展的“第二次打击”因素,并促进BMPR2突变啮齿动物易患PH。其机制仍然理解不完全。
cGAS-STING信号通路是一种固有免疫炎症通路,通过识别细胞质中异常出现的DNA诱导I型干扰素和炎症因子的释放。随后,cGAS结合胞质DNA并催化环鸟苷酸-腺苷酸(cGAMP)的合成,cGAMP作为次级信使结合并激活STING。STING的激活导致许多与炎症相关的心肺疾病。婴儿期发病的STING相关血管病(SAVI)是由于STING的功能获得性突变。STING激活通过过量产生I型干扰素和炎症因子导致COVID-19肺组织的内皮细胞功能障碍。然而,cGAS-STING在PH中的参与程度和后果尚不清楚。
由F2RL3(F2R类凝血酶或胰蛋白酶受体3)编码的蛋白酶激活受体4(PAR-4)参与内皮细胞的促炎反应,并在IL-1α或TNF-α刺激下在人冠状动脉中显著增加。F2RL3缺陷在通过抑制血小板中的凝血酶信号传导在肺栓塞中显示出保护作用。值得注意的是,先前的研究还报道了在人PH患者和大鼠MCT PH模型中F2RL3表达的增加,F2RL3是否以及如何对PH产生影响尚不清楚。
在本研究中,我们旨在调查STING在PH发病机制中的功能作用。我们揭示了PH中cGAS-STING通路的激活。STING抑制通过减少干扰素信号传导和通过调节PAECs中的F2RL3增强BMPR2信号传导来防止PH和内皮功能障碍的发展。我们的研究表明,靶向STING可以作为治疗PH的有效策略。
研究结果
一:cGAS-STING通路在啮齿动物肺动脉高压(PH)模型的肺组织中被激活。
qPCR分析显示,在多种啮齿动物PH模型(包括SuHx和缺氧小鼠PH模型,图1A)及SuHx、MCT和缺氧大鼠PH模型(图1B-D)的肺组织中,cGAS、STING、IRF3、IRF7、IFIT1、IFIT2、IFIT3和CXCL10的mRNA水平显著上调。Western blotting结果显示,在SuHx(图1E)和缺氧小鼠PH模型的肺组织中,cGAS、p-STING/STING和p-IRF3/IRF3的蛋白水平显著增加。同样地,在SuHx、MCT(图1F)和缺氧大鼠PH模型的肺组织中,STING蛋白水平显著升高。免疫荧光染色显示,在SuHx和MCT大鼠PH模型中,重塑的肺动脉内皮细胞层中STING表达增加(图1G),表明STING主要在内皮细胞中表达。综上所述,这些结果表明cGAS-STING通路在PH模型中被激活,而STING是肺血管内皮细胞中关键的失调基因。
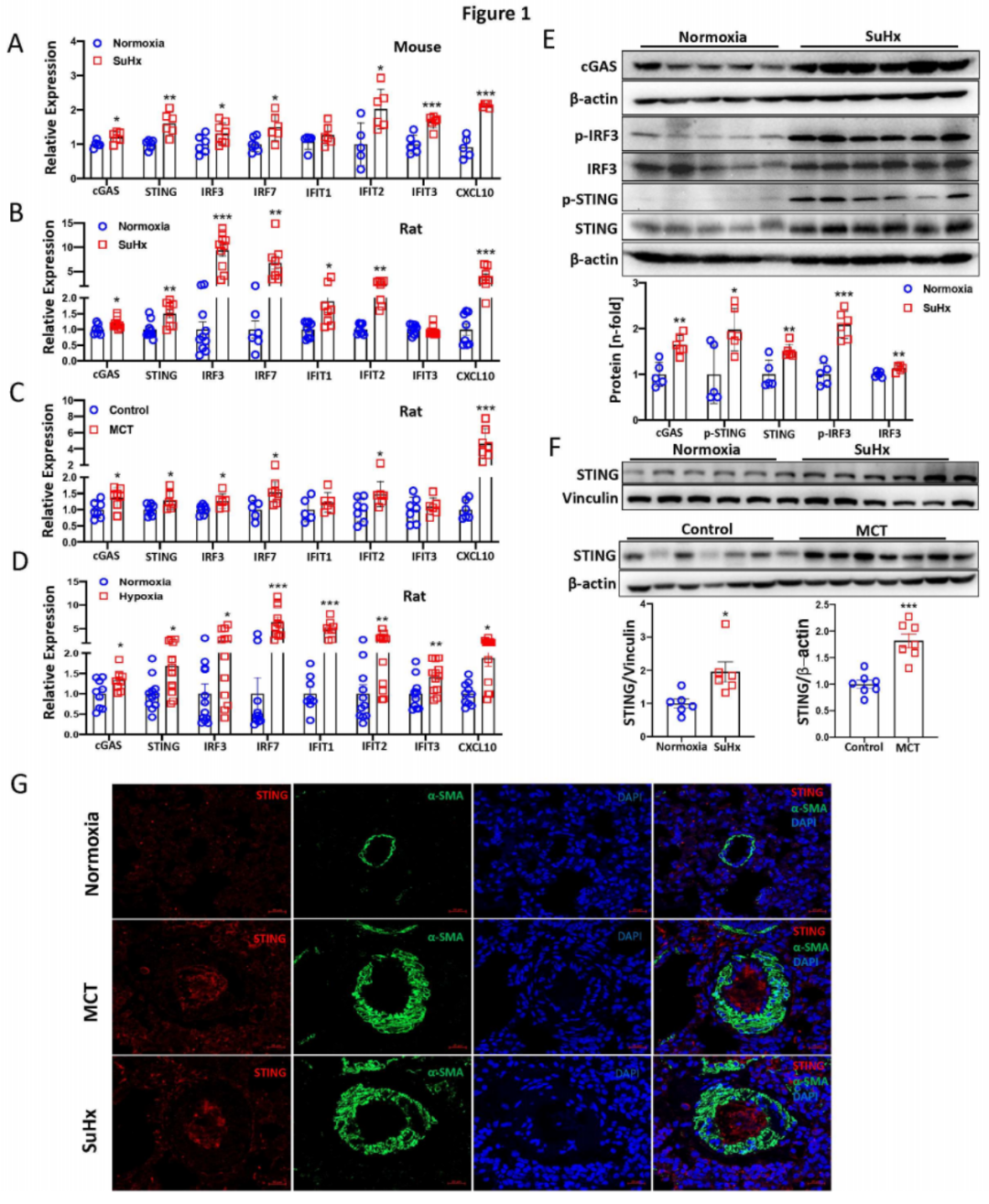
图1:啮齿动物PH模型肺组织中cGAS-STING信号通路的增强
二:cGAS-STING通路在肺动脉高压(PH)患者的肺组织中被激活,且STING在病理刺激下的内皮细胞中表达增加。
进一步的qPCR分析显示,与对照组相比,PH患者肺组织中cGAS、STING、IRF7、IFIT1、IFIT2、IFIT3和CXCL10的mRNA水平显著增加(图2A)。Western blotting分析证明,与对照组相比,PH患者肺组织中的STING表达上调(图2B)。免疫荧光和免疫组化染色确认,STING在PH患者重塑的肺动脉内皮细胞层中高表达和增加(图2C)。这一结果与Protein Atlas的单细胞RNA测序数据(数据未显示)和Western blotting分析显示STING在PAECs中的表达高于PASMCs一致(图2D)。为了进一步研究内皮细胞STING在PH发展中的病理贡献,我们发现暴露于缺氧环境的PAECs体外和缺氧及SuHx小鼠PH模型体内的肺微血管内皮细胞中STING表达显著增加(图2E-F)。综上所述,这些发现表明cGAS-STING通路在PH中被激活,且内皮细胞中STING的表达升高可能在PH的发展中起关键作用。
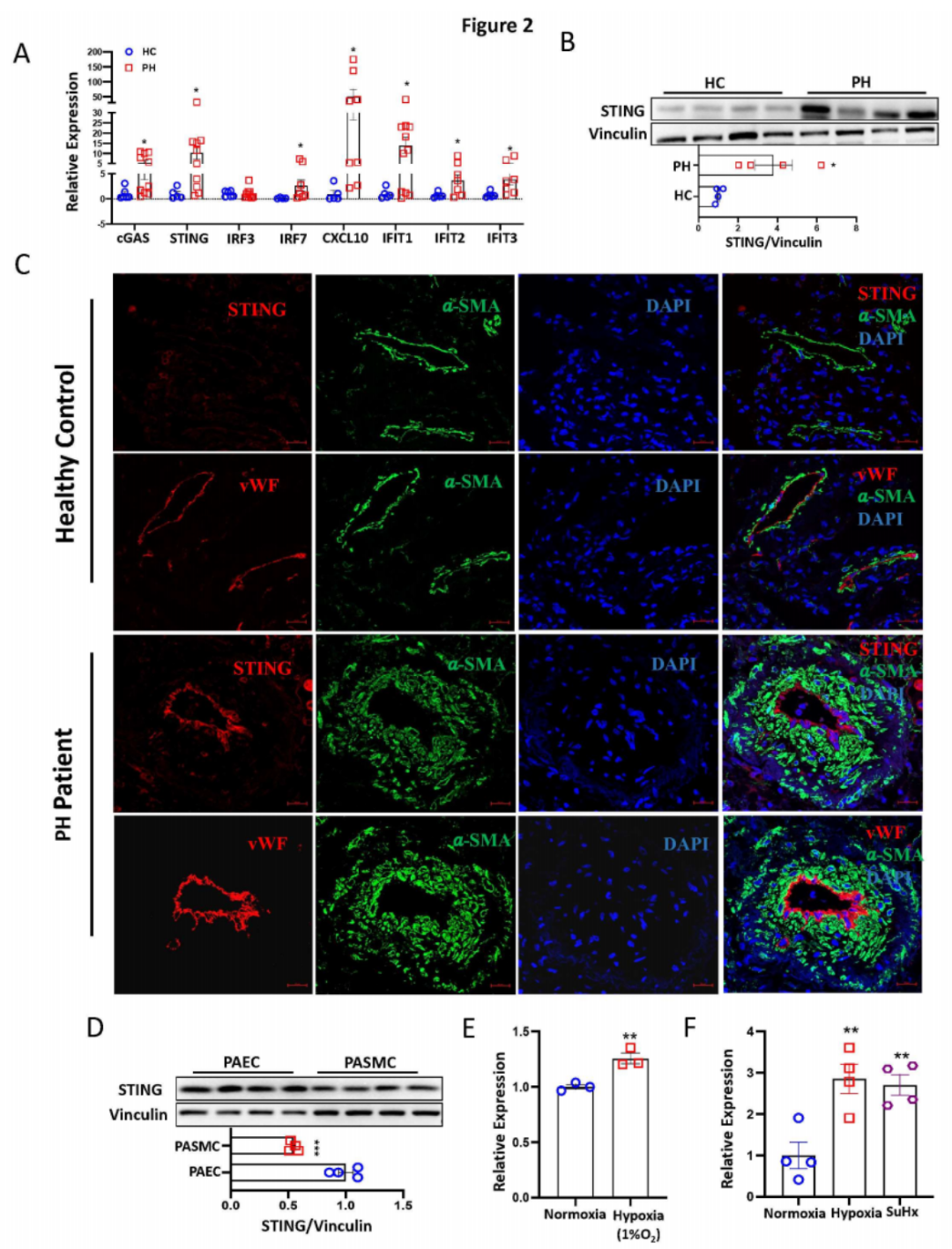
图2:PH患者肺组织中cGAS-STING信号通路的增强
三:TNF-α激活cGAS-STING通路和干扰素(IFN)信号
以往研究表明,cGAS-STING通路参与TNF-α诱导的炎性关节炎干扰素反应。在此,我们观察到TNF-α处理(2ng/ml)24小时后的PAECs中,cGAS、STING、IRF7、IFIT1、IFIT2、IFIT3和CXCL10的转录水平显著增加(图3A)。此外,cGAS和p-STING蛋白水平以及p-IRF3和p-TBK1显著上调(图3B-D)。为了探讨抑制STING是否可以预防STING依赖的干扰素信号激活,PAECs中使用STING的siRNA(20 μM)和STING抑制剂H-151(3μM)进行处理并随后进行TNF-α处理。结果显示,采用这两种策略抑制STING显著减少了PAECs中的p-IRF3和p-TBK1(图3E-F)。同样,干扰素刺激基因(ISGs)的转录水平在STING沉默(图3G)或H-151处理(图3H)下也显著下降。总的来说,这些发现表明TNF-α激活了PAECs中的cGAS-STING通路,抑制STING可以预防STING依赖的干扰素(IFN)信号激活。
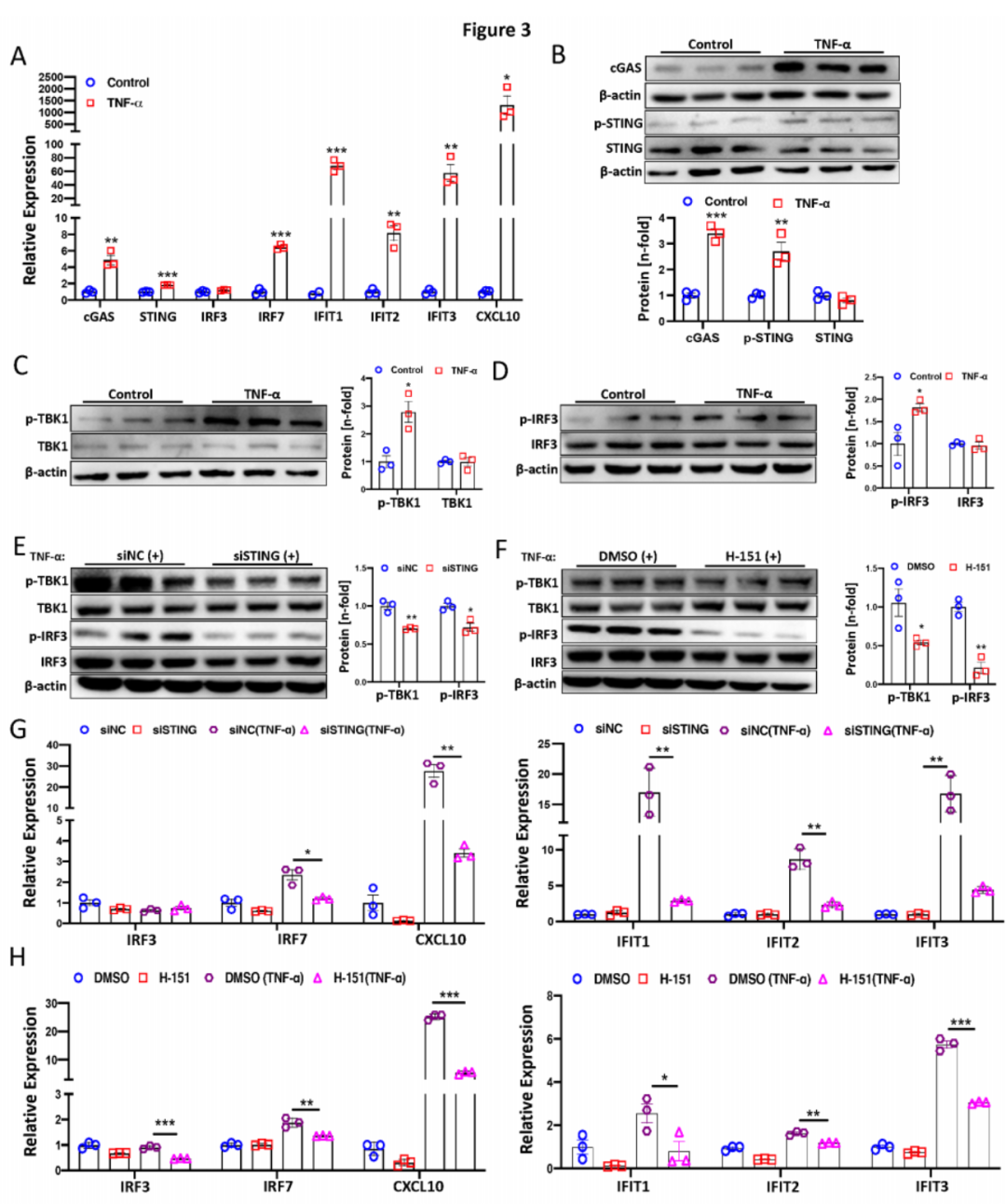
图3:TNF-α激活PAECs中的cGAS-STING信号通路
四:STING的表达影响内皮功能
通过EdU掺入分析显示,与对照组相比,使用siRNA或H-151抑制STING显著减少了PAECs的增殖(图4A-D)。一致地,使用siRNA转染或H-151处理抑制STING也显著降低了增殖细胞核抗原(PCNA)的蛋白水平(图4E-F)。通过划痕迁移实验发现,抑制STING降低了细胞迁移速率(图4G-H)。此外,使用siRNA转染抑制STING显著下调了内皮细胞活化标志基因ICAM-1的表达(图4I),表明抑制STING阻止了内皮活化。总之,这些体外结果揭示了STING在PAECs中的内皮功能障碍和活化中的关键作用。
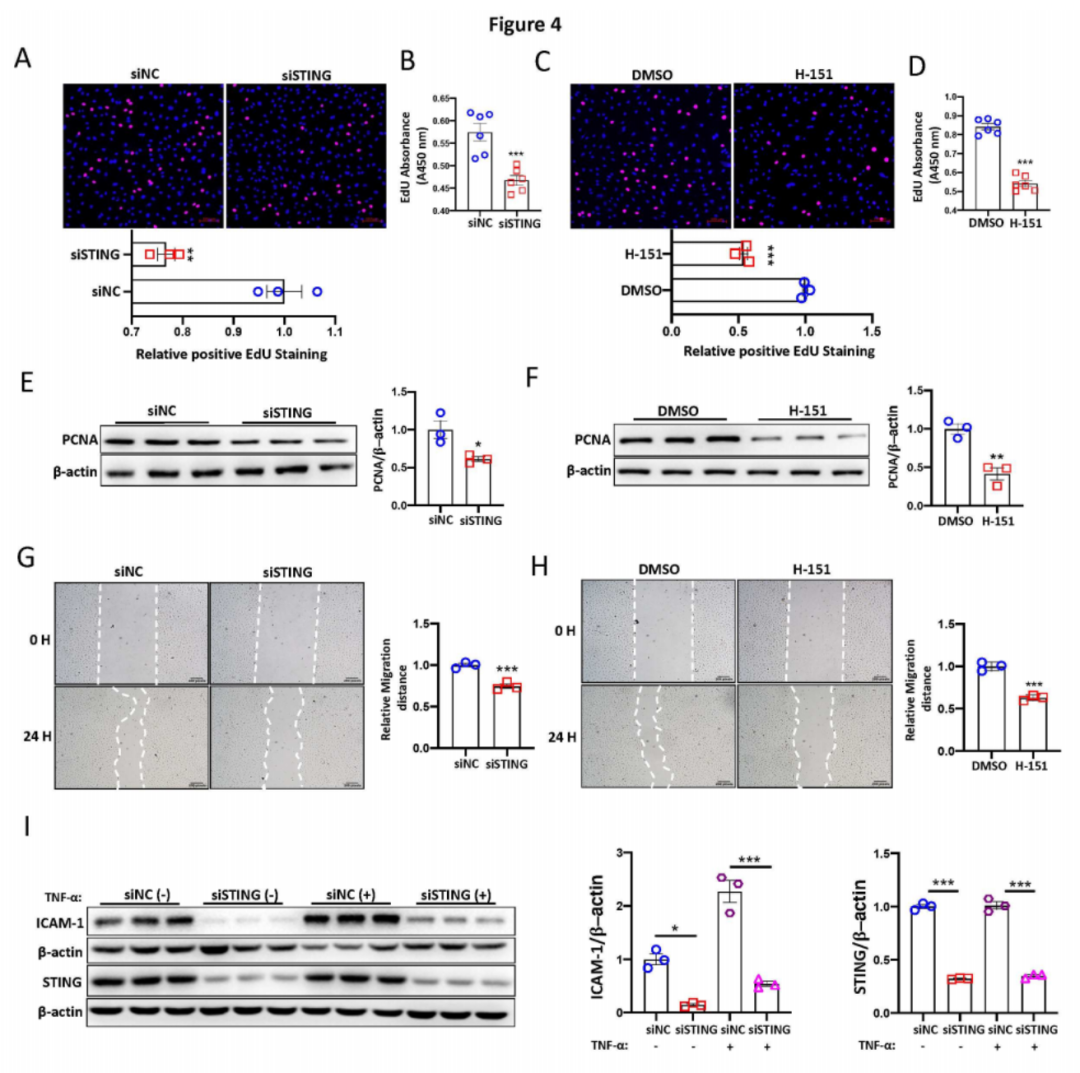
图4:STING表达水平影响内皮功能
五:F2RL3是STING的靶点并通过STING-NF-κB轴调控转录
为了探究分子机制,我们对转染STING siRNA的PAECs进行了RNA-Seq分析。与对照siRNA组相比,共有306个基因显著上调,601个基因显著下调。差异表达分析显示出不同的基因表达模式。基因本体分析显示,沉默STING导致参与免疫反应、细胞活化和炎症反应的基因表达减少(图5A)。KEGG通路分析显示,几条与PH相关的通路富集,包括细胞因子-细胞因子受体相互作用、细胞粘附分子、补体和凝血级联反应、TNF信号通路、IL-17信号通路、NOD样受体信号通路和NF-κB信号通路(图5B)。热图和火山图揭示了参与“补体和凝血级联反应”和F2RL3基因的基因显著受影响(图5C-D)。通过验证发现,F2RL3在STING沉默后显著下降(图5E),并通过Western blotting分析进一步确认了这一点(图5F)。先前的研究表明,F2RL3由NF-κB p65转录调控,而STING可以激活下游的NF-κB信号。因此,我们提出F2RL3可能由STING-NF-κB轴转录调控。STING沉默显著减少了PAECs中NF-κB p65的磷酸化(图5G)。利用JASPAR和NCBI进行的F2RL3 2kb启动子序列分析确定了三个NF-κB潜在结合位点。通过染色质免疫沉淀(ChIP)实验检测NF-κB与F2RL3启动子区域的结合。使用NF-κB ChIP样本和特异引物进行的PCR显示了NF-κB在F2RL3启动子上的结合(图5H)。为了最终证明NF-κB结合到F2RL3启动子并促进其激活,进行了双荧光素酶报告基因实验。突变F2RL3启动子区域的推定NF-κB响应元件(位于位置82、1015、1529)显著减少了荧光素酶活性(图5I),表明NF-κB的激活通过结合F2RL3启动子区域增加F2RL3转录。接下来,我们分别敲低STING和F2RL3,并进行了组合敲低。结果显示,转染STING siRNA或STING/F2RL3 siRNA组中STING表达显著降低,而转染F2RL3 siRNA组中STING无显著变化。然而,所有三组中F2RL3表达水平显著下调。这些数据表明F2RL3是STING的下游调控基因。此外,我们进一步进行了共免疫沉淀(Co-IP)实验,显示了PAECs中STING和F2RL3的相互作用(图5J)。然而,免疫荧光(IF)染色未显示STING和F2RL3在PAECs中的直接结合,这表明STING可能通过未知的蛋白质复合物与F2RL3相互作用。总之,我们发现F2RL3由STING-NF-κB轴转录调控,并可能通过蛋白质复合物与STING相互作用。
六:F2RL3参与PH和TNF-α诱导的干扰素信号通路的病理过程
为了研究F2RL3在PH中的病理学相关性,我们发现F2RL3在各种啮齿动物PH模型和PH患者(图5K)的肺组织中上调。免疫荧光染色显示,F2RL3在PH患者重塑的肺动脉的内皮层中高度表达(图5L)。这一发现得到了PASMCs和PAECs的Western blot分析以及Protein Atlas的scRNA-Seq数据(数据未显示)的支持。重要的是,我们发现F2RL3在暴露于低氧(1% O2)的PAECs中显著增加,以及从低氧和SuHx小鼠PH模型中分离的肺微血管内皮细胞中显著增加。敲低F2RL3显著降低了PAECs中的Hif-1α和Hif-2α表达。有趣的是,与野生型小鼠相比,Sting-/-小鼠的肺组织中F2RL3表达显著降低,并且与STING的mRNA表达水平呈强正相关。机制上,qPCR分析显示,单独敲低F2RL3和联合敲低STING显著减少了干扰素刺激基因(ISGs)的表达,如CXCL10、IFIT1、IFIT2和IFIT3。一致地,敲低F2RL3显著减少了TNF-α处理的PAECs中的p-IRF3和p-TBK1(图5M)。先前的研究表明,STING和F2RL3促进NLRP3炎性小体信号通路。在这里我们发现,敲低STING和F2RL3显著降低了PAECs中的NLRP3蛋白水平。功能上,我们发现敲低F2RL3显著减少了在正常氧和低氧条件下的细胞增殖。总之,我们发现F2RL3表达的增加可能有助于PH的发展,且STING-F2RL3调控轴参与了干扰素信号的调控。
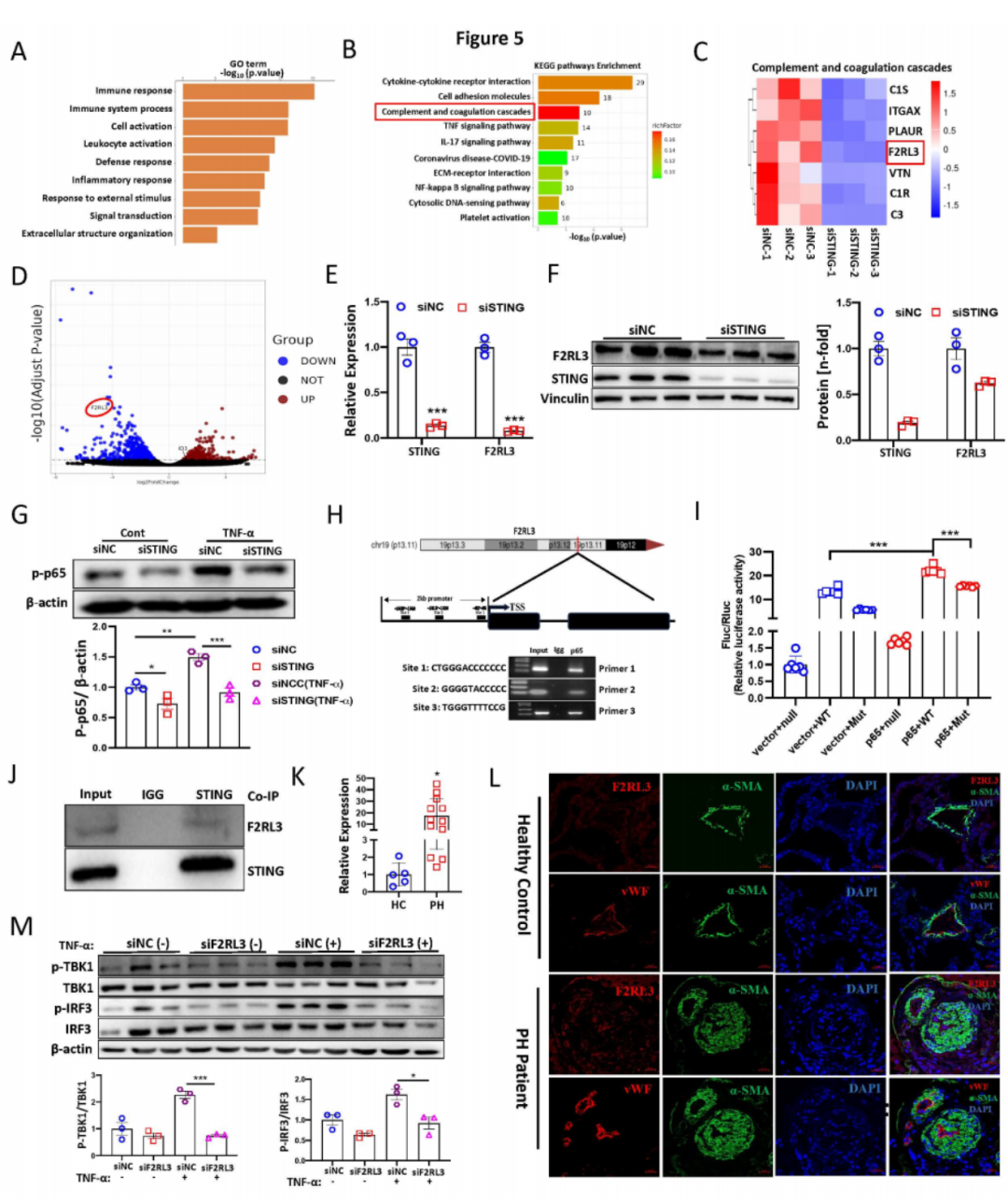
图5:STING-NF-κB轴转录调控F2RL3并参与PH发病机制
七:STING敲低通过与F2RL3相互作用增强BMPR2信号通路。
除了下调的通路外,敲低STING还显著诱导了几条与PH相关的通路,包括TGF-β(GO:0071559)、对TGF-β刺激的细胞反应(GO:0071560)、对生长因子刺激的细胞反应(GO:0071363)和促进凋亡过程(GO:0043065)信号通路。热图显示了RNA-Seq中上述GO通路中的基因。此外,KEGG通路分析显示TGF-β信号通路是上调的主要通路。大多数失调的基因属于BMP信号通路(图6A)。因此,我们进一步进行了qPCR和Western blot实验,以验证这些失调的BMP信号基因。发现敲低STING增强了BMP9(10ng/ml)(图6B)或TNF-α(2ng/ml)刺激条件下的BMPR1A、BMPR2和ID3的mRNA表达水平。一致地,敲低STING也导致在基础条件或BMP9-(图6C-D)/TNF-α刺激条件下BMPR2和Smad1/5/9(p-Smad1/5/9)磷酸化水平上调。有趣的是,我们还观察到敲低F2RL3显著增加了p-Smad1/5/9,表明F2RL3的抑制也激活了BMP信号通路(图6E-F)。此外,敲低F2RL3不影响STING的蛋白水平(图6E-F)。我们进一步分析了BMP信号的激活是否影响STING或F2RL3的表达。如图6G所示,BMP9刺激显著降低了F2RL3的表达而不是STING,同时增加了BMPR2、ID1和ID3的表达水平。一致地,BMP9处理的PAECs中的F2RL3蛋白水平显著下降(图6H-I)。此外,抑制BMPR2显著增加了F2RL3的mRNA和蛋白水平(图6J-L)。为了评估STING敲低激活BMPR2信号是否由F2RL3介导,我们进行了在STING敲低条件下通过F2RL3过表达(LV-F2RL3)感染的补救实验。我们发现,STING敲低显著增加了STING敲低和STING敲低加上LV阴性对照组中的BMPR2和p-Smad1/5/9磷酸化水平。令人惊讶的是,我们观察到F2RL3过表达显著阻断了STING敲低和STING敲低加上LV阴性对照感染组中的BMPR2和p-Smad1/5/9磷酸化水平的升高。通过Western blot证实了STING敲低和F2RL3过表达(图6M-N)。总之,这些数据表明STING通过F2RL3负调控BMPR2信号,并且F2RL3和BMPR2信号之间可能存在负反馈回路。
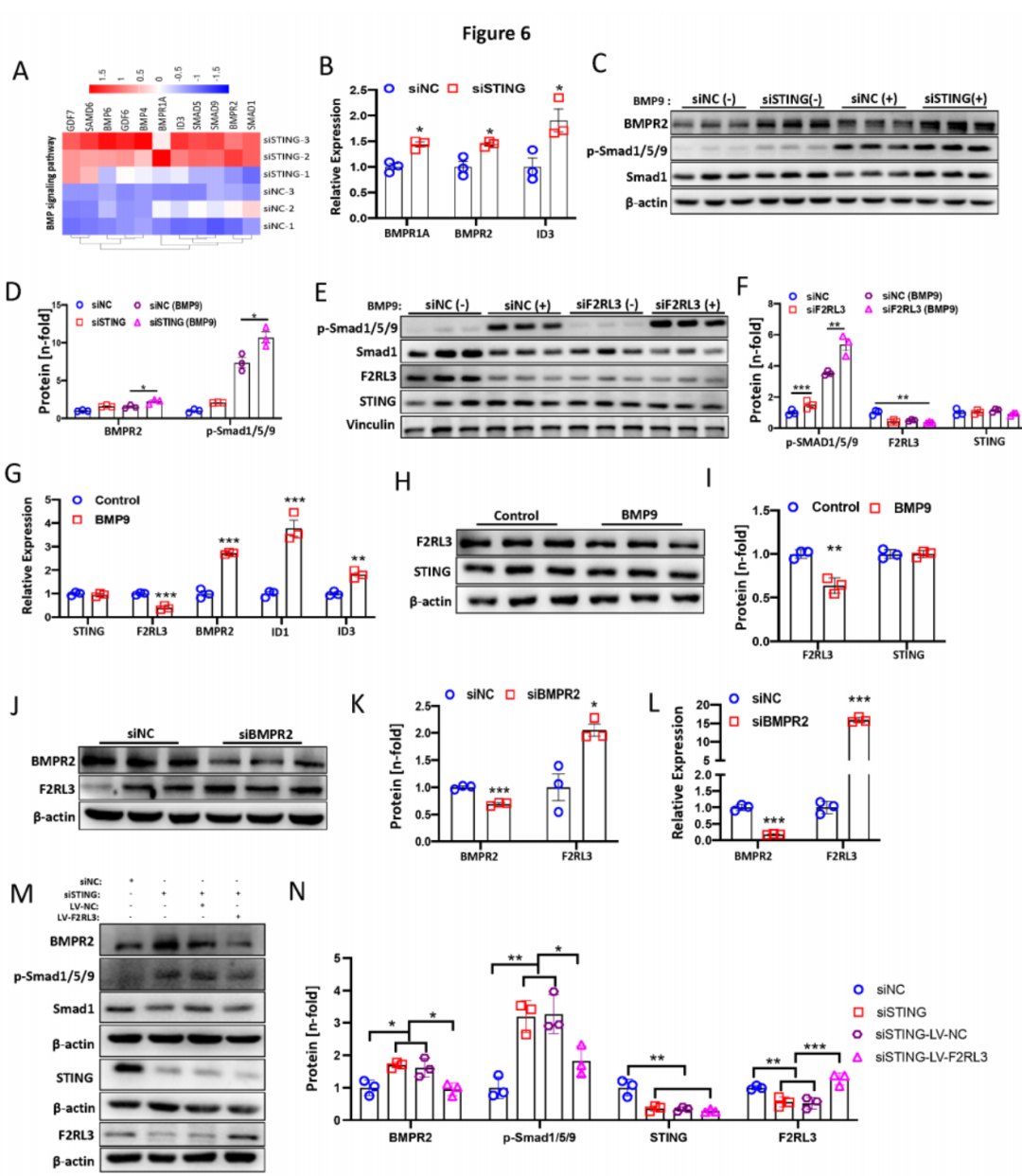
图6:STING沉默通过与F2RL3相互作用增强BMPR2信号通路
八:STING基因敲除缓解小鼠PH的发展。
为了研究体内STING基因敲除是否对实验性PH的发展具有保护作用,我们挑战了野生型(WT)和Sting敲除(Sting-/-)小鼠,用3周低氧和Su5416注射(SuHx PH模型)。通过qPCR和Western blot在肺组织中确认了STING的敲除(图7A-B),以及PCR产物测序。与WT对照组相比,Sting-/-小鼠在SuHx模型中右心室收缩压(RVSP)和右心室肥厚(RVH)显著降低(图7C-D)。各组之间的心率没有变化(8B)。组织病理学上,Sting-/-小鼠与WT同窝小鼠相比显著减少了肺血管重塑(图7E)。通过超声心动图,我们发现Sting-/-显著改善了右心室(RV)功能,如三尖瓣环收缩运动(TAPSE)(图7F)。然而,两组之间的PAT/PET比率没有差异(图7G)。机制上,与体外数据一致,Sting-/-显著降低了p-IRF3蛋白水平,并增强了BMPR2和p-Smad1/5/9蛋白水平在WT和Sting-/-小鼠在正常氧和SuHx PH模型中的总肺组织中(图7H-I)。此外,Sting-/-小鼠与WT小鼠在正常氧和SuHx条件下的F2RL3蛋白水平显著降低,而WT SuHx组与WT正常氧组相比F2RL3表达显著升高。此外,SuHx PH模型中与正常氧条件相比,Sting、F2rl3和ISGs的mRNA水平显著增加,而在SuHx模型中的Sting-/-小鼠中显著降低(图7J-K)。相关性分析显示STING表达与F2rl3、Cxcl10、Irf3、Irf7和Ifit2显著正相关。因此,STING基因敲除通过下调F2RL3、ISGs并上调BMPR2信号来预防小鼠PH的发展。
九:STING的药理学抑制对PH产生预防和治疗效果。
为了研究STING的药理学抑制是否可以预防PH的发展,WT小鼠从暴露于慢性低氧的第一天起每天接受STING共价拮抗剂H-151的剂量,同时每周注射Su5416。单独使用H-151没有显著效果,但与SuHx组相比,显著降低了SuHx处理的PH模型中的RVSP、RVH(图7L-M)和远端肺动脉的血管重塑(图7N)。各组之间的心率没有显著差异。超声心动图结果显示,H-151治疗显著改善了SuHx损伤的TAPSE和PAT/PET,但单独使用对正常氧条件下的这两个参数没有显著影响。qPCR分析显示,H-151治疗显著降低了Sting、F2rl3和ISGs的mRNA水平。此外,Sting与F2rl3、Irf3、Irf7、Ifit1、Ifit2、Ifit3和Cxcl10显著正相关。重要的是,Western blot显示与对照SuHx组相比,H-151 SuHx组的p-IRF3蛋白水平显著降低。
为了研究H-151是否可以用于治疗PH,小鼠每周皮下注射SU5416并暴露于慢性低氧3周,然后在低氧条件下每天注射H-151另2周。与H-151预防模型一致,我们发现治疗性使用H-151逆转了RVSP、RVH并减少了肺血管重塑,与对照组相比,在两组中都不影响心率。超声心动图显示,H-151还改善了SuHx损伤的TAPSE和PAT/PET。机制上,H-151治疗显著降低了Sting、F2rl3和干扰素(IFN)信号的mRNA表达和p-IRF3的蛋白水平。此外,STING的mRNA水平与F2rl3、Irf3、Irf7、Ifit1、Ifit2、Ifit3和Cxcl10显著正相关。综上所述,这些结果表明STING是PH病理中的关键贡献者,并且抑制STING在预防或治疗设置中对PH表现出强大的治疗效果。
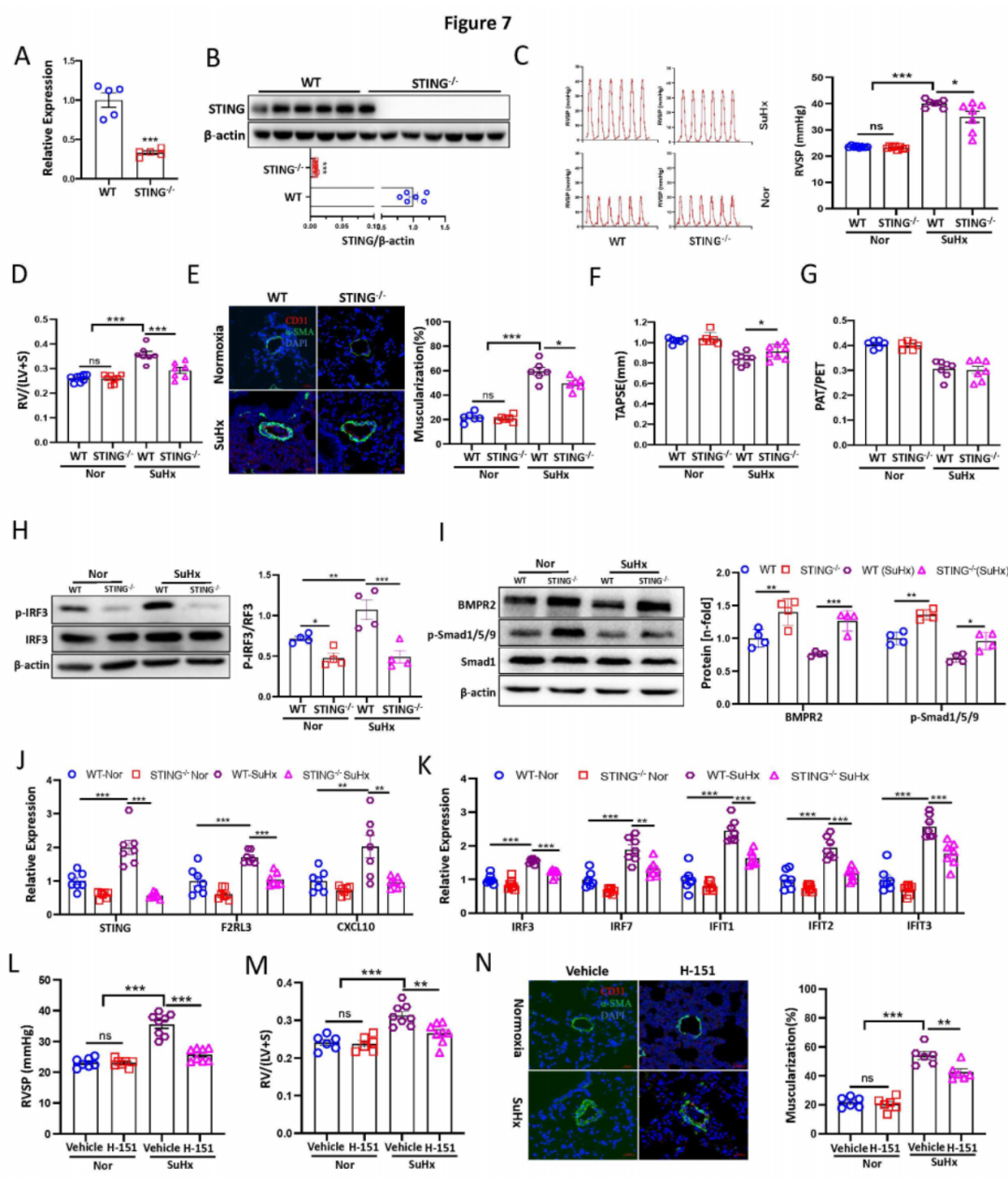
图7:STING基因敲除和药理学抑制减轻小鼠PH模型的发展
研究结论
我们对各种啮齿动物PH模型和PH患者中的cGAS-STING通路进行了全面评估,揭示了STING在PH中的重要作用。我们的研究表明,STING主要在肺血管的内皮细胞中表达,并且对内皮功能障碍和PH的病理发生有贡献。机制上,STING的敲低与F2RL3协同作用,减少了干扰素信号并增强了PAECs中的BMPR2信号。通过基因敲除和药理学抑制STING的转化研究显示,在临床前小鼠PH模型中具有显著的治疗效果。总之,这些结果突出了STING在PH中的新作用,并表明它可能是PH治疗的一个有前途的治疗靶点。
作者,该研究由南方科技大学医学院完成,第一作者邓林博士,目前任职于中山大学附属第八医院心内科。通讯作者为南方科技大学卞劲松教授和深圳人民医院呼吸研究所聂晓伟研究员。
参考文献
Deng L, Cao C, Cai Z, Wang Z, Leng B, Chen Z, Kong F, Zhou Z, He J, Nie X, Bian JS. STING Contributes to Pulmonary Hypertension by Targeting the Interferon and BMPR2 Signaling through Regulating F2RL3. Am J Respir Cell Mol Biol. 2024 Jun 12. doi: 10.1165/rcmb.2023-0308OC. Epub ahead of print. PMID: 38864771.


