玻璃化冷冻囊胚复苏后体外培养时间对妊娠结局的影响!
时间:2024-09-05 14:03:22 热度:37.1℃ 作者:网络
【摘要】
目的 探讨玻璃化冷冻的扩张期囊胚解冻复苏后不同的培养时间对临床妊娠结局的影响。
方法 回顾性分析我院2021年1月1日至2022年12月31日期间通过玻璃化冷冻的D5及D6囊胚移植周期临床资料,共1 867周期。根据囊胚复苏后体外培养时间将其分为A组(<2 h, n=958)和B组(2~4 h, n=909),再根据移植囊胚的数目分为两个亚组,移植1枚囊胚定义为A1组(n=843)和B1组(n=798),移植2枚囊胚定义为A2组(n=115)和B2组(n=111)。比较各组HCG阳性率、临床妊娠率、胚胎着床率、多胎率、早期流产率及最终活产率之间的差异。
结果 患者的平均年龄、不孕年限、内膜厚度以及基础激素水平等在A1和B1组、A2和B2组之间均无显著差异(P>0.05)。妊娠结局方面,移植1枚囊胚的两组(A1和B1)间HCG阳性率、临床妊娠率、胚胎着床率、多胎率、早期流产率、异位妊娠率和活产率比较均无显著差异(P>0.05);移植2枚囊胚的两组(A2和B2)比较,A2组的HCG阳性率显著高于B2组(91.30% vs. 79.28%,P<0.05),A2组临床妊娠率(81.74% vs. 71.17%)、胚胎着床率(61.30% vs. 54.05%)、活产率(67. 83% vs. 63.06%)也均高于B2组,但差异无统计学意义(P>0.05)。Logistic分析结果表明,移植2枚冻融囊胚时体外培养时间<2 h是HCG阳性率的独立影响因素 [OR=2.210,95%CI(1.028,4.752),P=0.042]。
结论 双囊胚移植周期解冻后应尽量在2 h内移植,以便获得更好临床结局;单囊胚移植者解冻后在4 h内移植临床妊娠结局并无明显差异。
近年来,辅助生殖技术(ART)已经帮助成千上万的女性成功妊娠。体外受精过程中遇到卵巢过度刺激综合征(OHSS)等不适宜新鲜周期移植或移植后仍有剩余可用胚胎时,将这些可用胚胎冷冻保存在液氮中,随后择期再解冻并移植回子宫里,最终可以提高单次取卵周期累积妊娠率。胚胎冷冻前进行囊胚培养,可以进一步筛选出发育潜力更好的胚胎,从而可以获得更高的着床率和活产率,同时降低了流产率。
国内外众多中心纷纷开展了玻璃化冻融囊胚移植,但是由于此项技术并没有一个统一的执行标准,囊胚解冻后培养时间对移植的结局以及胚胎后续发展是否产生影响仍旧处于讨论阶段。冼英杰等认为解冻后培养时间并不会对妊娠结局产生影响,解冻当天均可进行移植,而陶林林等认为解冻后至少培养2 h的囊胚会获得更好的妊娠结局,个别中心甚至采取解冻后过夜培养移植的策略。本研究对我中心1 867个冻融囊胚移植周期进行回顾性分析,探讨囊胚复苏后不同培养时间对移植后妊娠结局的关系。
材料与方法
一、研究对象
回顾性分析我中心2021年1月至2022年12月行囊胚解冻复苏后移植的病例资料。
纳入标准:(1)女方年龄<38 岁;(2)冻融胚胎移植(FET)周期;(3)冷冻前囊胚级别为培养至第5天(D5)或者第6天(D6)的4期囊胚。
排除标准:(1)解冻胚胎培养成囊胚后再移植;(2)解冻后取消移植的周期;(3)患有子宫异常等疾病者。
共纳入1 867例FET周期,根据囊胚解冻复苏后至移植前的培养时间间隔,分为A组(<2 h, n=958)和B组(2~4 h, n=909),再根据移植囊胚数目分别将A、B分为两个亚组,即移植1枚囊胚的A1组(n=843)和B1组(n=798)、移植2枚囊胚的A2组(n=115)和B2组(n=111)。
二、诊疗回顾
1.促排卵与取卵:常规方案促排卵,首先B超监测卵泡发育情况,大部分卵泡直径大于18 mm时于当晚注射人绒毛膜促性腺激素(HCG;珠海丽珠)进行扳机,注射36 h后经阴道B超引导下取卵,按照常规方式进行IVF或ICSI受精。
2.胚胎培养:受精后将胚胎置于G1 plus培养液(Vitrolife,瑞典)进行培养。受精后18~20 h观察2PN(2 Pronucleus),受精后68~70 h观察卵裂期胚胎发育情况,在患者签署知情同意书后,将达到培养囊胚标准的胚胎转移至G2 Plus培养液(Vitrolife,瑞典)培养囊胚。直到D5或D6将达到4期及以上的囊胚进行玻璃化冷冻。
3.囊胚评估:根据Gardner囊胚分级标准分期(3~6期)[3期:囊腔充满整个胚胎;4期:囊腔出现扩张,直径大于原始的胚胎直径,透明带扩张后变薄;5期:出现滋养层从透明带中孵出,但并未脱离透明带;6期:囊胚组织完全孵出,并脱离透明带]。
另外根据细胞数分为A~C级[A级:内细胞团紧紧包裹,细胞数较多,外胚层细胞较多并形成连续的上皮;B级:内细胞团细胞较分散且量少,较少的外胚层细胞形成疏松的上皮;C级:内细胞团细胞数目很少,很少几个大细胞构成外胚层]。将囊胚级别在4BB以上定义为优质囊胚。
4.囊胚冷冻与解冻:采用玻璃化冷冻试剂盒(Kitazato,日本),根据使用说明书,待液体恢复室温后,将囊胚在ES液中平衡10~13 min,再转移至VS液中吹洗(控制在60 s内),随后立即将囊胚装载于冷冻载杆(Kitazato,日本)上,迅速浸入-196℃的液氮中。
囊胚解冻前,将解冻液TS液提前放置于温箱30 min以上,将需要解冻的载杆捞至泡沫盒,快速从液氮中捞出并完全浸入TS液中1 min,随后按照操作手册依次捞至DS液3 min、WS1液5 min,37℃热台上捞至WS2液5 min,最后转移至囊胚培养皿G2 Plus培养液(Vitrolife,瑞典)中。使用激光破膜仪进行辅助孵化,尽可能完全穿透透明带,最后放入培养箱等待移植。
5.囊胚移植及妊娠判定:囊胚解冻后培养时间限定及分组:本中心具有3组同步运营胚胎实验室,移植当天3组同一时间开始解冻囊胚。按照固定顺序,第1组首先开始移植,并且在囊胚复苏后2 h以内结束移植,随后第2组移植,最后第3组移植,第3组最晚移植时间在囊胚复苏后4 h以内。次年更换移植顺序,第3组先移植,第1组最后移植。
囊胚移植后常规给予黄体支持,移植后第12天测定血β-HCG水平,HCG>50 U/L视为阳性。阳性患者于移植后4周进行阴道B超检查,观察有无妊娠囊和胎心,移植后3个月随访B超情况,并于分娩后再次进行电话随访。
三、评价指标
患者一般资料,包括年龄、不孕年限/类型、体质量指数(BMI)、受精方式、胚胎质量、解冻周期内膜厚度/激素水平、用药方案等;移植周期临床结局,包括HCG阳性率=血β-HCG阳性周期数/移植周期数×100%,临床妊娠率=临床妊娠周期数/移植周期数×100%,生化妊娠率=血β-HCG阳性但无临床妊娠周期数/移植周期数×100%,胚胎着床率=孕囊数/移植胚胎数×100%(单胚胎移植孕囊数记为1),多胎率=多胎妊娠周期数/临床妊娠周期数×100%,早期流产率=孕12周内自然流产周期数/临床妊娠周期数×100%;活产率=活产胎儿周期数/移植周期数×100%。
四、统计学分析
采用SPSS 21. 0统计学软件处理数据。计量资料符合正态分布用“平均数±标准差”(x±s)表示,组间比较采用检验;计数资料采用率(%)表示,组间比较采用检验。采用Logistic回归分析评估冻融囊胚移植后的HCG阳性率的影响因素及相关性。P<0.05为差异具有统计学意义。
结 果
一、患者一般资料对比
本研究共纳入1 867个冻融囊胚移植周期,患者年龄范围在20~37 岁之间。
移植1枚囊胚解冻后不同培养时间的两组(A1和B1组)以及移植2枚囊胚解冻后不同培养时间的两组(A2和B2组)之间,在患者年龄、不孕年限、体质量指数(BMI)等基础资料以及解冻周期激素水平、用药方案等临床资料的差异均无统计学意义(P>0.05)(表1)。
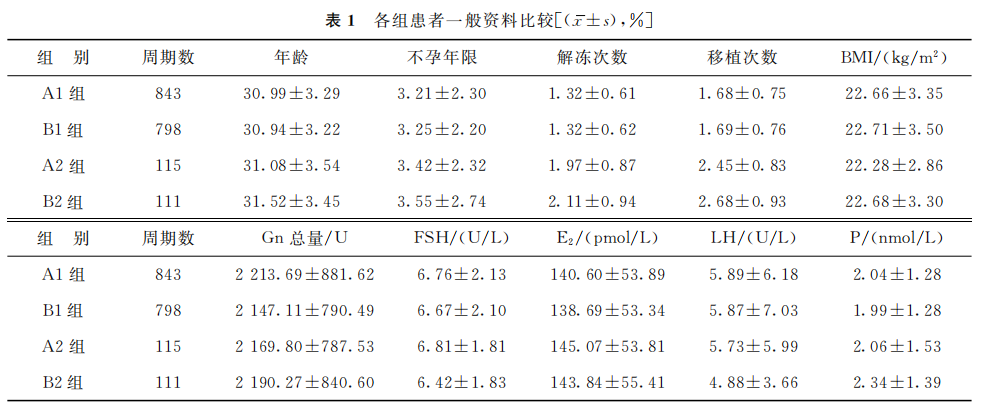
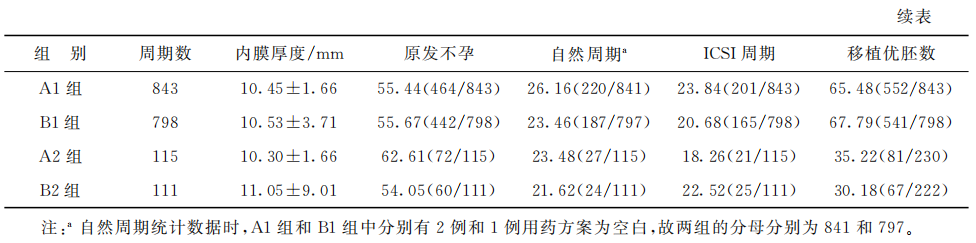
(表1)
二、患者临床结局比较
移植1枚囊胚两组(A1和B1)间的比较:A1组HCG阳性率、临床妊娠率、胚胎着床率、活产率均略高于B1组,而多胎率、早期流产率、异位妊娠率均略低于B1组,但差异均无统计学意义(P>0.05);移植2枚囊胚两组(A2和B2)间比较:A2组HCG阳性率显著高于B2组(P<0.05),其余指标均无显著性差异(P>0.05)(表2)。
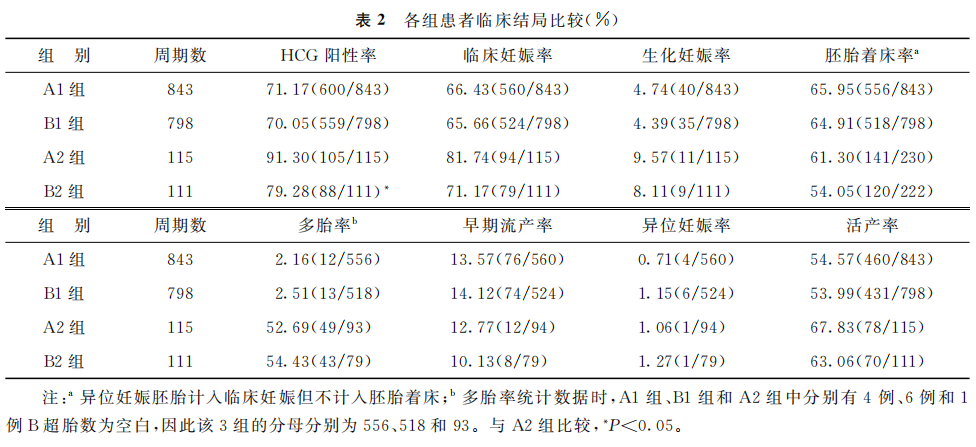
(表2)
三、影响HCG阳性率的多因素分析
因移植1枚囊胚的两组(A1和B1)间的临床结局差异无统计学意义(P>0.05),故只对HCG阳性率有统计学差异(P<0.05)的移植2枚囊胚的患者(A2和B2)资料进行统计学分析。以HCG阳性率为因变量,囊胚培养时间<2 h、不孕年限、内膜厚度、BMI、不孕类型、受精方式、内膜准备方案为协变量,通过SPSS软件进行Logistic分析。结果表明,移植2枚冻融囊胚时移植前培养时间<2 h是HCG阳性率的独立影响因素 [OR=2.210,95% CI(1.028,4.752),P=0.042](表3)。
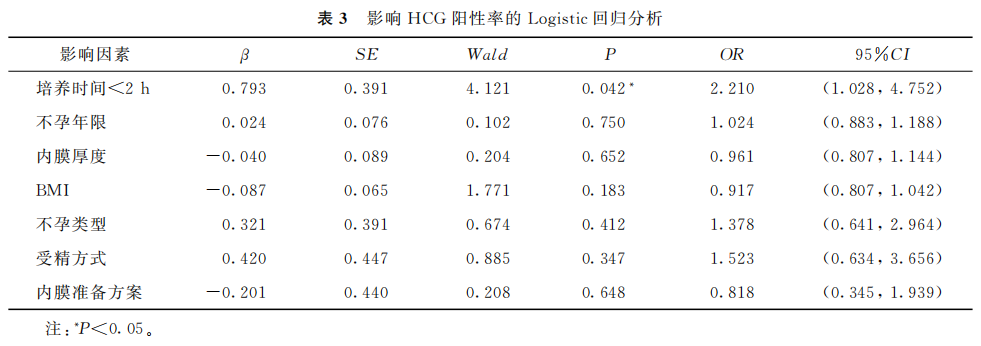
(表3)
讨 论
随着辅助生殖技术(ART)的迅速发展,胚胎玻璃化冷冻技术已趋于成熟,现已逐渐成为各大中心主要的胚胎冷冻方法,这项技术能将胚胎冷冻保存的复苏率提高到90%以上。
胚胎复苏后移植也可以解决促排卵后子宫内膜与胚胎发育不同步的问题,提高了ART助孕的成功率。将胚胎培养至囊胚阶段,进一步通过形态学比较来筛选,又可以提高累计妊娠率,并且降低患者成本。
一般认为影响玻璃化冷冻后移植结局的因素主要集中在患者的年龄、移植数目、移植次数、胚胎级别、内膜厚度、激素水平等方面。但胚胎的质量才是患者成功受孕的关键,我们一般通过复苏后对胚胎进行一段时间的培养来观察其存活状态及发育潜能。
目前关于冻融胚胎移植前的培养时间对妊娠结局的影响,国内外学者仍旧在不断讨论中。一部分研究认为胚胎复苏后培养2~4 h和过夜培养对后续临床妊娠率、活产率并无太大差异。而也有研究认为培养2 h后移植可以提高着床率和妊娠率,降低流产率。关于解冻后更短的培养时间对妊娠结局的影响却鲜有研究。
囊胚复苏后的扩张程度可作为预测后续临床结局的重要参数,一般解冻复苏后15 min就可以看到囊胚腔轻微增大,1~2 h已经能够表现出其恢复扩张状态的能力,所以选择培养时间<2 h仍旧可以通过形态学观察来判断复苏是否成功。
陶林林等对解冻后培养2~5 h和<2 h做了比较研究,认为培养2~5 h提高了患者的临床妊娠率和着床率,但其并未对移植数目进行分类统计,且囊胚样本量不足500例。
本研究在更大的样本量基础上进行了移植数目的限定,同时通过分组移植来保证解冻后培养时间的可控性,每隔一年对组间移植顺序进行对调,从而消除人员及仪器的系统误差。患者一般资料也进行了更加丰富的对比,如既往移植次数、患者自身对照等均无显著差异。本研究结果显示移植1枚囊胚时解冻后培养<2 h和2~4 h在各方面均无显著性差异。冼英杰等将囊胚移植前培养时间分为≤2 h、2~4 h和4~6 h进行了比较,得出的结论是培养时间并不影响临床结局,本研究结果与之一致。
但本研究发现当移植2枚囊胚时,更短的培养时间可以显著提高冻融周期移植后HCG阳性率(91.30% vs.79.28%,P<0.05),临床妊娠率趋向于高于培养2~4 h(81.74% vs. 71.17%),同时胚胎着床率和活产率也有提高的趋势,尽管均未达统计学意义(P>0.05);在双囊胚移植的不利影响方面,缩短培养时间并未明显提高患者生化妊娠率、多胎率、早期流产率以及异位妊娠率(P>0.05)。
针对此结局产生的差异,进一步对移植2枚冻融囊胚进行了Logistic回归分析,结果显示解冻后培养时间在2 h以内是HCG阳性率的独立影响因素[OR=2.210,95% CI(1.028,4.752),P=0.042],提示培养时间越短HCG阳性率越高。β-HCG是由胎盘的滋养层细胞分泌,其浓度影响胚胎的运输以及生长发育,进而影响胚胎早期植入,合理的利用β-HCG绝对数值也有助于识别宫外孕或流产。本研究中各组间的生化妊娠率及着床率并无显著差异,我们认为其HCG阳性率的差异主要由囊胚移植后在宫腔内终止发育导致。
对比移植1枚囊胚(A1+B1)组与移植2枚囊胚(A2+B2)组的基础资料数据,可以明显发现移植2枚囊胚组的整体优胚占比显著低于移植1枚囊胚组(32.74% vs. 66.61%,P<0.001)。
Wang等认为低质量胚胎在冷冻解冻过程中受到的损伤更大,并且表现出了更高的氧化应激水平。Swain等认为实验室培养基类型、pH值、温度、渗透压和氧浓度等变量都是影响胚胎非整倍体的可能因素,人工模拟的体内环境始终无法取代生理的输卵管和子宫。Gardner等从代谢动力学方面展开研究,认为培养环境中的氨基酸、维生素及葡萄糖利用率影响胚胎发育,这些代谢过程受培养环境的氧气浓度所影响,表明非优质胚胎适应能力更差,缩短体外培养时间可以更好的维持胚胎发育的潜力。
因此,我们推测,对于质量较好的胚胎而言,移植时间并不影响其发育潜能,但是对于质量较差的胚胎而言,很难适应目前的培养系统所提供的发育环境,尽早的与母体接触可以恢复其生理功能,从而改善患者妊娠结局。
本文关于解冻当天培养时间对妊娠结局的影响研究,虽然样本量较大,但是依然存在些许不足,如本研究仅为单一中心的回顾性分析,且年龄限定为非高龄人群(<38岁),囊胚级别限定为4期。实际工作中我们移植双囊胚时,仍有许多高龄患者,此次研究并未囊括。
综上所述,囊胚的解冻移植可以选择在移植日当天进行解冻复苏。对于单囊胚移植,培养时间在4 h内临床结局无明显差异,实际工作中可合理安排时间进行相关操作;对于双囊胚移植,若解冻的囊胚确定存活并观察到囊胚的扩张,应尽快进行移植,尤其对于胚胎质量较差的患者,可以降低体外环境对胚胎发育潜力的影响,从而改善临床结局。
文章来源:杨喆东,李波,薛侠,等.玻璃化冷冻囊胚复苏后不同体外培养时间对临床妊娠结局的影响[J].生殖医学杂志,2024,33(7):860-865.


