45%的PD-L1阴性局部晚期NSCLC患者放化疗后再次活检PD-L1呈阳性,获益于度伐利尤单抗维持治疗
时间:2024-09-08 06:05:25 热度:37.1℃ 作者:网络
放化疗(CRT)是局部晚期非小细胞肺癌 (LA-NSCLC) 的首选选择。针对LA-NSCLC患者,一些将程序性细胞死亡1(PD-1)轴抑制剂与放疗联合治疗LA-NSCLC患者的临床试验正在进行中。然而,CRT对肿瘤细胞程序性细胞死亡配体1(PD-L1)表达的影响尚不清楚。在这项多中心回顾性研究中,研究者分析了CRT前后获得的配对NSCLC标本。通过免疫组织化学检测肿瘤细胞上的PD-L1表达。本研究旨在评估PD-L1阴性LA-NSCLC患者在CRT后进行再次活检的可行性、并发症风险和临床相关性。
总体而言,分析了来自6个中心的31名PD-L1阴性LA-NSCLC患者。在14名患者(45%)中,CRT前后标本中PD-L1表达的肿瘤细胞百分比显著增加。9名患者在CRT后PD-L1表达没有变化,5名患者的再次活检材料不足以进行PD-L1分析,2 名患者在再次活检时未发现肿瘤细胞。再次活检后并发症发生率非常低(6%)。除一名因结核病复发而长期住院的患者外,所有再次活检PD-L1阳性的患者在CRT后均接受了度伐利尤单抗维持治疗。PD-L1表达不变或增加的患者的中位PFS分别为10个月和16.9个月。
CRT治疗可以在基线时诱导相当一部分PD-L1阴性患者表达PD-L1,使他们能够在欧洲接受度伐利尤单抗维持治疗。因此,在确定性CRT治疗后,应考虑对LA-NSCLC PD-L1阴性患者进行PD-L1重新检测,以便更好地选择度伐利尤单抗维持治疗候选者。
研究背景
非小细胞肺癌(NSCLC)是全球第二大常见癌症,也是癌症相关死亡的主要原因,约25%的患者在确诊时患有局部晚期疾病。历史上,对于体能状态良好且无法切除的局部晚期NSCLC(LA-NSCLC)患者,标准治疗一直是含铂双药化疗联合放射治疗(即放化疗:CRT)。然而,接受CRT治疗的患者的中位无进展生存期较差(约8个月),5年时仅有15%的患者存活。尽管尝试通过将不同的新药与CRT相结合来改善患者生存率,但结果令人失望,直到Pacific试验的结果出现。事实上,随机3期PACIFIC试验为不可切除的LA-NSCLC建立了新标准,引入了使用抗PD-L1药物度伐利尤单抗进行免疫治疗维持的概念,适用于CRT后疾病未进展的患者。与安慰剂相比,在CRT后使用度伐利尤单抗进行长达12个月的维持治疗可提高总生存期 (OS:3年时43.5个月vs 29.1个月) 和无进展生存期(PFS),任何级别的免疫相关副作用均较低(25%)。
PD-L1由肿瘤微环境中的细胞表达,并与T细胞上的PD-1结合。它触发T细胞受体的抑制信号传导,降低T细胞杀伤能力并阻断效应功能。然而,肿瘤细胞上的PD-L1表达是动态的,可通过给予肿瘤治疗(例如CRT)来诱导。有证据表明,在接受新辅助CRT后进行手术的NSCLC患者中,PD-L1表达显著增加。考虑到这一点,CRT后的再次活检可能更好地选出PD-L1阳性患者。反对再次活检的理由包括并发症风险以及可能无法获得足够量的肿瘤组织进行分析。尽管如此,在最初PD-L1呈阴性的患者接受CRT后进行PD-L1重新检测,可以为原本无法从中获益的患者提供维持性度伐利尤单抗,因为欧洲药品管理局(EMA)已建议仅对PD-L1肿瘤比例评分((TPS)≥1%的患者使用度伐利尤单抗。因此,尽管美国食品药品管理局(FDA)和其他制药机构已批准在所有患者中使用度伐利尤单抗,无论PD-L1表达如何,但PD-L1阴性患者在欧洲不能接受该治疗。EMA基于事后分析得出这一结论,该分析显示,肿瘤不表达PD-L1的患者与对照组相比没有生存优势。
因此,这项回顾性多中心研究的目的是分析不可手术的LA-NCSLC患者(诊断时为PD-L1阴性)CRT前后的配对NSCLC标本,以探索CRT对PD-L1的影响。此外,这项工作旨在评估在PD-L1阴性LA-NSCLC患者中CRT后系统地进行再次活检的可行性、并发症风险和临床相关性。
研究结果
从2019年1月到 2022年1月,来自6家意大利中心的31名连续患者符合纳入标准并被纳入本研究。所有入组患者在诊断时均为PD-L1阴性LA-NSCLC患者,均接受了前期CRT(同步或连续)治疗。除一名患者因急性心脏事件而推迟再次活检外,其余30名患者(97%)均在前期CRT后接受检查。使用PD-L1 IHC 22C3 pharmDx试剂盒来检查PD-L1表达。PD-L1阳性肿瘤细胞的百分比由专业病理学家评估,他们对临床结果不知情。TPS计算为显示部分或完全膜染色的肿瘤细胞相对于样本中所有肿瘤细胞的百分比。根据染色强度,分为四组:阴性(<1%)、弱(≥1%和<5%)、中等(≥5%和<50%)和强(≥50%)。如果没有发现恶性细胞或仅发现疑似恶性细胞,则不进行PD-L1 TPS。
患者特征总结于表1中。其中,大多数患者为男性(81%)和吸烟者(90%);13名患者为IIIA期疾病,12名患者为IIIB期疾病,6名患者为IIIC期疾病。9名患者为鳞状组织学,22名患者为非鳞状NSCLC。大多数患者(48%)接受紫杉醇加卡铂作为CRT方案。
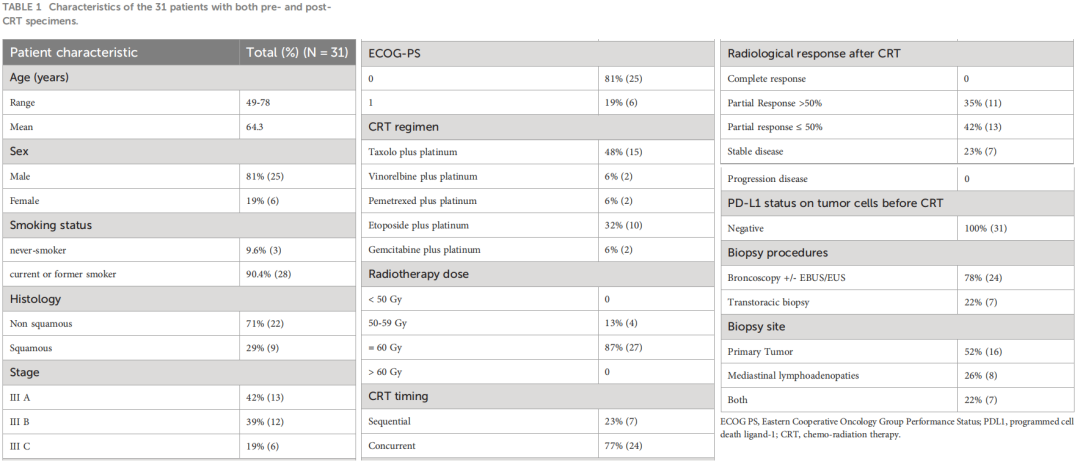
表1
再次活检的特征和结果见表2。放疗最后一天与再次活检之间的中位时间为31天(15-56天)。在放疗后有足够样本的24名患者中,14名(58%)在放疗后标本中肿瘤细胞PD-L1表达呈阳性。阳性率为45%(95%CI:35-55)。9名患者的放疗前和放疗后标本中PD-L1表达均为阴性。5名患者的再次活检样本不足以进行PD-L1分析,2名患者在再次活检时未发现肿瘤细胞。
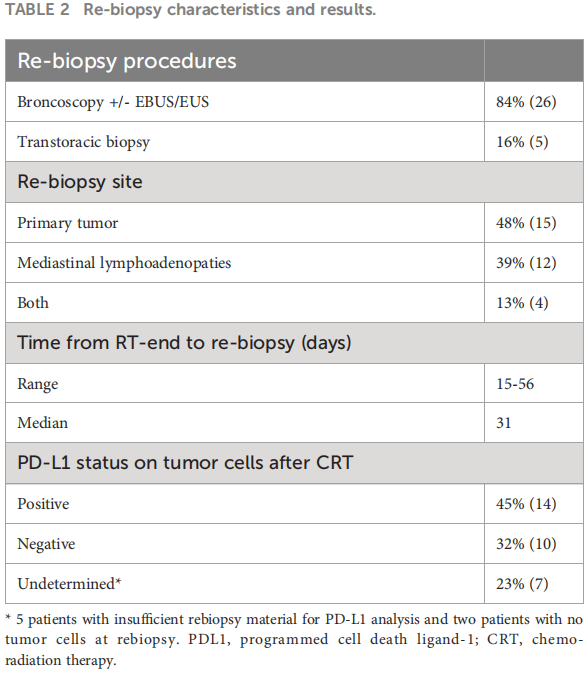
表2
分别有15名(48%)患者、12名(39%)患者和4名(13%)患者的再次活检部位为原发性肺肿瘤、纵隔淋巴结肿大或两者兼有。28名患者的再次活检部位与原始活检部位相符(解剖位置相同)。3名患者(9.6%)的再次活检取自诊断性活检以外的其他部位。26名患者的再次活检在“肺内镜科”进行,采用支气管镜检查(肺病变)、支气管/气管周围(支气管内超声,EBUS)或胃食管旁(内镜超声,EUS-无论是使用 EBUS内镜(EUS-B)还是传统EUS镜)结构进行。5 名患者进行了肺病变经胸取样。表 2报告了再次活检的方式。
所有患者在再次活检过程中均未发生任何严重的急性并发症。CRT后再次活检的总体并发症发生率为6%(n = 2,1例气胸和1例支气管出血)。所有患者均未发生任何严重的晚期并发症或后续后遗症。
在接受再次活检的31名患者中,有14名(45%)获得了再次活检的潜在临床相关性;事实上,在14名PD-L1 TPS从阴性变为阳性的患者中,可以给予度伐利尤单抗维持治疗(一名患者由于同时出现复发性结核病而无法服用度伐利尤单抗)。
研究者还研究了PD-L1表达变化与生存时间之间的关联。这些生存曲线如图1所示。在24名具有足够CRT后样本的患者中,CRT后样本中的PD-L1表达与PFS适度增加相关(PD-L1 阳性组 vs PD-L1阴性组,中位数分别为16.9个月 vs 10个月,p = 0.6),而中位OS无差异(PD-L1阳性组 vs PD-L1阴性组,中位数分别为20个月 vs 14个月,p >0.5)。14 名CRT后PD-L1阳性的患者中有13名(93%)在观察期间接受了度伐利尤单抗维持治疗。在这些患者中,中位PFS和OS分别为17.7个月和21.3个月。没有患者EGF-R呈阳性,而ALK重排和KRAS突变分别仅出现在一名患者中。
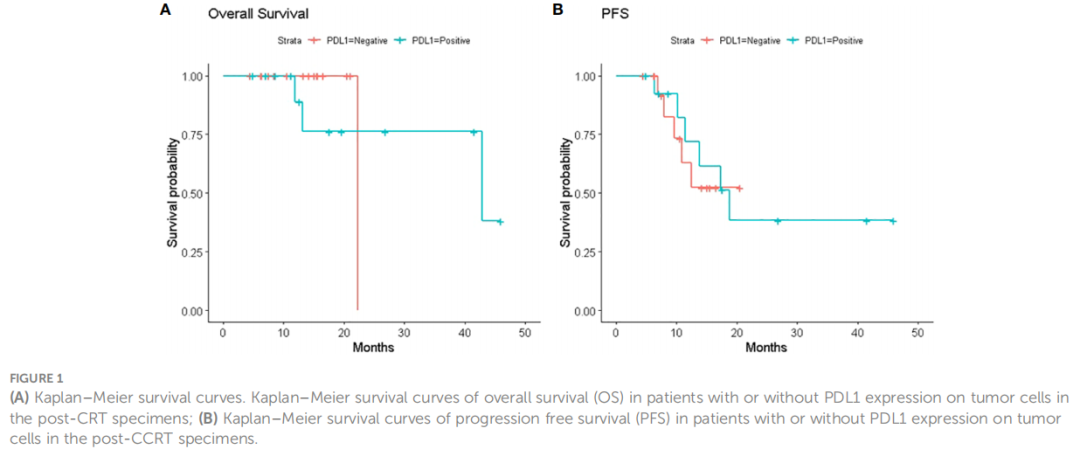
图1
讨 论
在对CRT后疾病缓解或稳定的不可切除LA-NSCLC患者进行的PACIFIC试验中,度伐利尤单抗显著改善了PFS和OS。这些结果使“PACIFIC 方案”(CRT后使用度伐利尤单抗)逐渐成为此类治疗的标准方案,并促使度伐利尤单抗获得全球批准,用于治疗铂类CRT治疗后病情无进展的不可切除LA-NSCLC患者。然而,在欧洲,根据欧洲药品管理局(EMA)要求的事后分析结果,患者的肿瘤还必须有≥1%的肿瘤细胞(TCs)表达PD-L1。
目前关于NSCLC中PD-L1 TPS变化的研究主要以回顾性研究为主,纳入对象为局限性/可切除病变、接受过新辅助或辅助化疗的患者,但结果仍不一致,存在争议。例如,Sheng等人报道NSCLC新辅助化疗后PD-L1阳性率由75%降至37.5%,而Rojkó等人报道肺癌患者新辅助化疗后PD-L1表达无明显变化,Song等人证实肺鳞癌患者新辅助化疗可以上调PD-L1的表达,Guo等人的研究也证实了这一点。
然而,据研究者所知,目前尚无前瞻性研究探讨CRT后再次活检对LA-NSCLC的作用,无论是可行性还是临床相关性。一项回顾性研究纳入了35名LA-NSCLC患者,其在CRT前后获取了配对的NSCLC标本,结果显示CRT后PD-L1阳性肿瘤细胞的百分比显著下降。
本项多中心回顾性研究表明,在基线时PD-L1 TPS结果为阴性的患者中,大约一半可通过CRT给药诱导PD-L1 TPS表达。因此,由于PD-L1 TPS表达从阴性(<1%)变为阳性(>1%),因此对这组患者进行重新活检可能会增加根据EMA标准接受度伐利尤单抗维持治疗的候选人数量。本研究的数据表明,使用各种活检方式进行重新活检是可行的、安全的,因为未记录到严重并发症,并且成功率很高。后者的数据很有趣,因为Chouaid及其同事先前报告称,18%(没有肿瘤细胞)和7%(肿瘤细胞太少)的病例因活检中肿瘤组织不足而无法进行分子分析,这对他们来说是一个挑战。
多项研究已探索了不同肿瘤部位PD-L1 TPS的差异,并已就肿瘤间和肿瘤内异质性达成普遍共识,尤其是在IV期NSCLC中。几乎所有这些研究都评估了IV期NSCLC原发性和转移性肿瘤部位之间PD-L1表达的一致率,并报告PD-L1 TPS <1% 或 ≥50% 的肿瘤具有高度一致性。最近的一项研究证实了这些数据,作者指出,由于已知且广泛研究的PD-L1表达异质性,因此可以质疑观察到的PD-L1 TPS变化是否能够仅用再次活检的位置不同来解释。这些作者发现,在与诊断性活检相同或其他位置进行再次活检的患者中,PD-L1 TPS的变化发生率几乎相同。本研究的样本量太小,无法确定是特定的活检步骤而不是活检部位有更大的样本不足风险;但更多的活检可以提高步骤的成功率,这当然是有道理的。
考虑到人们对在之前接受过放射治疗的区域进行活检的恐惧,以及多达40%的患者在基线时没有适合进行组织学PD-L1评估的肿瘤活检(例如,由于使用细针抽吸收集的组织不足),以及PD-L1表达的细胞学评估虽然可行,但在常规临床实践中尚未广泛标准化,这一数据是值得探索的。不考虑PD-L1阴性且在CRT后拒绝接受度伐利尤单抗维持治疗的患者。
本研究存在一些局限性。首先,这是一项回顾性研究,样本量相对较小。其次,考虑到PD-L1表达的评估存在很大差异和一些问题,必须强调的是,研究者未对原发活检或再次活检进行集中审查。第三,研究者没有使用荧光原位杂交(FISH)来研究PD-L1表达,而这种技术通常被认为更可靠。
总 结
一线治疗后,进展性IV期NSCLC患者通常会接受再次活检,因为它可以提供重要的生物学信息来指导二线治疗决策。然而,尽管再次活检具有潜在的临床优势,但它并不是强制性的,也不是日常临床实践中经常采用的检查。
本研究表明,重新活检是可行的,并发症风险低,并且对于PD-L1阴性的LA-NSCLC患者具有临床意义。因此,对于PD-L1阴性的LA-NSCLC患者,应在确定性CRT后考虑重新确定PD-L1,因为这可能使他们能够接受度伐利尤单抗维持治疗。当然,未来的前瞻性研究需要验证本研究的结果。
参考文献:
Ciammella P, Cozzi S, Borghetti P, Galaverni M, Nardone V, Ruggieri MP, Sepulcri M, Scotti V, Bruni A, Zanelli F, Piro R, Tagliavini E, Botti A, Iori F, Alì E, Bennati C and Tiseo M (2024) Redetermination of PD-L1 expression after chemio-radiation in locally advanced PDL1 negative NSCLC patients: retrospective multicentric analysis. Front. Oncol. 14:1325249. doi: 10.3389/fonc.2024.1325249



