从化疗到免疫治疗,复发转移宫颈癌长生存病例分享
时间:2024-09-22 06:04:28 热度:37.1℃ 作者:网络
01 病例介绍
病例摘要
患者:女,46岁
初诊时间:患者于2020-10因“宫颈癌放化疗后2年,发现全身多发转移1月”初次就诊北京大学肿瘤医院
既往及家族史:无特殊
诊断:宫颈低分化鳞癌ⅢC2r期 腹盆淋巴结转移
外院治疗
初始治疗:
患者2018-10因“阴道不规则出血”就诊当地医院,完善检查后确诊为宫颈低分化鳞癌ⅢC2r期,腹盆淋巴结转移。
于2018-10开始完成当地放化疗:
①95%PGTVn(腹盆转移淋巴结)48Gy/95%PTV(腹盆淋巴引流区、宫旁、阴道)40Gy/20f,后加量95%PGTVn12Gy/5f,95%PTV10Gy/5f。
②于2018-10-26、11-02行顺铂60mg同步化疗2周期。
③后行腔内后装治疗7次(具体剂量不详)。
疗效:CR
第一次复发:
2019-07发现左锁骨上淋巴结,3.0*1.5cm,活检病理示鳞癌,考虑宫颈来源。
于2019-08至2019-09在当地医院完成左锁骨上转移淋巴结放疗:
①95%PGTVnd(左锁骨上转移淋巴结)60Gy/95%PTV(左锁骨上淋巴引流区)54Gy/30f。
②因骨髓抑制未能同步化疗。
2019-10复查CT:CR
第二次复发:
自2019-12以来,患者出现腰部酸痛,进行性加重。
颈部CT示颈部多发淋巴结较前增大,自扪及左侧颈部肿物。
于2020-06就诊北京大学肿瘤医院。
北京大学肿瘤医院治疗
病理会诊:原(宫颈)低分化鳞癌。
2020-06腹盆CT:宫颈未见肿块,后纵隔、腹膜后、右侧闭孔区多发肿大淋巴结,考虑转移。
2020-06胸部CT:左侧锁骨上、后纵隔、脊柱旁多发肿大淋巴结。
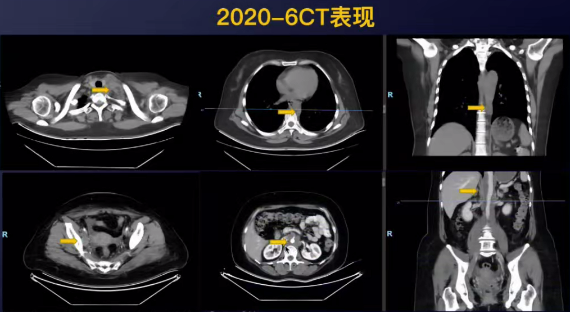
因患者分期晚,全身转移淋巴结广泛,无法行局部放疗,以全身治疗为主。
于2020-07至2020-09行4周期白蛋白紫杉醇+奈达铂方案化疗联合贝伐珠单抗靶向治疗。
4周期疗效评价:PR
2020-09CT示:食管旁纵隔淋巴结基本消失,腹主动脉旁多发淋巴结明显消退。
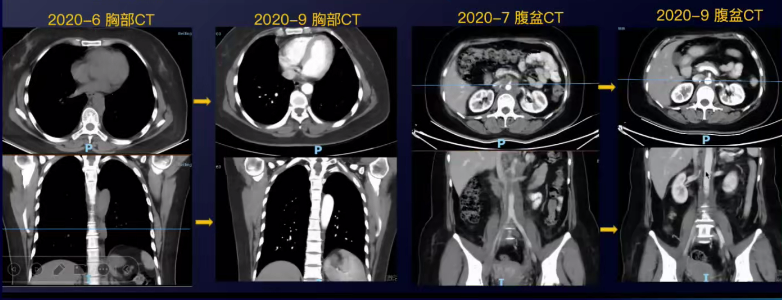
因患者PD-L1 CPS=30,肿瘤负荷大,于2020-10第5周期加用免疫治疗。
患者消化道反应较前继续加重,拒绝后续化疗。
不良反应:白细胞减少3度,中性粒细胞减少3度,贫血2度,血小板减低1度,恶心2度,食欲下降2度,外周神经毒性2度,偶有牙龈出血。
后续治疗:
因PD-L1阳性,且近期有出血症状,选择免疫维持治疗。
2020-11开始免疫维持治疗,PD-1单抗 200mg d1 q21d。
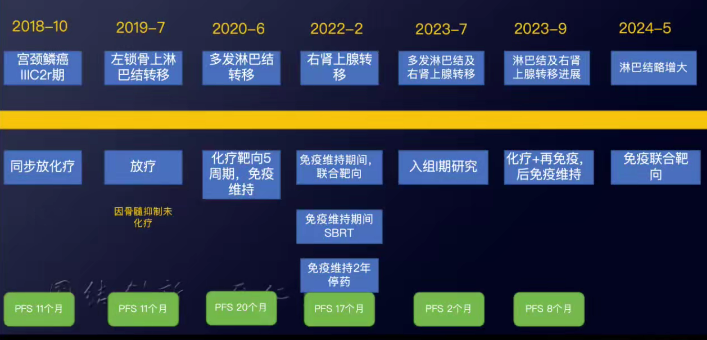
期间3个月复查一次,维持PR。免疫维持至2022-2。PFS 17个月。
2022-02CT示:后纵隔、腹膜后、右侧闭孔区多发淋巴结部分同前、部分较前缩小。右侧肾上腺结节增大,考虑转移。
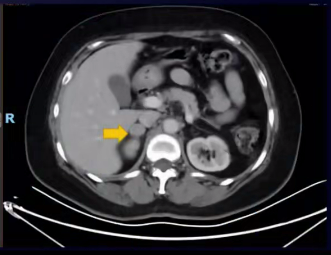
下一步治疗方案:
患者为免疫治疗期间出现局部进展,推荐免疫治疗继续,联合局部治疗。
但患者既往放化疗后,病灶略大,行SBRT不良反应较大,先行免疫治疗联合靶向治疗(患者拒绝化疗),后再考虑加用SBRT局部放疗。
采用继续免疫治疗,加用贝伐珠单抗靶向治疗,至2022-10。
2022-06复查:右肾上腺病灶缩小,2022-09复查:右肾上腺病灶维持PR(略增大)。
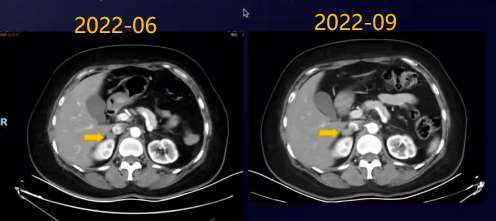
2022-10继续免疫治疗,行肾上腺转移灶放疗,SBRT 1OX-FFF 95%PTV(右肾上腺转移灶)40Gy/5次/5d。
免疫治疗维持2年(末次2022-11)
2022-12复查CT:右肾上腺病灶明显缩小;后纵隔、腹膜后、右侧闭孔区多发淋巴结大致同前。
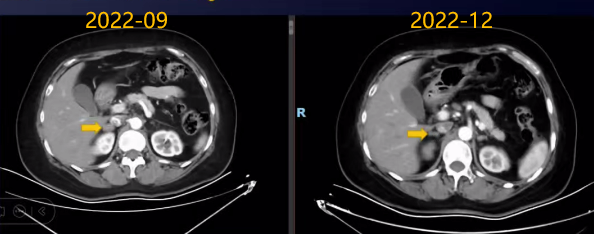
与患者沟通,建议免疫维持治疗,因经济原因患者考虑暂时不用药,观察随访。
2023-07再次进展(停药7个月)
2023-07腹盆增强CT:后纵隔区域、腹膜后、右侧闭孔区多发肿大淋巴结较前增大,较大位于右侧闭孔区,原约17x10mm,现约21x12mm;腹膜后较大者原约17x7mm,现约23x13mm。右肾上腺体部结节增大,原约10x6mm,现约17x13mm。
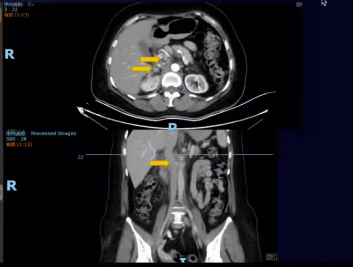
2023-07入组“一项评估LTC004在晚期或恶性肿瘤患者中的安全性、耐受性、药代动力学级药效学的I期临床试验”。
2023-09 PD出组。CT示:后纵隔区域、腹膜后、右闭孔区多发淋巴结大部分较前增大;肠系膜血管周围新见多发稍大淋巴结;右肾上腺体部肿物增大,现约46x23mm。
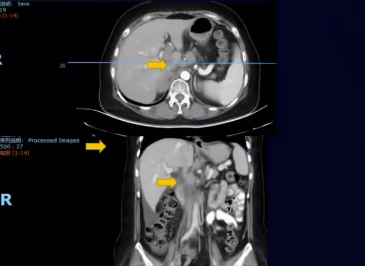
因多发进展,建议全身化疗+贝伐珠单抗+免疫治疗,患者暂不想双药化疗,因经济问题患者未行靶向治疗。
2023-09开始行单药化疗联合免疫治疗8周期:顺铂100mg+PD-1单抗200mg q21d。(由于既往双药化疗副作用大,因此不采用双药化疗;因经济原因不考虑靶向治疗)
疗效评价:PR
2024-02复查CT示:腹主动脉旁多发淋巴结明显退缩。
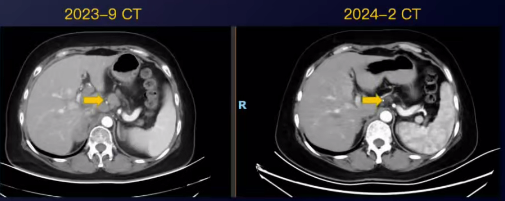
2024-03开始免疫维持治疗,2024-05CT疗效评估略增大。
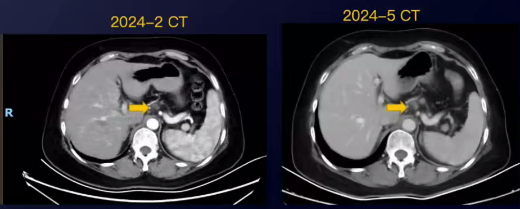
2024-05开始行免疫治疗加用贝伐珠单抗靶向治疗,截至此次MDT会议开展,患者依旧进行治疗。
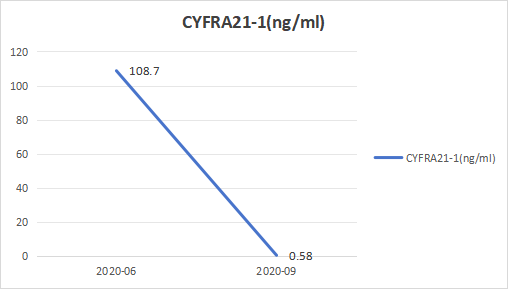
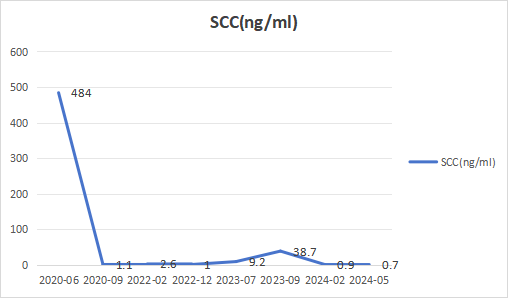
肿瘤标志物变化
治疗经过小结
02 病例讨论
问题 1:针对这种复发转移的宫颈癌,在免疫治疗期间如何去看待它的爆发进展、缓慢进展和局部进展。在临床上一般考虑如何去决策后续的治疗方案?
北京医院-肿瘤内科-刘焱:这个病例为晚期的宫颈癌,当时诊断为ⅢC2r期,如果诊断得更加细致明确,有可能还是IV期。患者通过放化疗、免疫、化疗和靶向的三联或二联治疗的不断调整,达到了5年8个月的长生存,并且现在病情依旧稳定。体现出了宫颈癌治疗的现状和趋势,即所有实体瘤都强调联合治疗。对于后续的治疗,我认为在患者经济条件允许的情况下应该尽量维持治疗。
北京友谊医院-肿瘤中心-马妮娜:该病例从2018年10月一直到现在,免疫治疗贯穿着治疗的全过程。随着Keynote 158问世以来,NCCN指南就把免疫治疗归到PD-1阳性的二线治疗,然后逐渐进入到一线。总的来说,免疫治疗给宫颈癌患者带来了较长生存期,是宫颈癌治疗的重要手段之一。
宫颈癌的局部治疗相较于其他癌种要重要一些。晚期患者的局部治疗,内科医生更看重全身系统治疗,治疗完再考虑局部治疗,但宫颈癌局晚期出现寡转移的情况,在临床上会进行处理顺序的调整,把局部治疗放在前面。此外,对于宫颈癌的治疗来说,放疗也是非常重要的,需要进行多学科的协作讨论。
这个病例中,患者对化疗的敏感性比较好。在进行化疗联合免疫以及后续的免疫维持治疗中,都得到了较长的PFS,这两者都结合了化疗。尽管我们已经进入了免疫治疗时代,并且ADC类药物可能成为更好的选择,但我认为在当前阶段,化疗仍然是一个非常重要的治疗手段。在应用免疫治疗和抗血管生成治疗的同时,我们不应忽视化疗的重要性,它仍然是我们治疗策略中的关键手段。
在宫颈癌的治疗中,化疗药物的选择相对有限,常用的药物种类不多。但现在,随着抗血管生成治疗、免疫治疗以及ADC类药物的出现,我们有了更多的治疗选择,这不仅为患者提供了更多可能性,也为医生提供了更多的治疗武器。然而,如何合理地安排这些治疗方法,如何“排兵布阵”,对我们来说是一个挑战。
山东省立医院-肿瘤微创综合治疗科-杨淑萍:这个病例非常精彩,这位晚期宫颈癌患者自2018年至今,已经生存了5年多,这表明她的治疗效果非常好。患者对治疗的反应非常敏感,无论是化疗联合靶向治疗,还是化疗联合免疫治疗,或是免疫治疗的维持治疗,都取得了显著的效果。特别是她的第二次和第三次维持治疗,其PFS都能达到大约20个月,这样的治疗成果为她的长期生存提供了可能。
在癌症治疗中,肿瘤迅速进展的时候,需要与假性进展鉴别开来。真正的肿瘤进展意味着肿块的实质性增大,而假性进展可能只是炎症细胞的浸润。对于某些粘液腺癌,我们尤其需要注意,因为它们可能在实性成分上没有明显增加,但在液性成分上却有显著增加,这需要我们进行仔细鉴别。
对于局部进展的处理,尽管在宫颈癌方面我们可能缺乏足够的经验或临床试验数据,但我们可以借鉴其他肿瘤的治疗策略。例如,在肺癌治疗中,如果出现局部进展,我们可能会继续使用原有的治疗方案,并考虑增加局部治疗,如放疗、手术等。
至于缓慢进展,免疫治疗的特性之一是起效较慢。我们常说要给免疫治疗足够的时间来发挥作用,如果在两个治疗周期后,肿瘤只是缓慢增大,我们可能会再等待两个周期。在许多肿瘤治疗中,尤其是胆管癌,我们有时会观察到这种缓慢增大,但随后可能会看到免疫反应的激活和临床疗效的改善。
天津医科大学肿瘤医院-放疗科-朱莉:这个病例自2018年初次发现以来,尽管我们对她之前接受的放疗和化疗剂量不是完全熟悉,因为她是从其他医疗机构转诊过来的,但根据她的治疗时间线来看,她接受了相当规范的治疗。她能够维持一年甚至更长时间的无进展生存,这本身就是一个积极的信号。然而,一年后她出现了锁骨上淋巴结转移,随后接受了针对性的放疗。不幸的是,她的病情继续进展,出现了纵膈淋巴结和腹主动脉旁淋巴结转移。她最终转诊到了北京大学肿瘤医院。
从2020年到2024年6月的最新复查,这4年间,尽管患者的病情有所进展,但进展速度相对较慢。她的优势在于,转移仅限于淋巴结,而没有涉及到重要的脏器,如肺、脑、骨骼或肝脏。这为我们提供了继续治疗的机会。在治疗策略上,无论是化疗、抗血管生成治疗,还是单纯的免疫治疗,过去四年的治疗效果都是成功的,因为它们至少在一定程度上控制了病情的进展。虽然影像学上可能仍然可以看到肿瘤残留,但肿瘤标志物的显著下降表明病情得到了控制。对于这部分患者,我认为可以通过PET-CT来辅助诊断肿瘤体系上的是放化疗后的激化反应还是真的肿瘤活性。
我认为这个患者的进展属于缓慢进展,持续的免疫治疗是有效的。因此,我个人认为,如果当前使用的免疫治疗药物有效,就不太建议轻易更换其他免疫治疗药物,除非出现耐药。当然,每种免疫治疗药物都有其细微的差别,但它们的总体作用机制是相似的。如果再次出现进展,我们可以考虑更换其他药物,或者根据患者的具体情况,考虑其他治疗选项,如ADC药物,这些药物现在对低表达也有效率。
总的来说,这个病例的治疗是成功的,它展示了免疫治疗在宫颈癌治疗中的潜力。随着新药物的不断发展,我们有理由对未来的治疗持乐观态度。
问题 2:免疫治疗两年之后,病人的病情不管是已经完全消失还是维持稳定的状态,如何看待他是否需要继续免疫治疗?
北京医院-肿瘤内科-刘焱:在患者经济条件允许的情况下应该继续免疫治疗,但治疗的频率可以适当减少,因为免疫治疗有“长拖尾”效应,免疫有效机制一旦形成,可能会持续存在。因此可以把治疗间隔拉长,比如从3周延长到6周,甚至2个月,以便减少患者的经济负担。
山东省立医院-肿瘤微创综合治疗科-杨淑萍:免疫治疗的维持问题在当前肿瘤治疗领域中是一个非常热门的话题。不同的临床研究提出了不同的维持时间建议,有的推荐一年,有的则建议两年。目前,还没有明确的指南来指导我们维持治疗的最佳时长。此外,关于免疫治疗是否可以跨线使用或者进行再挑战,也是一个值得探讨的问题。
对于在免疫治疗中出现进展的患者,一个可能的策略是更换化疗方案,同时继续使用原先的免疫治疗方案,以观察是否能够获得与之前相同的治疗效果。如果患者在治疗一段时间后再次出现进展,可以考虑是否恢复使用原来的免疫治疗方案。这些跨线和再挑战的治疗决策需要基于临床试验数据来做出指导。
对于这个持续进展的病例,我们可以考虑进行活检,以明确患者当前的疾病状况,这可能对治疗决策有所帮助。
北京协和医院-妇科肿瘤中心-彭澎:关于免疫治疗的持续时间,目前存在一些争议。有肺癌研究显示,使用免疫治疗超过两年的患者,其预后可能并不比在两年内停止治疗的患者更好。但这只是基于少量研究的结果,尚未得到广泛证实。对于这个患者来说,如果免疫治疗有效且经济条件允许,通常建议继续治疗。然而,对于治疗的最佳持续时间,还需要更多的临床研究来提供指导。
北京大学肿瘤医院-放疗科-尤静:关于这位患者的后续治疗方案,我们首先考虑的是,如果目前的免疫治疗显示出稳定或仅缓慢进展,我们通常不会放弃这种免疫治疗。因为一旦停止免疫治疗,转而选择其他药物,根据我们治疗复发性转移性宫颈癌的经验,可能没有其他特别有效的药物,且有效率会非常低。因此,我们倾向于继续免疫治疗,并在此基础上考虑更换其他药物。例如,我们可以考虑使用白蛋白紫杉醇联合国产的PD-1,或者贝伐珠单抗与PD-1联合使用。这些组合在二期临床研究中显示出较高的ORR,大约在50%到70%之间。然而,单独使用PD-1药物的有效率相对较低,研究数据显示ORR仅为17%,这证实了对于后线治疗的患者,单独使用免疫治疗的效果通常不是很理想。
但是,当免疫治疗与其他治疗如化疗和靶向治疗联合使用时,效果通常会更好。因此,我们会继续考虑使用这种联合方案。如果病情进一步进展,我们会考虑进行HER2免疫组化检测,以确定是否可以使用ADC类药物。目前,ADC类药物的ORR大约为30%,因此仍然值得尝试。正如彭教授所提到的考虑更换其他药物,如吉西他滨、依托泊苷以及小分子TKI类药物。我们已经在晚期患者中尝试了这些药物,但从整体有效率和毒性来看,它们可能不如目前的免疫治疗方案。除非患者无法继续使用当前的药物,否则我们不会轻易更换。
问题3:针对这种复发转移的宫颈癌一线治疗,目前来说,在化疗的基础上,联合治疗模式怎么选择比较合适?
北京友谊医院-肿瘤中心-马妮娜:这个患者在初始治疗的时候还没有免疫一线治疗的选择,现在一线治疗可以选择化疗联合免疫或者化疗联合抗血管生成药物的治疗方案。这个病例放到现在来说,我认为在给患者选择治疗方案的时候要考虑患者的PD-L1的表达情况、MSI的情况以及一些肿瘤标志物的情况。
北京大学肿瘤医院-放疗科-尤静:对于这种复发转移宫颈癌的一线治疗中,如何在化疗基础上选择免疫治疗和靶向治疗。其实这两者并不是互斥的关系,而是一个需要综合考虑的问题。
如果患者的PD-L1表达是阳性的,例如在KEYNOTE-826研究中,我们已经知道,只要PD-L1阳性,加入免疫治疗可以显著延长PFS和OS。由于宫颈癌患者中有90%是PD-L1阳性,因此大多数患者都可以从免疫治疗中获益。至于何时加入贝伐珠单抗,根据KEYNOTE-826今年发表的一项亚组分析,单纯加入贝伐珠单抗的患者与未加入的患者相比,PFS和OS也有显著延长。这意味着在免疫治疗的基础上,可以进一步考虑加入靶向治疗。然而,靶向治疗也伴随着副作用。例如,GOG 240研究在2014年发表的文章中证实,加入贝伐珠单抗后,有17%的患者会出现瘘,尤其是那些既往接受过放疗的患者。因此,在决定是否加入贝伐珠单抗时,我们需要考虑患者是否接受过放疗,以及放疗距离现在的时间是多久。这些因素将帮助我们决定是否以及何时加入贝伐珠单抗。
北京协和医院-妇科肿瘤中心-彭澎:首先,关于患者的后续治疗,我非常赞同马教授的观点,即使在靶向治疗和免疫治疗成为主流的今天,化疗仍然具有不可替代的地位。以这位患者为例,原来主要接受的是铂类为基础的化疗,再加上白蛋白紫杉醇。但还是有其他药物可以用,比如吉西他滨(宫颈癌二线治疗比较常用的药物),如果长时间没有紫杉醇类药物也可以重新考虑。然而,患者对化疗的副作用反应较大,因此他个人不愿意继续接受化疗。我认为,患者的意愿在治疗决策中也很重要,尤其是国外。
其次,关于PD-1/PD-L1抑制剂与ICI类药物是否存在交叉耐药性的问题,目前尚无定论。尽管同一类药物可能存在耐药性,但核心机制都是差不多的。不过,PD-1/PD-L1抑制剂与CTLA-4抑制剂之间是否存在交叉耐药,仍是当前研究的热点。
对于该患者,如果免疫再进展,是否可以尝试双免疫疗法,或者更换为CTLA-4抑制剂,或者PD-L1抑制剂,都是值得探讨的治疗方案。此外,如果患者对PD-1/PD-L1抑制剂产生耐药,是否可以考虑使用小分子TKI抑制剂,也是我们可以考虑的治疗策略。
03 MDT小结
该病例是一位64岁的晚期结直肠癌患者,在2010年行结肠癌根治术,2021年复发肝转移。当时,经过MDT讨论,患者被诊断为初治潜在可切除,分子分型显示为RAS和BRAF基因野生型。通过西妥昔单抗联合双药化疗的转化治疗,患者达到了显著的疗效。值得称赞的是,该病例在关键治疗节点均有MDT团队的参与。
该病例为46岁女性患者,初诊为ⅢC期伴淋巴结转移。这位患者是幸运的,对系统治疗的反应较好,无论是化疗、免疫还是靶向治疗,效果均不错。然而,由于经济原因和双药化疗副作用的影响,患者在某些治疗上的坚持并不理想。ⅢC期宫颈癌5年生存率一般为20%左右。患者目前已经历5年多的治疗,尽管影像学上看显示出一些进展,但肿瘤标志物(SCC)相对稳定,算是一个比较成功的病例。
述评
中国医学科学院北京协和医院-妇产科-吴鸣:在进行免疫治疗前,我们通常会评估一些关键的生物标志物。在宫颈癌中,使用MSI-H和TMB作为生物标志物存在难度,因为能从中获益的患者群体较小。与此相反,PD-L1的情况则有所不同。由于宫颈癌的主要病因是外来的HPV病毒,因此在正常的宫颈组织中PD-L1的表达很低,但在宫颈癌组织中,PD-L1的表达可以非常高,甚至达到80%或90%以上。
在宫颈癌的免疫治疗中,我们很少会单独使用免疫药物,因此,实际上我们可能不必过分关注PD-L1的表达水平,因为现在的治疗大多是联合免疫治疗。当然,对于某些身体状况非常差的患者,如果有某些生物标志物的指导,单独使用免疫治疗也可能是一个选择,这样患者可能会感到更好。我们不能因为一定要联合免疫治疗,而让患者承受极大的副作用,影响生活质量。
宫颈癌的治疗是最标准化的。对于早期患者,手术是首选,而对于非早期患者,从IB3期开始,放化疗就是首选了。这些治疗方法已经经过了几十年的验证。宫颈癌手术自2018年以来一直存在争议,即开腹手术与腔镜手术的优劣。目前认为,对于非常早期的肿瘤,如小于两公分的,腔镜手术与开腹手术效果差不多,尤其是那些已经接受过锥切的患者。但如果肿瘤较大,开腹手术可能优于腔镜手术。尽管如此,我们仍在进行RCT研究,入组已经结束,正在等待最终数据,看看是否能改变公认指南。
一旦宫颈癌复发,众所周知,临床上主要的治疗方案是TP方案化疗。对于宫颈癌患者,我们在使用贝伐珠单抗时非常谨慎,尤其是在复发时,尤其是那些过去在膀胱附近或直肠附近有病灶的患者。如果在这种情况下同时使用TP方案和贝伐珠单抗,发生漏的可能性大约是卵巢癌的5倍,接近5%。因此,在临床试验中,这种漏的发生也是相对较多的。
在宫颈癌治疗中,一旦患者使用PD-1抑制剂后疾病继续进展,更换另一种PD-1抑制剂往往也不会带来更好的效果,但是更换PD-1抑制剂并联合抗血管生成药物或联合免疫检查点抑制剂,亦或联合化疗,可能效果会好一些。关于PD-1抑制剂的使用时长,目前尚无定论。如果患者在使用PD-1抑制剂两年或更长时间后仍然保持CR,那么可以考虑停药。然而,如果患者在使用PD-1抑制剂期间是带瘤生存,那么停止治疗可能会带来风险。


