南方医科大郑磊、张静/港中文唐本忠院士《自然·通讯》:策略性设计的一价金配合物,通过化疗-光疗和诱导免疫原性细胞死亡协同根除肿瘤
时间:2024-09-23 15:00:58 热度:37.1℃ 作者:网络

研究背景:
近年来,癌症作为威胁人类健康的重大疾病,其发病率和死亡率在全球范围内持续增长。到目前为止,化疗仍然是癌症的主要治疗方法,但在临床上仍存在许多缺点,如缺乏肿瘤靶向性、强烈的毒副作用以及频繁用药导致的耐药性。近年来,免疫疗法已成为癌症治疗中一种强大而有前途的方法。其独特优势不仅在于消除局部转移性肿瘤,还在于通过长期免疫记忆预防肿瘤复发。尽管如此,它仍然存在一些缺点,如成本高、耐药性、单一模式治疗的适用性和有效性有限。因此,研究人员一直探索将免疫疗法与其他治疗方法相结合的协同方法,旨在实现癌症治疗的最佳效果。与传统治疗方法相比,光疗作为一种新兴的重要治疗方法,具有无创性和副作用小的优点。此外,由于其独特的诱导免疫原性能力,近年来引起了广泛关注。聚集诱导发光材料(AIEgens)作为光疗的理想载体之一,近年来在光疗应用方面展现出了巨大的潜力。AIEgens作为聚集体表现出增强的发射,具有较大的斯托克斯位移和较强的光稳定性。更重要的是,AIEgens还具有出色的荧光成像能力,可以将诊断和治疗功能集成到一个平台中,以进行精确成像引导的癌症治疗。然而,目前的AIEgens仍然面临着低吸收率和靶向能力不足的挑战,这限制了它们的发光和光疗效果。
为了应对AIEgens面临的上述挑战,南方医科大学郑磊教授和张静教授团队在之前的工作中提出了一个简单而有效的策略,通过引入一价金单元。这一策略涉及两个关键点:首先,它可以显著提升AIEgen配体的吸收效率,一方面显著增强了AIEgen的发光,同时也提升了非辐射光疗的效能。其次,一价金中心还通过一种特殊的硫氧还蛋白还原酶(TrxR)抑制途径实现优异的抗肿瘤性能。因此,引入一价金可以进一步实现化疗和光疗的联合,显著提高抗肿瘤疗效。尽管近年来在基于一价金的AIEgens抗肿瘤研究方面取得了一些进展,但该领域仍处于早期阶段。而且,目前的治疗方法主要集中在化疗和光疗上,关于免疫治疗的报道很少。考虑到当前免疫疗法和光疗的上述局限性,他们进一步提出开发可将化疗、光疗和免疫疗法三种相结合的一价金AIE体系,以实现更强大的抗肿瘤作用。
本文要点:
2024年9月18日,香港中文大学唐本忠院士、南方医科大学郑磊教授和张静教授、华东师范大学胡连瑞研究员作为共同通讯作者,南方医科大学冯娜博士生和华中师范大学彭振博士作为共同第一作者在Nature Communications在线发表题为“Strategically engineered Au(I) complexes for orchestrated tumor eradication via chemo-phototherapy and induced immunogenic cell death”的研究性论文。在这项工作中,提出了一种通过整合NHC-Au单元和AIE配体来设计一系列配合物的策略。受Arambula教授及其同事最近工作的启发,N-杂环卡宾(NHC)-Au络合物可以作为一种有效的免疫原性细胞死亡(ICD)诱导剂,通过氧化还原调节触发ICD。NHC-Au单元和AIE配体的融合旨在利用两者的优势,联合化疗、光疗和免疫治疗实现高效抗肿瘤。此外,本研究将NHC配体衍生为三苯基膦,并系统地比较了它们的生物成像和抗癌性能,以确定最佳候选者。最终,研究表明,所设计的卡宾金配合物1-3通过联合化疗、光疗和免疫治疗显示出有效的抗癌治疗效果(图1)。然而,更值得一提的是,以三苯基膦为配位的化合物4表现出更突出的成像和抗肿瘤性能。据悉,这是首例将化疗、光疗和免疫疗法整合到一体的金配合物体系。这种策略有望为高性能癌症治疗诊断药物的开发提供新的途径。
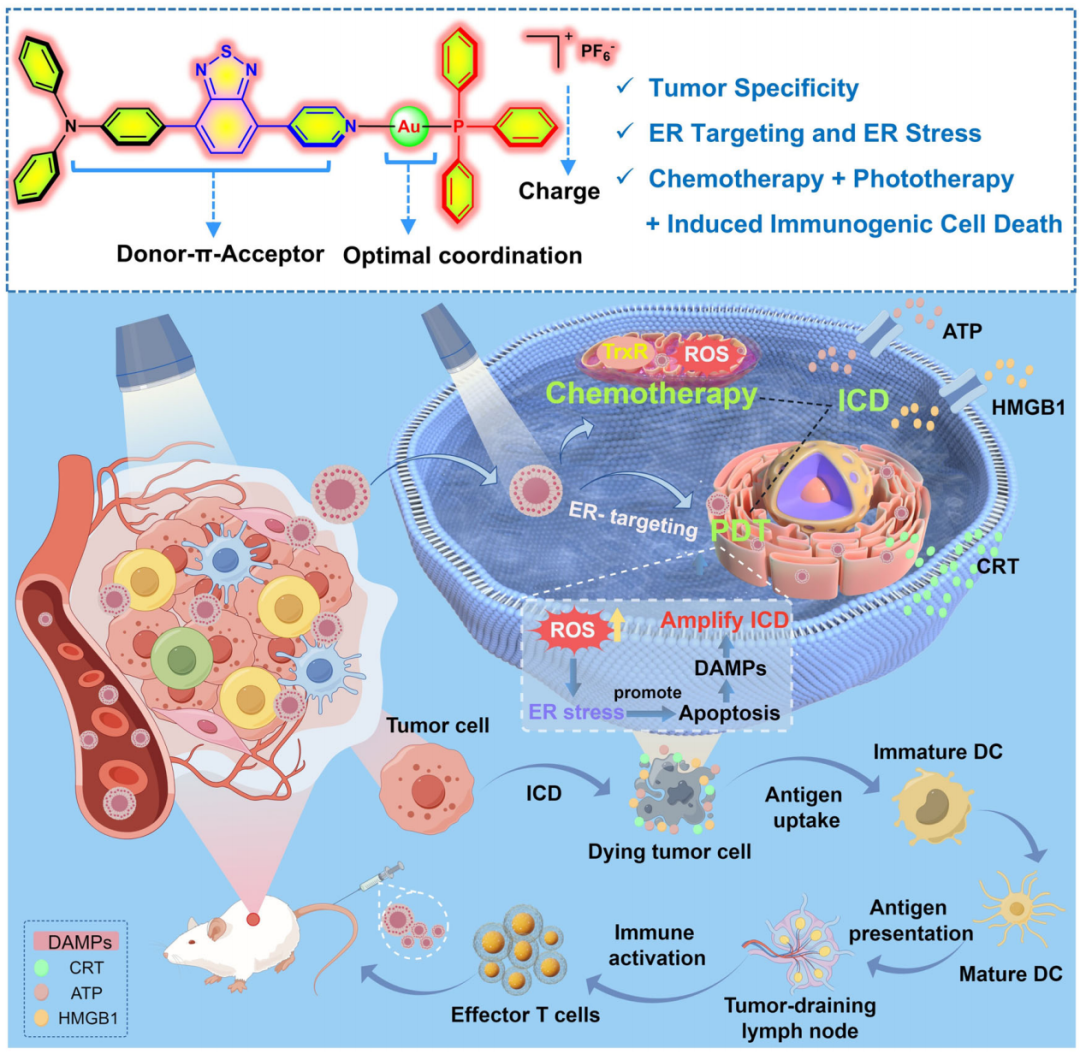
图1. 一价金配合物通过联合化疗和光动力学治疗(PDT)激活免疫原性细胞死亡(ICD)的分子设计原理和示意图(图源:Nature Communications)
本研究首先通过对各配合物进行光谱研究和分子结构理论计算,验证调控配体后,各配合物的吸收发射光谱及活性氧(ROS)生成能力的变化。结果证实了各配合物的吸收发射光谱出现不同程度的红移,尤其是配合物4;而配合物2-4具有更强的ROS生成能力(图2)。之后通过体外生物成像结果发现,配合物1-4具有良好的肿瘤细胞成像能力且对不同细胞器靶向效果不同(图3)。
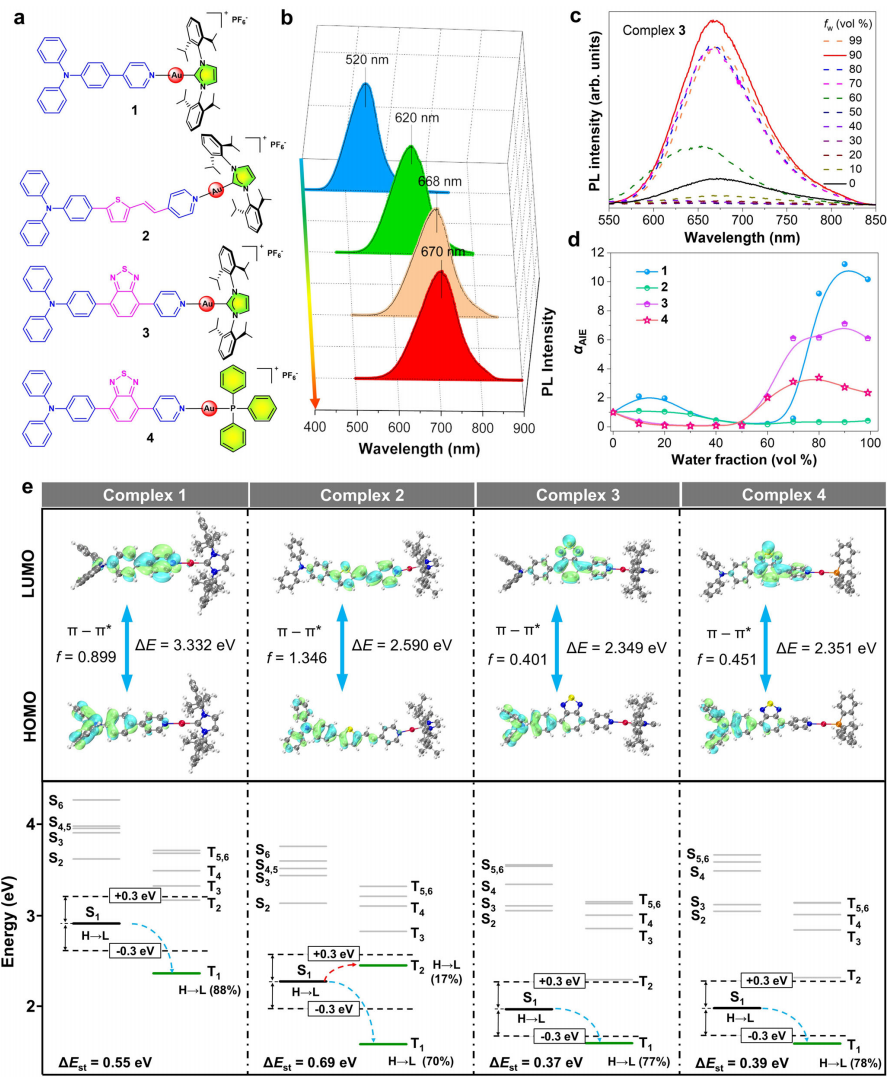
图2.配合物1-4的表征与性能研究(图源:Nature Communications)
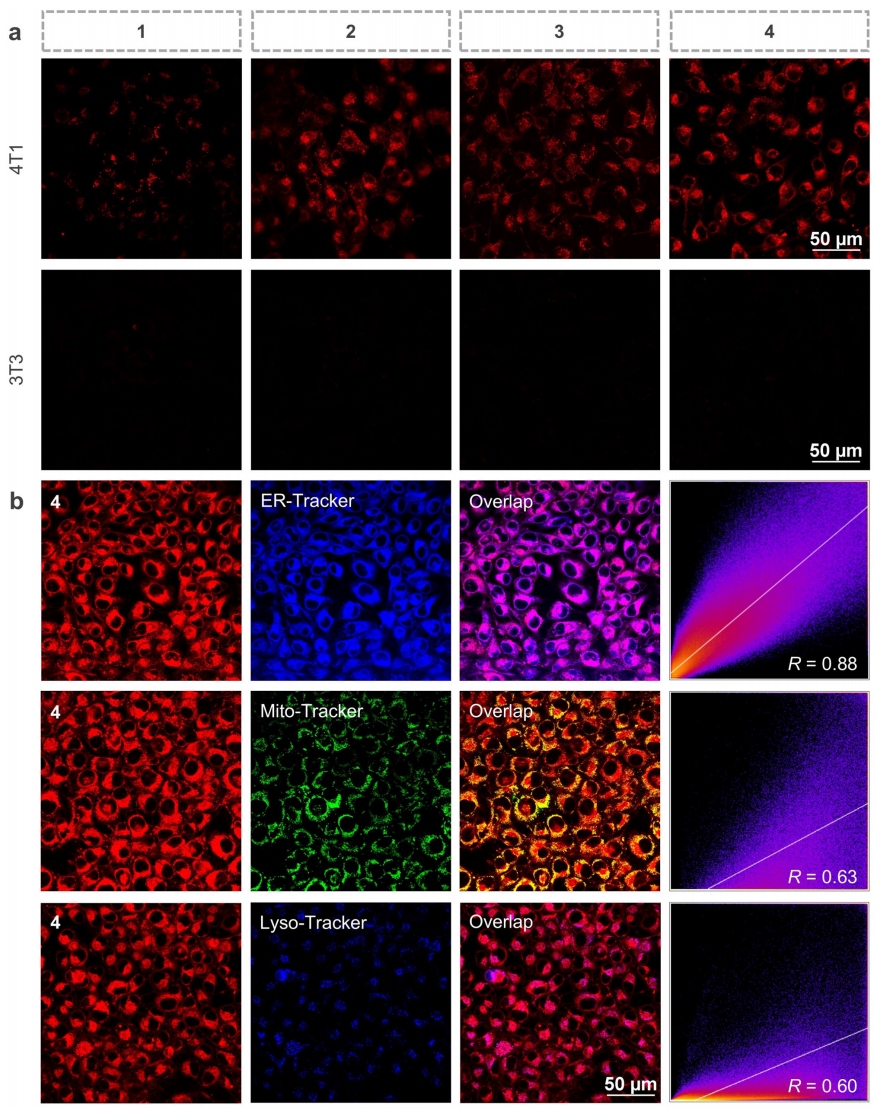
图3.配合物1-4的细胞成像和细胞器靶向(图源:Nature Communications)
体外细胞实验研究结果表明,配合物1-4具有良好的生物相容性,且对肿瘤细胞均具有一定治疗效果,其中配合物4在光照下表现出更优异的肿瘤杀伤效果(图4)。通过体外抗肿瘤机制研究发现,配合物4在抑制TrxR、胞内产生ROS、诱导凋亡等方面均表现更为出色(图5)。
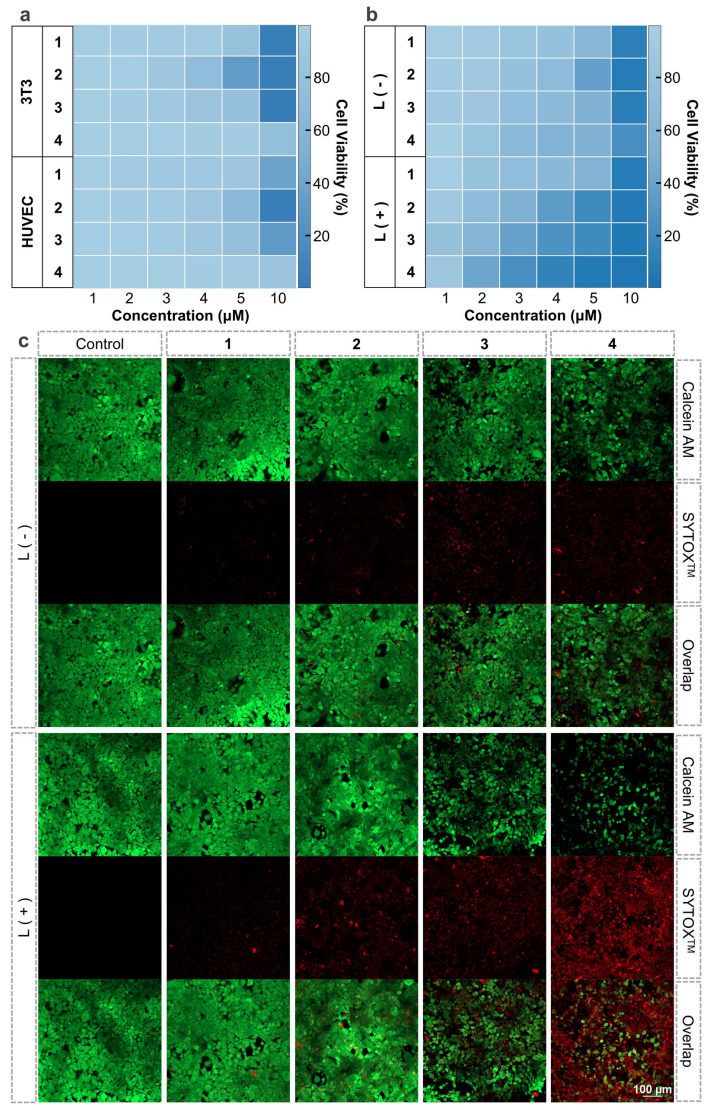
图4.配合物1-4的体外抗肿瘤研究(图源:Nature Communications)
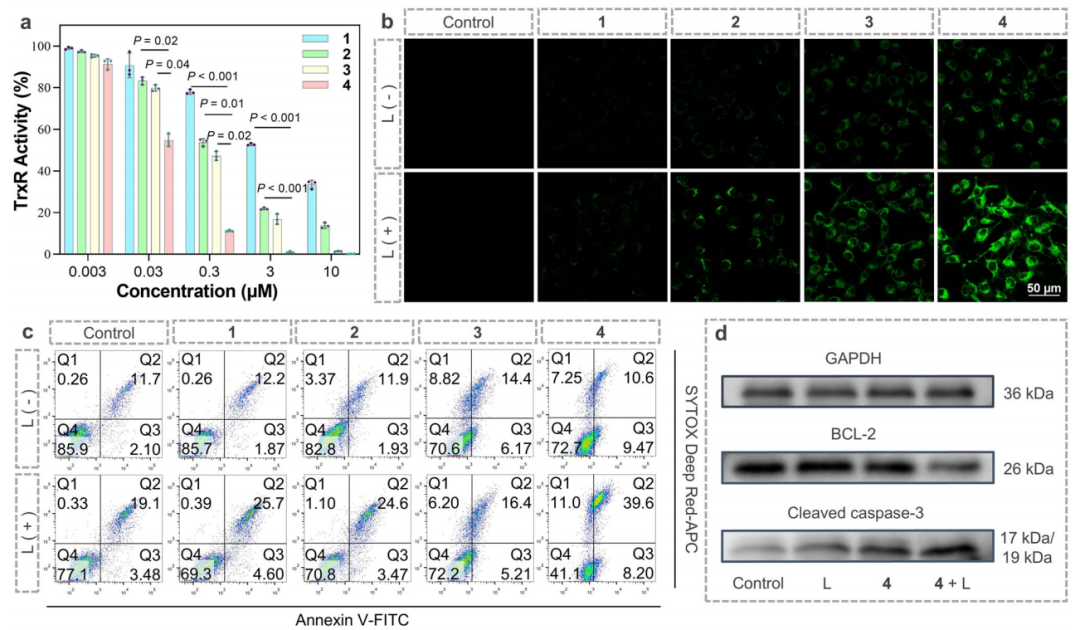
图5.配合物1-4的体外抗肿瘤机制(图源:Nature Communications)
由于配合物4具有一定的内质网靶向能力,并具有良好的光动力效应。配合物4产生的ROS会对内质网造成损伤,并可能诱导内质网释放钙离子,从而引发内质网应激的发生。为了进一步验证内质网应激的发生,研究者们通过蛋白质印迹实验检测了内质网应激相关的C/EBP同源蛋白(CHOP)和葡萄糖调节蛋白(GRP78)的表达水平证实了内质网应激的发生。随后通过检测损伤相关分子模式(DAMPs)包括钙网蛋白易位(CRT)、三磷酸腺苷(ATP)分泌、高迁移率组蛋白B1(HMGB1)等证明了配合物4能在体外光照下能有效促进与ICD相关的DAMPs的释放(图6)。
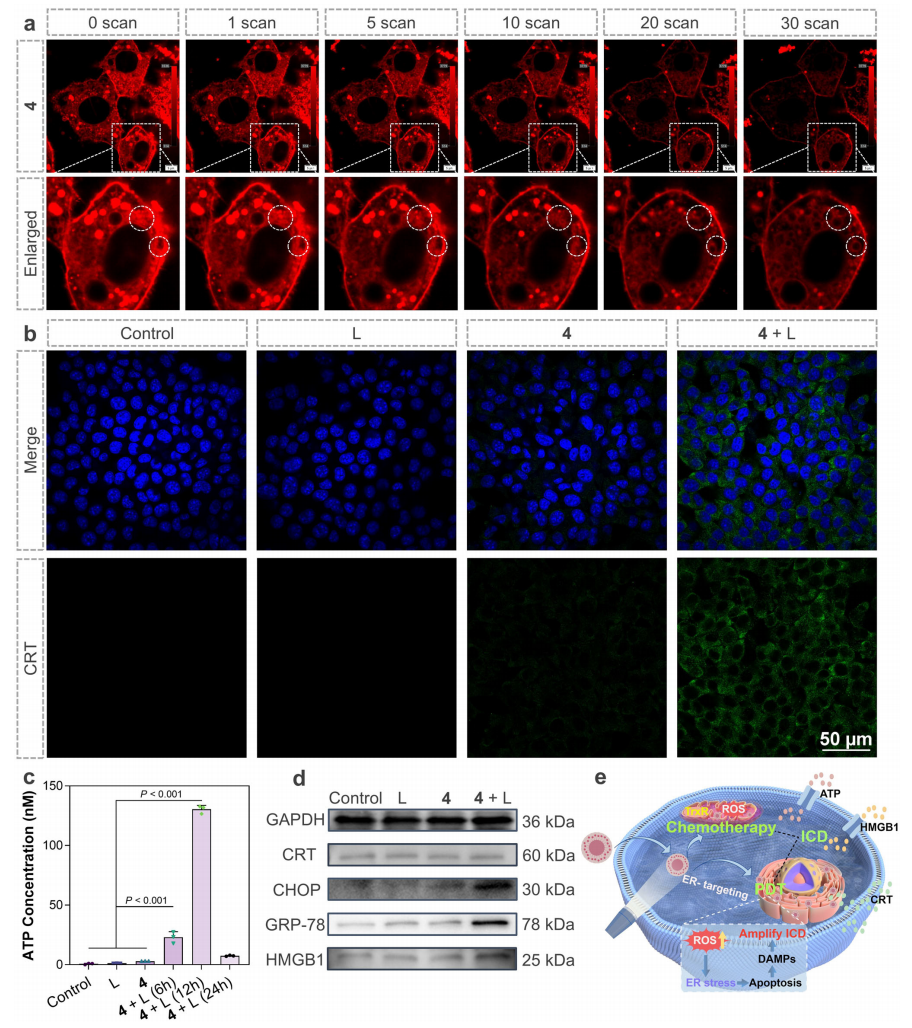
图6. 配合物4介导的体外ICD(图源:Nature Communications)
最后,该团队通过动物实验研究配合物4的体内抗肿瘤情况。活体成像结果表明配合物4能够在体内到达肿瘤部位。动物模型治疗结果表明配合物4在光照下能够有效抑制肿瘤生长(图7)。其肿瘤及脾脏切片及流式检测结果显示CD4+ T细胞和CD8+ T细胞被激活。这些发现表明配合物4介导的联合治疗在体内有效地触发了ICD,从而引发了相应的抗肿瘤免疫应答(图8)。
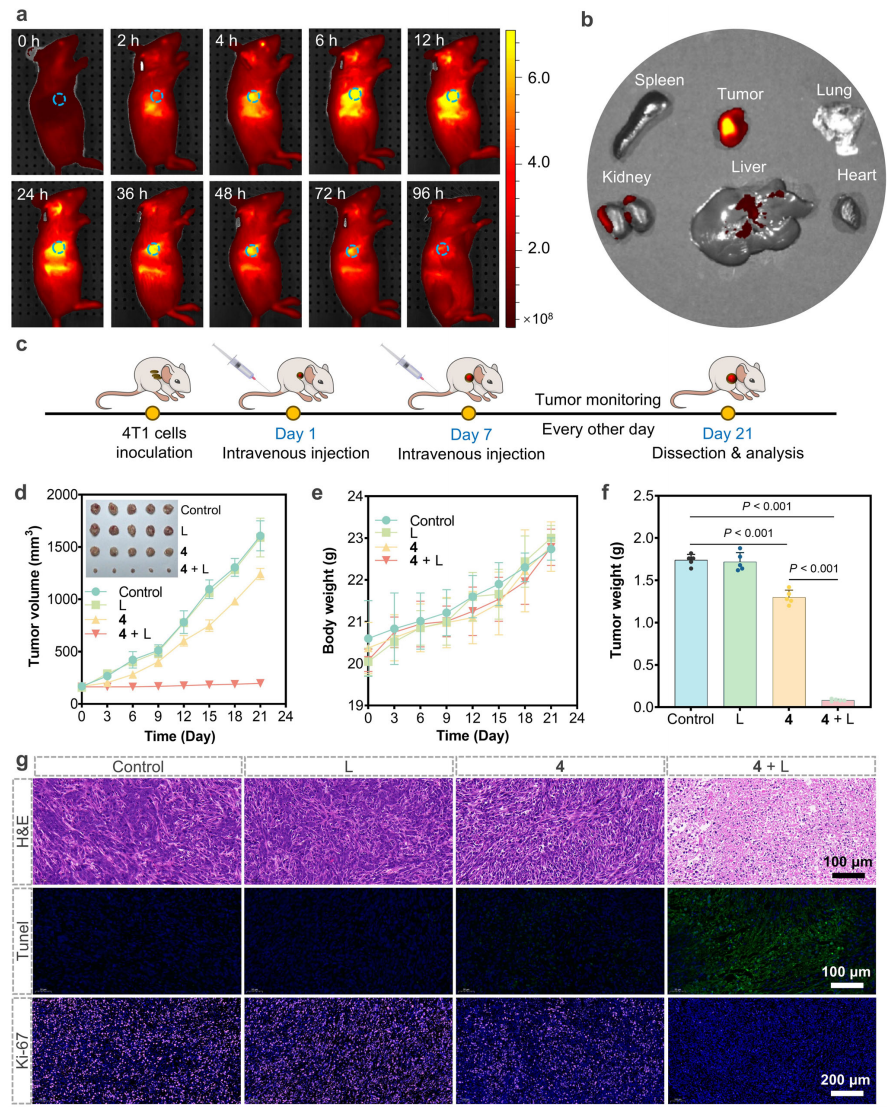
图7. 配合物4体内肿瘤成像与治疗(图源:Nature Communications)
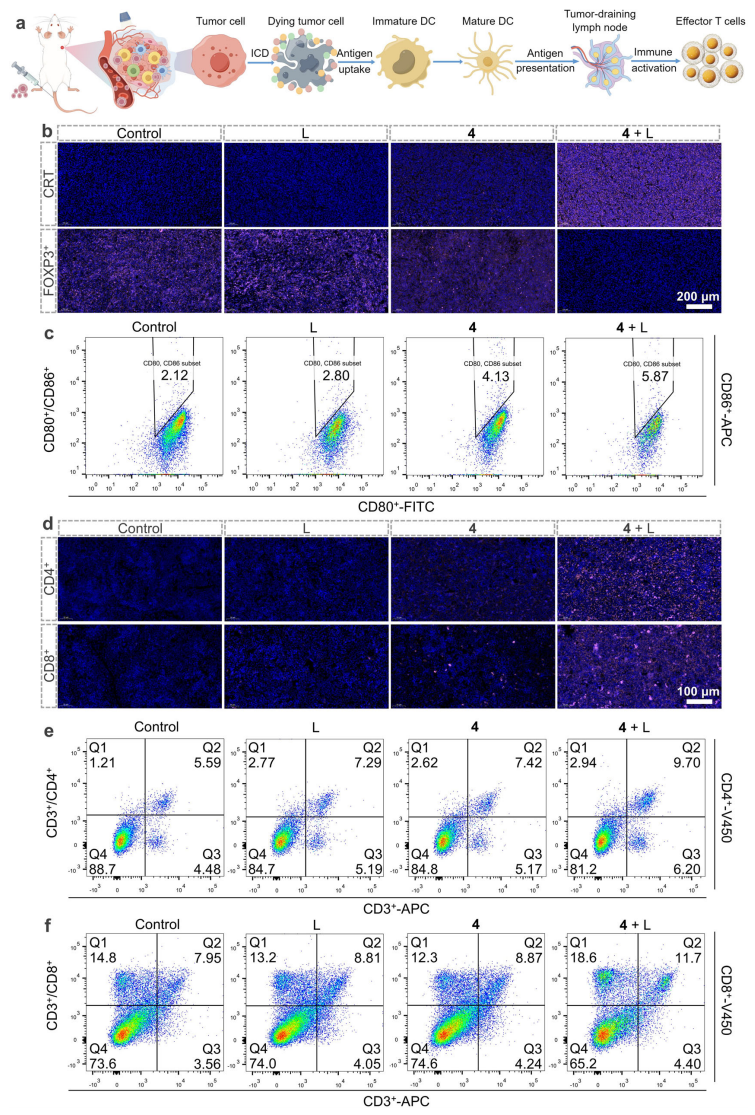
图8. 配合物4介导的体内ICD及相关肿瘤免疫应答(图源:Nature Communications)
【文章结论与讨论,启发与展望】
该研究通过将N-杂环卡宾一价金和三苯基膦一价金单元与AIE配体结合,设计了一系列新型的配合物,取得了化疗、光疗及免疫治疗联合的显著抗癌效果。体外实验证明了该系列配合物具有特异性肿瘤成像、细胞器靶向和强大的治疗能力。值得一提的是,其中以三苯基膦为配体的配合物4在所有评估方面都表现出最佳性能。该研究对潜在机制的全面探索表明,配合物4的有效抗癌作用源于有效的TrxR抑制、高效的ROS生成和以DAMPs显著释放为特征的细胞氧化应激诱导的ICD的协同作用,其中内质网应激发挥了重要作用。随后的体内实验也证实了配合物4出色的肿瘤成像能力,并通过激活免疫反应增强了其强大的治疗效果。因此,该研究的精心设计不仅赋予一价金配合物独特的分子结构,使其成为有效的光敏剂,而且还凸显了它们在体外诱导ICD和体内引起免疫反应的强大能力。然而,作者也提出该策略目前还面临一定的局限性。具体来讲,所设计的系列配合物的吸收光谱还无法达到更理想的600-850 nm范围,发射波长也在800 nm以下。因此,该系统的体内成像能力、组织穿透能力和光疗效果都受到了极大的限制。化学结构的进一步调控和成像性能提升的空间很大,可以将吸收扩展到更长的波长,提升吸收效率,同时达到更长的发射波长。
该研究受到国家重点研发计划项目、国家杰出青年科学基金、国家自然科学基金面上项目和青年项目、南方医科大学南方医院杰青培育计划项目、广东省基础与应用基础研究项目及上海市浦江项目等的资助。
原文链接:
https://doi.org/10.1038/s41467-024-52458-4


