Mol Cancer:中南大学李宁团队研究阐述了癌症代谢改变:能量途径和治疗靶点的见解
时间:2024-09-25 17:00:32 热度:37.1℃ 作者:网络
癌细胞经历重要的代谢重编程以支持其快速生长和存活。
2024年9月18日,中南大学李宁作为通讯作者在Molecular Cancer在线发表题为“Altered metabolism in cancer: insights into energy pathways and therapeutic targets”的研究综述,该综述探讨了糖酵解、氧化磷酸化、谷氨酰胺解和脂质代谢等重要的代谢途径,重点研究了它们是如何被调节的,以及它们对肿瘤发展的贡献。
研究了癌基因、肿瘤抑制因子、表观遗传修饰和肿瘤微环境在调节这些途径中的相互作用。此外,综述还讨论了靶向癌症代谢的治疗潜力,提出了糖酵解、谷氨酰胺解、TCA循环、脂肪酸氧化、LDH和葡萄糖转运的抑制剂,以及针对氧化磷酸化和脂质合成的新兴策略。尽管前景光明,但代谢可塑性、对联合疗法和强大生物标志物的需求等挑战仍然存在,强调了在这一动态领域继续研究的必要性。

癌症仍然是全世界发病率和死亡率的主要原因之一。尽管对癌症的理解和治疗取得了重大进展,但恶性细胞的复杂性和适应性继续构成持续的挑战。癌细胞的一个标志性特征是它们改变的新陈代谢,这支持了癌细胞在恶劣环境下的快速生长和生存。癌症代谢的研究可以追溯到20世纪初,Otto Warburg首次观察到癌细胞优先利用糖酵解产生能量,即使在氧气充足的情况下,这种现象现在被称为Warburg效应。Warburg的发现是革命性的,挑战了普遍认为线粒体氧化磷酸化是所有细胞(包括癌变细胞)的主要能量来源的观点。几十年来,随后的研究扩大了对癌细胞代谢重编程的理解,揭示了一个复杂的通路改变网络,有助于肿瘤发生和癌症进展。
癌细胞中的代谢重编程并不局限于糖酵解的增强。它包括各种代谢途径的一系列改变,包括即使在有氧条件下葡萄糖摄取和乳酸生成增加(有氧糖酵解),对谷氨酰胺的依赖性以进行脱水和生物合成(谷氨酰胺解),脂肪生成增强和脂肪酸氧化改变(脂质代谢),以及丝氨酸和甘氨酸等氨基酸代谢的变化。尽管强调糖酵解,但许多癌细胞仍然依赖线粒体呼吸来生存和增殖。这些改变是由癌基因和肿瘤抑制基因驱动的,它们重新连接细胞代谢以满足细胞快速分裂的需要,抵抗细胞死亡,并适应肿瘤微环境(TME)内的缺氧条件。在分子水平上,几个关键的调节因子协调了癌细胞的代谢重编程。致癌基因如MYC和RAS促进合成代谢过程,增加营养物质的吸收和利用。当肿瘤抑制基因如TP53和LKB1丢失时,可以增强糖酵解和生物合成途径。缺氧诱导因子(HIFs)诱导糖酵解酶和葡萄糖转运蛋白的表达,以响应低氧水平。AMP激活的蛋白激酶(AMPK)作为细胞能量传感器和调节器,平衡能量供需,而mTOR信号通路促进蛋白质合成和细胞生长,整合来自营养物质和生长因子的信号。
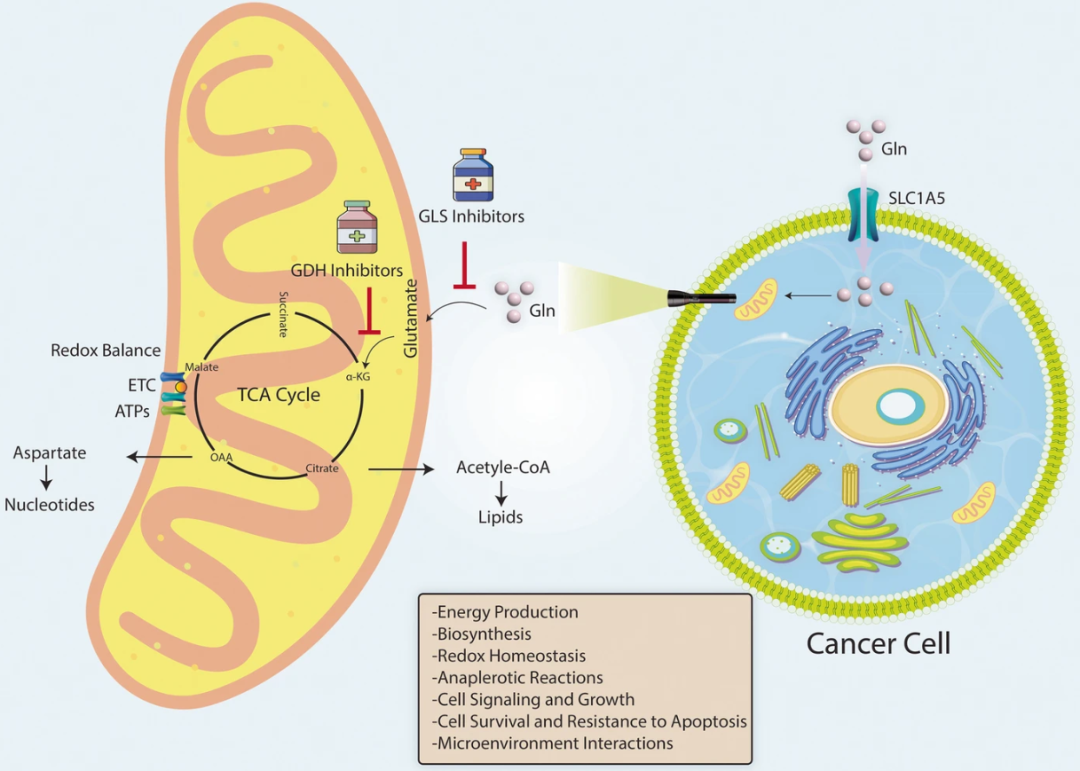
谷氨酰胺水解是癌症的关键能量途径模型图(图源自Molecular Cancer )
认识到代谢改变是癌症的标志,为治疗干预开辟了新的途径。靶向代谢途径提供了破坏肿瘤生长所必需的能量供应和生物合成过程的潜力。一些有前景的治疗策略包括糖酵解抑制剂,靶向糖酵解关键酶,如己糖激酶和乳酸脱氢酶,抑制谷氨酰胺摄取或代谢的谷氨酰胺拮抗剂,靶向脂肪酸合成和氧化途径的脂质代谢抑制剂,以及破坏线粒体功能和氧化磷酸化的线粒体代谢调节剂。临床试验正在探索这些和其他代谢靶点,以开发对正常细胞毒性最小的有效治疗方法。
综述的目的是提供一个详细的和综合的概述目前对癌症代谢改变的理解。它探讨了关键的能量途径,包括糖酵解、氧化磷酸化、谷氨酰胺解和脂质代谢,突出了它们在癌细胞中的作用和调节机制。综述还探讨了癌基因和肿瘤抑制因子、表观遗传修饰和微环境因素对这些途径的调节。此外,它还讨论了癌症代谢的治疗靶点,包括糖酵解抑制剂,氧化磷酸化,谷氨酰胺酶和脂质代谢。最后,它提出了克服代谢可塑性、开发联合疗法和识别代谢靶向生物标志物方面的挑战和未来方向,旨在为开发新的治疗方法提供信息。
参考消息:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02119-3

