【BCJ】王建祥/邱少伟团队通过多组学分析确定t(8;21)AML预后不良的高危亚组
时间:2024-09-28 06:06:14 热度:37.1℃ 作者:网络
t(8;21) AML
t(8;21)(q22;q22)易位是急性髓性白血病(AML)中一种常见的染色体异常,一般预后良好,但约40%的患者最终会复发。即使采用异基因造血干细胞移植,仍有20%的患者复发,且后治疗选择有限。据报道,KIThigh突变,特别是KIT-D816突变及FLT3-ITDhigh改变,会导致t(8;21) AML患者预后不良,但仍存在争议。其他因素,如异常免疫表型、高白细胞(WBC)计数和多参数流式细胞术(MFC)评估的高可测量残留病(MRD)水平也表明预后较差。然而这些无法完全阐明t(8;21) AML的分子学或临床变化。因此,改善目前的风险分层,尽早识别复发风险高的患者,以制定个性化治疗策略至关重要。
为阐明t(8;21) AML的表达谱和分子学特征,中国医学科学院血液病医院(血液学研究所)回顾性分析了该中心42例t(8;21) AML患者的转录组数据和临床特征及其对预后评估和治疗决策的影响,结果近日发表于《Blood Cancer Journal》,共同通讯作者为王建祥教授和邱少伟教授,共同第一作者为博士研究生刘钰、博士后刘文兵和博士研究生赖安丽。

研究结果
该研究纳入2020年9月至2022年10月诊断的42例t(8;21) AML患者,使用非阴性矩阵分解和一致性聚类分析,基于240个基因确定三个不同的转录亚群,命名为C1(38.1%,16/42)、C2(35.7%,15/ 42)和C3(26.2%,11/42)(图1A)。
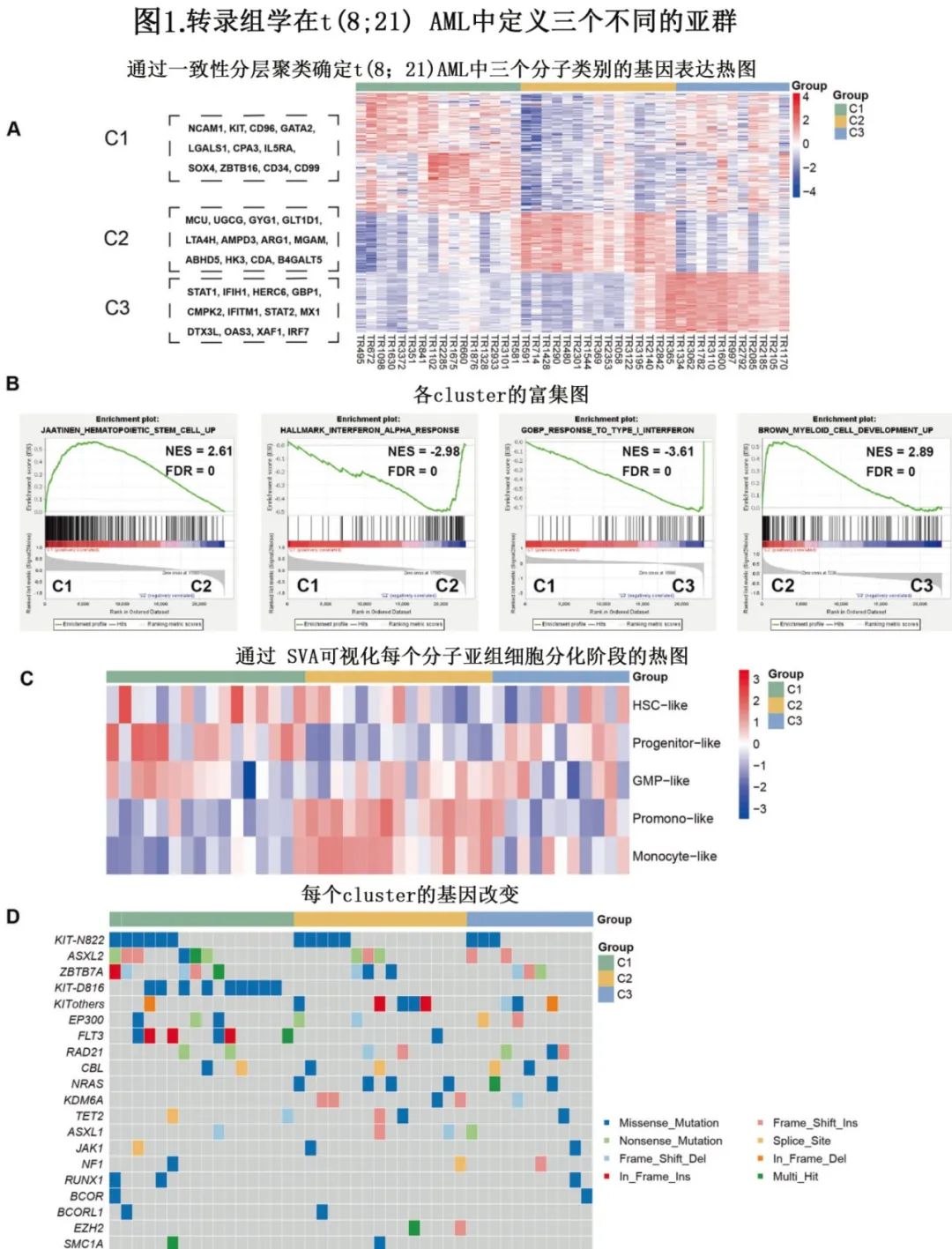
C1的特征为白血病干细胞和祖细胞特征的异常表达;C2和C3均富含干扰素(IFN)信号通路和免疫应答通路,但在髓细胞发育阶段有所不同(图1B)。该结果也在AML分层特征的基因集变异分析(GSVA)中得到验证,其中C1的特征为在造血发育的早期阶段出现阻塞,C2表现出晚期单核细胞样和单核细胞样细胞特性,而C3包含沿HSC样细胞到单核细胞样细胞的恶性细胞类型谱(图1C)。作者从HOVON队列46例t(8;21)AML患者中发现相似的三个clusters,表明该聚类策略的准确性。此外通过靶向测序数据发现,不良预后的KIT-D816突变(p<0.001)和FLT3-ITD (p=0.031)改变在C1样本中显著富集(图1D)。
三个亚组在预后方面具有显著差异。C1 患者的预后不佳,62.5%(10/16) 的患者最终在整个治疗过程中出现复发或保持难治状态,而 C2 中仅35.7%(5/14) 的患者复发或难治,C3中所有患者均达到完全缓解 (CR),并在整个随访过程中保持CR(p=0.006)。
主要分子学缓解 (MMR) 定义为RUNX1:::RUNX1T1转录水平至少降低3个对数,而完全分子学缓解 (CMR) 定义为明显不存在可检测RUNX1::RUNX1T1。该研究显示,诱导治疗后,C1组仅1例 (12.5%,1/8) 患者达到MMR,而 C2 组4例 (33.3%,4/12) 和 C3 组4例 (40%,4/10) 患者达到MMR。此外,化疗期间仅在C2(8.3%,1/12) 和C3(50%,5/10) 患者中观察到 CMR。
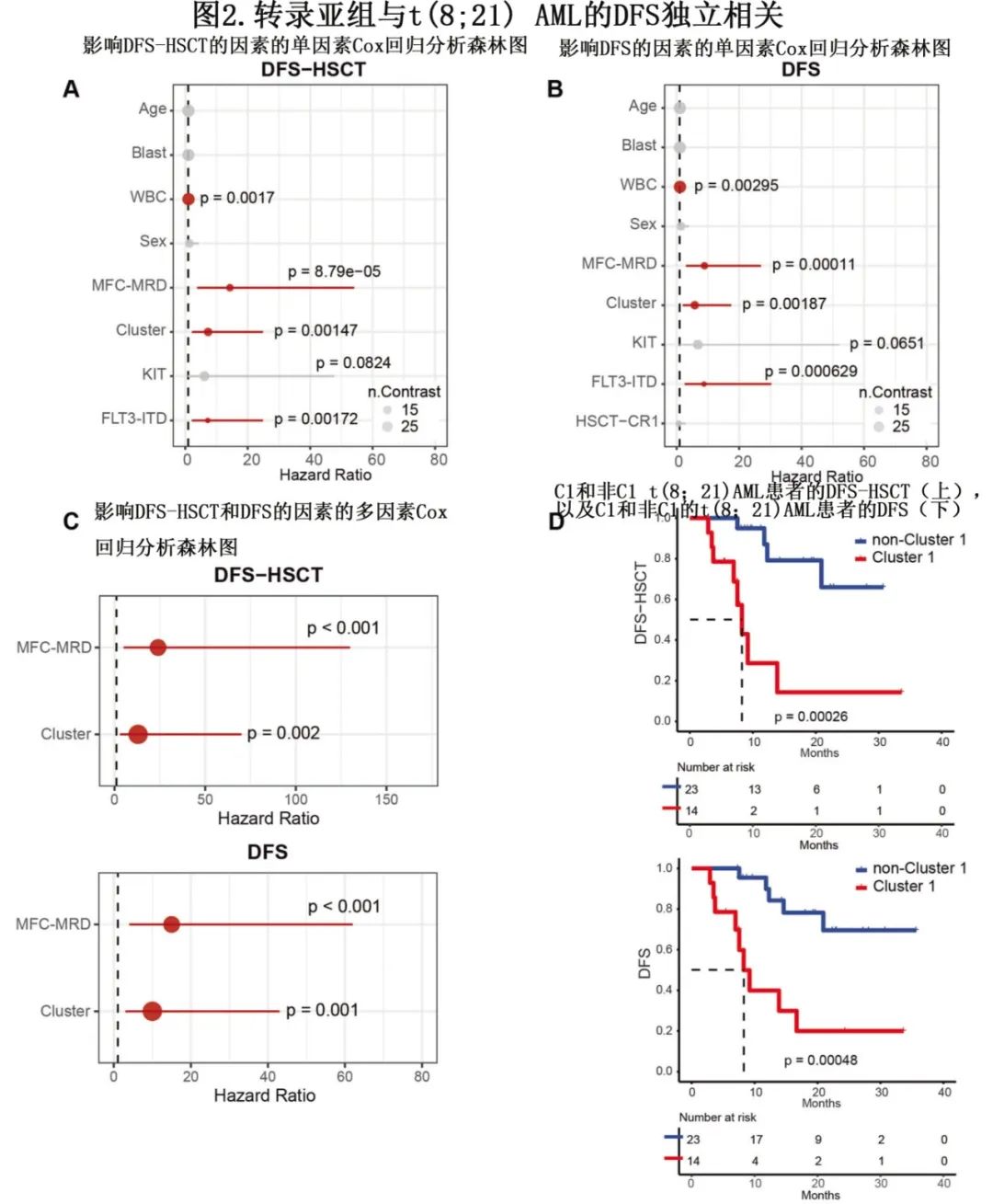
临床结局方面,中位随访21.2个月,根据2017 ELN-2017标准评估无病生存期 (DFS) 和无事件生存期 (EFS)。考虑到 C2 和 C3 的 DFS 均优于C1(分别为p=0.038和p=0.003),以及 C2 和 C3 之间的 DFS 相似 (p=0.054),将 C2 和 C3 患者合并为一组(以下称为非C1组)。
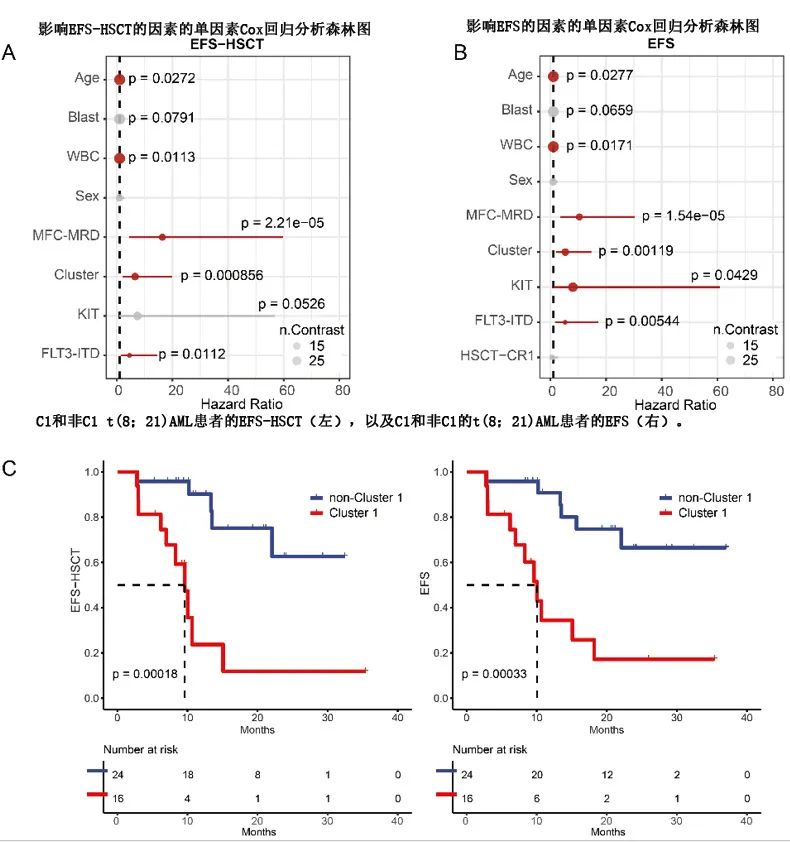
在移植时删失 DFS 和EFS,分别指定为 DFS-HSCT 和 EFS-HSCT。单因素分析表明,WBC计数升高、FLT3-ITD改变、MFC-MRD阳性和 C1 Cluster与 DFS 和 EFS 较差相关(图2A、B);KIT 突变与 EFS 较差相关。在校正了潜在复合变量(包括 WBC 计数、FLT3-ITD改变、MFC-MRD和转录Cluster)的多因素分析中,仅 MFC-MRD 阳性(DFS的HR=15.49,p<0.001;DFS-HSCT的HR=24.21,p<0.001)和C1 Cluster(DFS的HR=10.48,p = 0.001;DFS-HSCT 的HR=13.32,p=0.002)在向后剔除后仍然是 DFS 和 DFS-HSCT 的独立不良预后因素(图2C)。总的来说,t(8;21)AML集群亚型具有临床意义。C1 患者的中位 DFS 和 DFS-HSCT 均为8.26个月,非 C1 组未达到(分别为p<0.001和p<0.001;图2D)。C1 患者的中位 EFS 和 EFS-HSCT 为10.0和9.61个月,而非 C1 组均未达到(分别为p<0.001和p<0.001)。
总结
作者提出了一种基于多组学分析的t(8;21)AML新的分类策略,阐明了在t(8;21)AML中观察到的分子和临床变异,还确定了一个高危亚组 (C1),该亚组预后不良,证实转录亚型是生存的独立预测因子。此外,既往研究报道 KIT-D816 突变可预测t(8;21)AML的不良预后。C1中2例未携带 KIT-D816 突变,但仍出现预后不良 (28.6%,2/7),DFS分别为7.55个月和13.87个月。因此,与目前基于基因组突变的风险分类相比,作者建立的转录组学分析在识别高危组方面更准确。
此外,三个Cluster中不同的转录特征揭示了潜在的分化层级和细胞特征。C1组是最原始的阶段,因此与最差的预后相关,表明可合理应用 BCL-2 抑制剂。有趣的是,IFN相关通路在 C2 和 C3 中富集,且预后相对较好,与之前强调IFN-α治疗在t(8;21)AML中优势的报道一致。该发现或有助于根据新分类确定哪些患者可以从IFN-α治疗中获益。
该研究强调了t(8;21) AML中转录亚型对预后评估和治疗决策的重要性。诊断时的早期风险识别和实施有针对性的治疗策略可能会改善患者的预后。仍需要进一步研究在更大的独立队列中验证基于转录组的风险分层系统,以证实作者的先导研究,并促进相应临床试验的设计,以指导精确靶向化疗和改善治疗结局。
参考文献
Liu, Y., Liu, W., Lai, A. et al. Multiomic analysis identifies a high-risk subgroup that predicts poor prognosis in t(8;21) acute myeloid leukemia. Blood Cancer J. 14, 162 (2024). https://doi.org/10.1038/s41408-024-01144-1


