【衡道丨干货】2024版CSCO子宫内膜癌指南更新,国内外权威共识指南中的子宫内膜癌的病理诊断有何异同?
时间:2024-10-16 15:00:27 热度:37.1℃ 作者:网络
子宫内膜癌病理诊断原则
一、诊断性刮宫/宫腔镜下内膜活检/穿刺活检
所有标本应及时固定(离体30min内固定最佳),使用新鲜的3.7%中性缓冲甲醛固定液,固定液的量应为组织的10倍,固定时间8~48h。
(一)Ⅰ级推荐:
1、大体:
组织样本大小和数目
2、镜下:
明确病变性质和类型;肿瘤/非肿瘤;良性/恶性;组织学类型;组织学分级
子宫内膜癌组织病理:
-
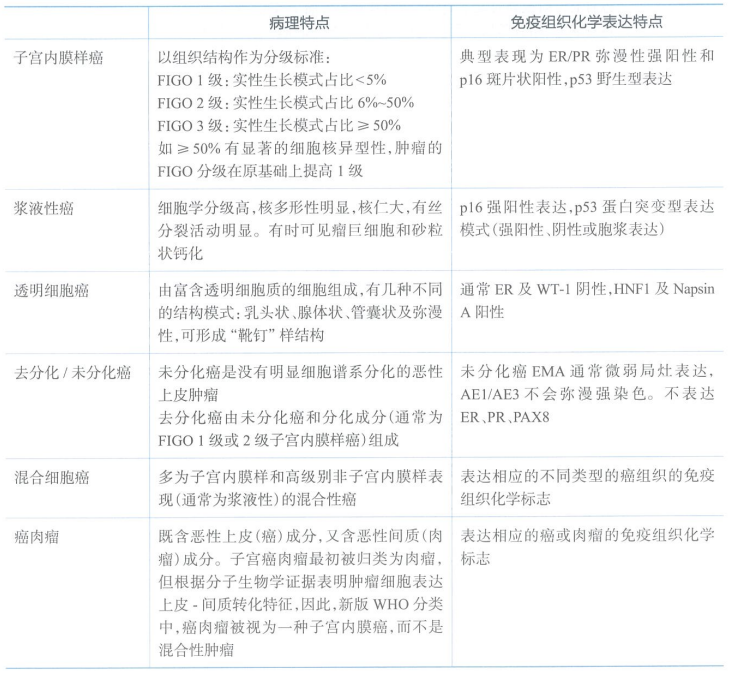
子宫内膜癌的常见病理亚型是子宫内膜样癌,其他亚型如浆液性癌及透明细胞癌、混合型癌、未分化/去分化癌等。
WHO子宫体肿瘤分类(第5版,2020)

-
2020版WHO分类中内膜癌增加了四种“其他类型”:中肾管腺癌、中肾管样腺癌、非特异鳞癌以及胃肠型黏液癌。
-
中肾管腺癌及中肾管样腺癌是通常表现出多种组织学形态,腔内嗜酸性胶体样物质的小腺体和小管占主导地位,免疫组化ER和PR通常阴性表达,p53呈野生型表达,GATA3弥漫表达,CD10呈腔面特征性阳性染色,目前倾向认为具有更高的侵袭性。
-
非特异鳞癌是仅由具有鳞状细胞分化的细胞组成的癌,诊断时需排除低分化内膜样癌。
-
内膜原发性胃(胃肠道)型黏液癌是具有黏液性胃/胃肠道特征的癌,可有特征性杯状细胞的出现。
常见的子宫内膜癌的病理及免疫组织化学表达特点
(二)Ⅱ级推荐:
免疫组织化学/分子标志物:
用于鉴别诊断、分子分型等的免疫组化标志物检测
(三)Ⅲ级推荐:
生物标志物:
用于分子分型的基因检测;Lynch综合征的筛查
二、子宫内膜癌分期/减瘤手术
子宫内膜癌采用手术病理分期,目前常用的是FIGO分期(2023版),见下表
子宫内膜癌的FIGO分期(2023)(手术病理分期)


注释:
a LVSI指淋巴脉管间隙浸润。
b 低级别宫内膜样癌侵犯子宫内膜和卵巢具有较好的预后,但必须与子宫内膜癌转移到卵巢(Ⅲ A2期)区分开来,如果病变满足下列所有条件,则不推荐进行辅助治疗:①无肌层侵犯或肌层侵犯<1/2;②无大量淋巴脉管间隙浸润;③无其他部位转移;④卵巢肿瘤为单侧,并局限于卵巢内,无表面侵犯或破裂。
c 大量脉管瘤栓,指≥5个淋巴脉管浸润。
d 非侵袭性组织类型包括低级别(G₁和G₂)子宫内膜样癌。
e 侵袭性子宫内膜样癌包括高级别子宫内膜样癌(G₃)、浆液性癌、透明细胞癌、未分化癌、混合性癌、中肾管样癌、胃肠型黏液腺癌和癌肉瘤。
(一)Ⅰ级推荐:
1、大体:
肿瘤部位;肿瘤大小;肿瘤切面,有无坏死;双侧附件大小,切面是否正常;淋巴结检出数目、大小和分组
2、镜下:
组织学类型;组织学分级;肌层浸润深度;宫颈间质是否受累;双附件是否受累;其他累及部位;淋巴结转移数和总数;癌结节数目;脉管瘤栓
(二)Ⅱ级推荐:
免疫组织化学/分子标志物:
用于鉴别诊断、分子分型等的免疫组化标志物检测
(三)Ⅲ级推荐:
生物标志物:
用于分子分型的基因检测;Lynch综合征的筛查
-
在条件允许的情况下,鼓励所有子宫内膜癌患者进行分子分型检测(POLEmut、MMRd、NSMP、p53abn),便于预后危险分层,并作为决定辅助治疗和系统性治疗的影响因素。分子分型检测可以用活检组织进行,并可以不用在子宫切除标本中重复。如果进行了分子分型检测,应该在所有分期中记录。
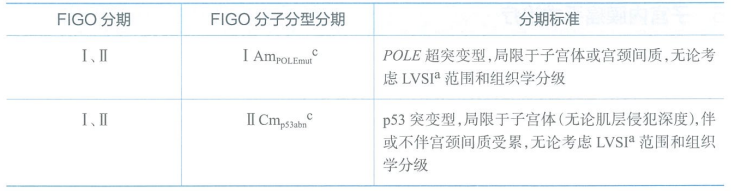
子宫内膜癌结合分子分型结果的FIGO分期
注释:
a LVSI指淋巴脉管间隙浸润。
b 预后良好:POLE超突变型;预后中等:dMMR型和NSMP型;预后差:p53异常型。
c 基于手术组织病理分期为FIGO Ⅰ期和Ⅱ期,如果分子分型检测结果为POLE超突变型或者p53异常型,FIGO分期需要进行修改,在FIGO分期后标记“m”表示分子分型,分别下标POLEmut或p53abn。MMRd型和NSMP型则不会修改FIGO分期,只需要在原FIGO分期后增加标记即可,如ⅠmNSMP和ⅡmMMRd。
d 基于手术组织病理分期为FIGOⅢ期和Ⅳ期,分期并不会由于分子分型结果而改变,只需要在原FIGO分期后增加标记即可,如Ⅲmp53abn和Ⅳmp53abn。
子宫内膜癌相关遗传易感基因筛检和基因诊断原则
一、Lynch综合征筛查
(一)Ⅰ级推荐:
对所有子宫内膜癌患者通过免疫组化(IHC)检测错配修复蛋白(MLH1、PMS2、MSH2、MSH6)表达情况和/或微卫星不稳定性(MSI)检测,进行Lynch综合征初筛。
-
利用MMR蛋白免疫组化和/或微卫星不稳定性(MSI)筛查肿瘤有无DNA错配修复缺陷,用于确定哪些患者应接受Lynch综合征的基因突变检测。
对于初筛发现错配修复缺陷(dMMR)和/或微卫星高度不稳定(MSI-H)的患者,建议有条件的医院按照Lynch综合征基因筛查流程(图1)完成MMR基因(MLH1、PMS2、MSH2和MSH6)和EPCAM基因胚系突变检测。
-
EPCAM基因的3'末端外显子缺失导致MSH2基因启动子高甲基化,从而使MSH2转录功能失活,病理往往表现为肿瘤细胞核MSH2(-)和MSH6(-)。
图1 子宫内膜癌相关Lynch综合征遗传筛查方案
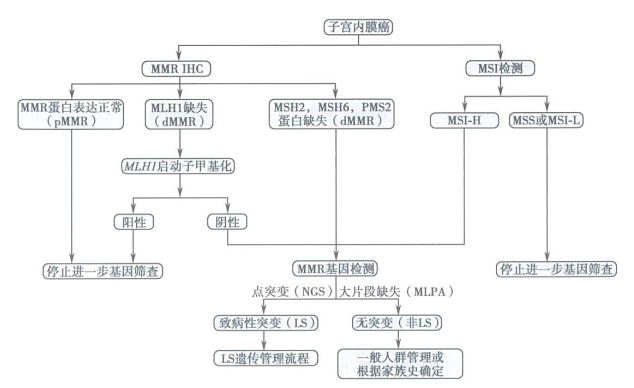
建议MMR基因检测患者的临床和病理特征:
①PMS2(MLH1正常)、MSH2或MSH6蛋白中任一蛋白表达缺失者;
②MLH1蛋白表达缺失,且MLH1基因启动子未见高甲基化者;
③MSI-H;
④临床高度怀疑Lynch综合征时:无论MMR状态如何,患者有同时或异时发生Lynch综合征相关肿瘤个人史,或有子宫内膜癌、结直肠癌或其他Lynch综合征相关肿瘤家族史的患者;
⑤有血缘关系的家族成员确诊为Lynch综合征者
-
MMR基因检测需要筛查点突变和基因大片段重排(大片段缺失和大片段扩增)。
-
BRAF V600E突变常见于MLH1基因启动子甲基化引起的散发性结直肠癌患者;子宫内膜癌患者BRAF基因突变频率极低,且与MLH1基因启动子甲基化不相关,因此在子宫内膜癌中筛查Lynch综合征时无须检测BRAF V600E突变。
-
有部分Lynch综合征患者肿瘤病理表现为功能缺陷性MMR蛋白表达,针对这部分患者需要结合个人史、肿瘤家族史和/或MSI状态推荐MMR基因检测。
-
Lynch综合征相关肿瘤包括结直肠癌、子宫内膜癌、胃癌、卵巢癌、胰腺癌、尿路上皮癌、脑肿瘤(通常是恶性胶质瘤)、胆管癌、小肠肿瘤、皮脂腺瘤。
(二)Ⅱ级推荐:
对于年龄<50岁的子宫内膜癌患者和有明显子宫内膜和/或结直肠癌家族史的患者,应考虑进行基因检测和咨询。
二、Lynch综合征后的管理策略
建议对明确为Lynch综合征的患者进行遗传咨询和遗传管理,须强调进行Lynch综合征相关恶性肿瘤的筛查及随访,同时推荐对与其有血缘关系的亲属尽早进行遗传咨询及基因检测,以便制订相应的遗传管理措施
1.Lynch综合征胚系突变携带者
①MLH1或MSH2突变携带者:20~25岁开始每1~2年行结肠镜检查;
MSH6或PMS2突变携带者:25~30岁开始每1~2年行结肠镜检查;
②从30~35岁开始每1~2年进行胃十二指肠镜检查;
③在确诊Lynch综合征但无子宫内膜癌的女性中,已生育的可考虑子宫和双附件预防性切除术;未行预防性手术者,当无临床症状时,建议每1~2年行子宫内膜活检以排除子宫内膜癌的风险,定期经阴道子宫双附件超声及血清CA125检测等排除卵巢癌风险。
2.对于已明确致病性胚系突变的家系,突变携带者参照以上方案进行随访,非突变携带者可按一般人群筛查。
3.不能明确胚系基因突变的家系,建议根据家族史和临床表现,由医生与患者商议决定复查随访策略。
子宫内膜癌分子分型
一、子宫内膜癌分子分型检测策略
2013年肿瘤基因图谱计划(The Tumor Genome Atlas,TCGA)通过全基因组测序,将子宫内膜癌分为4类分子亚型。此后,不同的组织机构提出了不同的分组命名方案,本指南采用TCGA的命名方案:POLE超突变型(POLE ultramutated)、高度微卫星不稳定型(microsatellite instability high,MSI-H)、低拷贝型(copy-number low)、高拷贝型(copy-number high)。
(一)Ⅰ级推荐:无
(二)Ⅱ级推荐:
对确诊子宫内膜癌患者的肿瘤样本进行分子分型,可使用手术切除标本、活检标本或刮宫标本。
二、分子分型检测方案
(一)Ⅰ级推荐:无
(二)Ⅱ级推荐:
检测POLE基因突变、MMR(错配修复)状态、p53蛋白表达或TP53基因突变状态。结果判断需要遵循一定顺序。
-
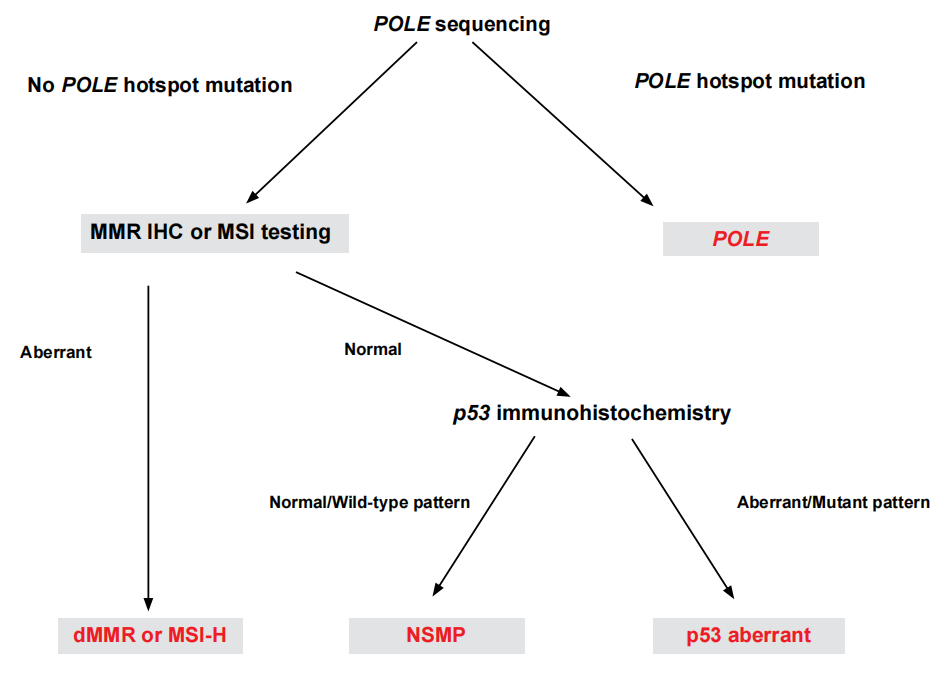
3%~6%的子宫内膜癌存在多种分子分型特征,称为多重分子亚型(multiple classifier)。一些文献表明同时有POLE致病突变及dMMR(错配修复缺陷)的子宫内膜癌应归为POLE超突变型,同时有dMMR以及p53状态异常的肿瘤应归为高度微卫星不稳定型。因此,分子分型的判读需要遵循一定判读顺序(图2)
图2 子宫内膜癌分子分型判读流程
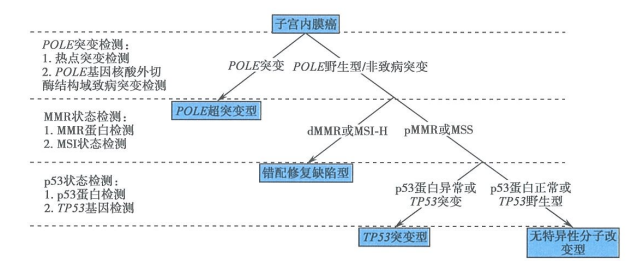
子宫内膜癌分子分型判读流程:
①首先判断POLE基因是否存在致病突变,具有致病性POLE突变时,则为POLE超突变型;
②当确定POLE基因不存在致病突变时,判断MMR/MSI状态,若表现为dMMR或MSI-H状态,则为错配修复缺陷型;
③当MMR/MSI状态表现为pMMR或MSS时,判断p53状态,若表现为p53蛋白表达异常或TP53基因突变时,则为TP53突变型;若p53蛋白表达正常或TP53基因为野生型,则为无特异性分子改变型。
三、POLE基因突变检测
(一)Ⅰ级推荐:无
(二)Ⅱ级推荐:
检测POLE核酸外切酶结构域热点突变。
-
POLE基因常见且已确认致病能力的热点突变包括P286R、V411L、S297F、A456P和S459F。
(三)Ⅲ级推荐:
检测POLE核酸外切酶结构域致病突变,覆盖POLE基因9~14号外显子区域。
四、MMR状态检测
(一)Ⅰ级推荐:无
(二)Ⅱ级推荐:
免疫组织化学法检测MMR蛋白,包括MLH1、MSH2、MSH6和PMS2;检测MSI状态
-
MMR状态的判读是根据MLH1、MSH2、MSH6和PMS2蛋白的免疫组织化学表达决定,4个蛋白的细胞核均表达完整或正常时为pMMR(错配修复功能完整),一个或多个蛋白表达缺失或异常为dMMR。
-
PCR+毛细管电泳法是MSI状态检测的金标准,也可采用二代测序检测,但因为缺乏统一标准,所以有条件的单位可考虑经过验证的二代测序MSI检测。MSI状态检测结果分为MSI-H(微卫星高度不稳定)、MSI-L(微卫星低度不稳定)及MSS(微卫星稳定),MSI-L和MSS均认定为MSS。MSI状态及MMR蛋白检测结果高度一致,但在少数子宫内膜癌病例中肿瘤组织具有异质性,可能会导致MMR蛋白检测与MSI状态检测结果不一致,MMR蛋白免疫组织化学检测可以更直观地观察到异质性。
五、p53状态检测
(一)Ⅰ级推荐:无
(二)Ⅱ级推荐:
免疫组织化学法检测p53蛋白表达
(三)Ⅲ级推荐:
检测TP53基因突变状态
-
p53蛋白免疫组织化学表达呈完全阴性、细胞核弥漫强阳性或细胞质表达时,为p53蛋白表达异常。p53蛋白表达呈现细胞核散在阳性时,为p53蛋白表达正常。TP53基因突变检测建议覆盖TP53基因所有外显子区及邻近剪切位点。
与NCCN指南比较
一、病理学评估原则(包括癌、癌肉瘤和神经内分泌癌)
(一)子宫
-
子宫切除术类型
-
标本完整性(完整、切开、碎瘤术后或其他)
-
肿瘤位置(宫腔内膜、子宫下段、息肉)
-
肿瘤大小
-
组织学类型
-
组织分化程度(如适用)
-
肌层浸润(浸润深度/肌层全层厚度,以mm为单位)
-
子宫颈间质受累
-
淋巴脉管间隙浸润
(二)其他受累组织/器官
1.输卵管、卵巢、阴道、宫旁、腹膜、网膜,其他
2.腹膜/腹水细胞学检查
3.淋巴结(如切除)
-
前哨淋巴结需进行超分期以检测较小肿瘤转移灶;
-
孤立肿瘤细胞分期为N0(i+),虽不会提高分期,但影响辅助治疗决策;
-
淋巴结转移的水平(如盆腔,髂总及腹主动脉旁);
-
孤立肿瘤细胞转移、微转移及肉眼转移的淋巴结数目;
-
术者或术中寻求病理咨询完成前哨淋巴结组织标本的肉眼评价,以保证标本中包含淋巴结组织。
4.对Ⅲ期、Ⅳ期和复发患者的组织标本进行雌激素和孕激素受体检测。
5.推荐对所有浆液性内膜癌和癌肉瘤患者进行HER2的免疫组织化学检测(HER2的荧光原位杂交技术检测方法也等同于免疫组织化学检测)。
6.无论组织学分型结果如何,可考虑在p53突变型内膜癌患者中进行HER2免疫组织化学检测。
7.由于诊断的可重复性存在争议,在子宫内膜癌,尤其是高级别肿瘤中进行肿瘤细胞的形态学评价以判断组织学类型这一方法尚未成熟。
二、分子分型分析及推荐流程
根据临床预后将子宫内膜癌分为4种分子亚型,包括POLE突变型,错配修复缺陷(MMRd)/微卫星高度不稳定型(MSI-H),无特殊分子特征(NSMP)及p53突变型。可考虑在子宫肿瘤初始评估时采用经过临床实验室改进修正案(CLIA)认证的实验室进行验证的和(或)经美国食品药品监督管理局(FDA)批准的检测方法进行全面的基因组分型。额外进行POLE突变(核酸外切酶结构域的热点突变)、错配修复蛋白的免疫组化检测或微卫星稳定的基因检测及p53表达的免疫组化检测有助于完善对子宫内膜癌肿瘤组织分型的大体病理学检查评估。强烈推荐POLE突变型,MSI-H型或高拷贝型患者入组临床研究。推荐对子宫内膜癌广泛进行MMR蛋白及MSI检测。应进一步评估启动子甲基化对MLH1缺失的影响,以评估表观遗传过程。建议进行遗传咨询、分子分析和所有其他MMR异常检测。对于MMR完整/MSI稳定或尚未进行基因筛查,但有明显子宫内膜癌和(或)结直肠癌家族史的患者,应进行遗传咨询和检测。对于转移或复发子宫内膜癌患者,可考虑行NTRK基因融合检测。可考虑采用经CLIA认证的实验室所验证的和(或)FDA批准的分析方法检测肿瘤突变负荷(TMB)。
子宫内膜癌分子分型判读流程
参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)子宫内膜癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Uterine Neoplasms. Version 2.2024


