Nature Medicine:常规全基因组测序(WGS):为疑似肿瘤儿童带来福音
时间:2024-10-23 19:00:45 热度:37.1℃ 作者:网络
随着DNA测序和分析技术变得更加便捷且成本降低,这些技术逐渐被纳入常规肿瘤学实践。目前临床医生可以使用多种检测手段,而全基因组测序(Whole-Genome Sequencing, WGS)因为能够解析整个(可获取的)基因组中的各种变异类型,被认为是提供信息最全面的单一检测方法。
儿童肿瘤的治疗通常依赖于特定的基因特征,因此,WGS在儿童肿瘤学中的应用特别具有价值。此外,由于部分儿童肿瘤的基因基础尚未被充分探索,WGS也有更大几率发现具有临床价值的基因变异。即便在已有的标准护理(SOC)检测中使用了扩展的分子分析方法(如靶向DNA和RNA测序面板),WGS仍然能提供额外的关键信息。
尽管全基因组测序(WGS)在临床中的应用日益普及,但目前仍缺乏充分的证据支持其在儿童肿瘤学实践中的常规使用。已有的研究多集中于特定患者群体,例如高风险疾病的儿童。然而,这些研究主要探索了WGS的潜在益处,而其在实时临床护理中的实际影响尚未被充分评估。目前,尚不清楚将WGS整合到常规临床实践中,是否能为所有疑似肿瘤的儿童提供超出标准护理(SOC)分子检测的临床价值。
2024年5月,由 Sam Behjati 团队发表于 Nature Medicine 题为 Benefits for children with suspected cancer from routine whole-genome sequencing的文章, 通过比观察性研究,揭示了WGS作为常规检测手段,不仅为检测整合提供了机会,还可以为实施基因指导的精准治疗创造了条件。

在本研究, Sam团队从英国两个三级儿童肿瘤中心(剑桥大学医院 CUH 和伦敦大奥蒙德街医院 GOSH)分别招募 130和152名儿童,分别覆盖了90% 和93%的患者。前者是实体瘤中心,后者是血液病中心。这些患者覆盖了75种肿瘤类型,在总体上可以代表英国儿童肿瘤学和血液学的常见疾病。 不过骨肿瘤、低级别脑肿瘤患者以及12岁以上青少年血液肿瘤患者的代表性不足。详细分组可见图一。
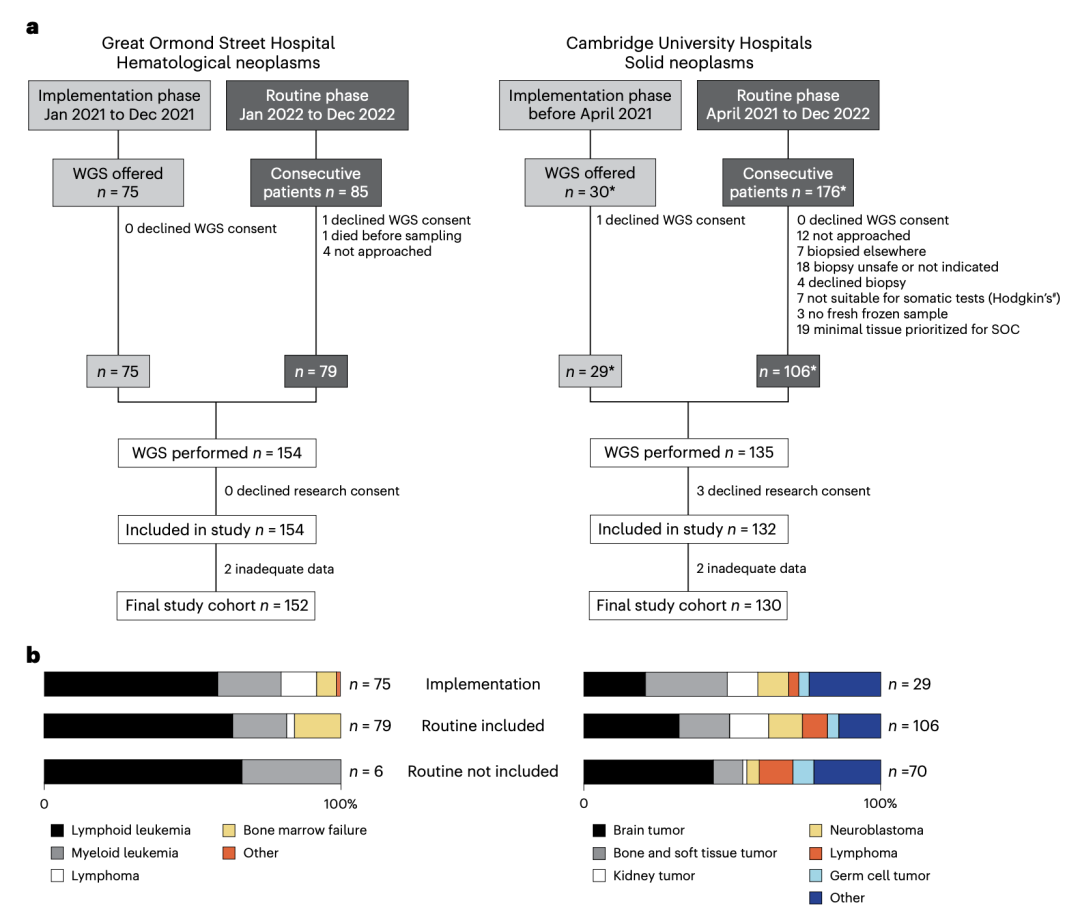
每个中心的研究分为两个阶段:
1) 实施阶段(Implementation phase)
在该阶段,患者非连续性地被纳入研究,由主治医生根据实际情况选择。选择标准主要基于样本采集与存储的可行性,因为这处于服务早期的建立阶段。
2) 常规检测阶段(Routine testing phase)
该阶段旨在向每位患者提供WGS检测,不再限于挑选特定患者,以便将WGS作为常规检测手段全面融入临床实践
研究结果可以从四个方面总结:1) WGS与标准护理(SOC)对比 2) 临床益处总结 3) 患者医疗管理变更中的独特WGS发现 4)儿童肿瘤基因组的新发现
-
在WGS与标准护理(SOC)对比中, WGS不仅完全再现了这些SOC检测的结果(包括未发现相关疾病特征的情况),还在108个实例(83个病例,占29%)中揭示了额外的诊断、风险评估、治疗和胚系特征。其中,80个发现直接带来了临床益处,如诊断改进或治疗机会。
-
这80个新发现带来的临床益处在69例患者(282例中的24%)涵盖了以下三个方面:
辅助诊断(n=40, 14%):WGS通过加速预期的检测结果或提供额外的诊断信息,帮助确认诊断。
-
加速诊断(n=24):
-
提供了骨髓衰竭、预期癌症易感性、新发癌症易感性排除等方面的快速诊断。
-
具体包括14例骨髓衰竭、7例癌症易感性确诊、1例癌症易感性排除和2例风险变异鉴定。
-
其他新诊断信息(n=16):
-
包括诊断明确化(8例)、识别新实体(3例)、SOC分子检测差异澄清(2例)、风险分类澄清(2例)、以及检测最小残留疾病的标准化(1例)。
提供治疗机会(n=20, 7%):WGS发现了一些可通过现有药物靶向的变异,为患者提供了新的治疗方案。
-
包括检查点抑制剂(4例)、RAS通路抑制剂(8例)、以及其他靶向治疗(8例)
改变患者管理(n=20, 7%):WGS的独特发现直接改变了患者的治疗管理。
-
诊断明确化(n=2):在两个病例中诊断得到澄清。
-
风险澄清(n=5):包括3例在血液学队列中通过WGS明确风险分类。
-
易感性检测及二级筛查(n=11):这些病例中进行了家族遗传性疾病的扩展筛查或二级癌症筛查。
-
易感性指导的治疗(n=2):两例患者根据遗传易感性信息实施了个性化治疗。
-
通过详细和审慎的案例审查,本研究共识别了20例WGS发现导致管理变更的案例。举例说明; 在一名胸部神经母细胞瘤患儿中,WGS发现了与乳腺癌易感性相关的PALB2框移突变。这一发现导致治疗方案的调整,即放射治疗的照射范围被修改,以避免乳房发育区受到辐射。尽管该患儿之前也接受了SOC检测(包括核型分析、拷贝数阵列及神经母细胞瘤易感基因的直接测序),但PALB2基因未被纳入检测范围,因为该基因通常不在神经母细胞瘤的易感性筛查中。因此,这一WGS发现属于SOC检测无法发现、且未被预期检测的变异,直接导致治疗调整。在所有的这些发现中,胚系变异在调整患者管理方面尤为突出。 这些案例表明,WGS能够发现SOC检测无法识别的重要变异,为临床决策提供了关键的基因信息,从而优化治疗方案并避免不必要的强化治疗。
-
在本研究的6例病例中,全基因组测序(WGS)揭示了此前未知的基因特征,这些特征可能成为未来研究的方向(见表4)。这些新发现包括独特的分子肿瘤实体、疾病定义性突变以及已知致癌突变的变异形式。在一例婴儿高级别脑肿瘤中,检测到了ATNX1–NUTM2D基因融合,这是首次在儿童中发现的此类融合。该肿瘤无法通过组织学或SOC分子检测(包括甲基化分析阵列)进行分类,并且其特征在数万个参考数据点中独一无二。这些发现推动了新的研究假设,并为某些难以分类的肿瘤提供了明确的诊断信息,展现了WGS在儿童肿瘤基因组研究中的重要价值。
总而言之, 本研究表明,全基因组测序(WGS)在儿童肿瘤诊疗中具有显著优势。WGS能够发现标准护理(SOC)检测无法识别的重要变异,提升诊断精度,加速治疗决策,并支持个性化治疗,如发现胚系易感性变异促成长期筛查和治疗优化。此外,WGS通过整合多项检测,减少了对组织样本的需求,这在儿童肿瘤中尤为关键。同时,随着WGS数据的积累,基因型–表型关联数据库可以被创建,为未来研究提供宝贵资源。
本研究也揭示了一些改进空间:目前RNA测序仅限于基因融合检测,缺乏基因表达分析,影响了WGS的全面应用;报告时间在某些情况下无法及时满足临床需求,需要针对不同疾病类型进行优化。此外,WGS的效用依赖于各单位的本地解读能力,解读水平的不均衡可能影响结果的应用价值。尽管WGS整合检测具有降低成本的潜力,但还需进一步的经济分析来评估其在不同医疗环境中的可行性。随着系统优化和成本降低,WGS有望成为儿童肿瘤学中的核心工具,推动更高效、更精准的临床护理和研究。


