第十五届上海市医学会肠外肠内营养学学术年会 | 钱甜教授:再喂养综合征(RFS)营养防治策略
时间:2024-10-30 16:02:40 热度:37.1℃ 作者:网络
2024年10月26日,由上海市医学会、上海市医学会肠外肠内营养学专科分会主办,上海交通大学医学院附属第九人民医院承办的“第十五届上海市医学会肠外肠内营养学学术年会“隆重召开。本届大会聚焦临床营养领域的诊治规范和前沿问题,主要内容包括肠外与肠内营养的规范应用及热点、焦点问题讨论,会议邀请著名专家进行专题报告。
大会期间,来自复旦大学附属儿科医院临床营养科的钱甜教授分享了“再喂养综合征(RFS)营养防治策略”精彩内容,本文梳理重点内容,以分享各位同道。

01 RFS背景和定义
RFS的历史可以追溯到第二次世界大战期间,当时人们注意到战俘、集中营幸存者以及饥荒受害者的营养补充过程中出现了严重的代谢紊乱。这些个体在经历了长时间的营养不良后,突然增加营养摄入会导致一系列复杂的生化反应,进而引发严重的健康问题。1950年代,《人类饥饿生物学》(Biology of Human Starvation)的研究报告进一步阐明了这一现象。该研究报告出自明尼苏达大学的一系列实验,详细记录了长期饥饿对人体的影响及其后续的营养恢复过程。
RFS定义为在经历了一段时间的热量摄入减少或停止(无论是通过口服、肠内还是肠外途径)之后,重新摄入营养物质时可能会引发的一系列代谢异常。这些异常包括但不限于低磷血症、低钾血症、低镁血症以及维生素缺乏和体液平衡紊乱。在极端情况下,RFS可能导致严重的器官功能衰竭,甚至是致命的结果。尽管RFS的确切发病率尚不明确,但据现有文献报道,其发生率大约在2%到8%之间,而与此相关的病死率为0.71%。
RFS通常发生在营养不良的个体开始接受营养支持后,其常见的病因有神经性厌食,危重症,PICU,恶性肿瘤,透析,消化道吸收不良,长期不规律进食导致饥饿,减重手术以后等。此外,军人和运动员虽然相对少见,但在极端条件下,如高强度训练或长时间饥饿后迅速补充能量,也可能引发RFS。
02 RFS发病机制
RFS的发病机制主要涉及代谢的快速转变,尤其是从分解代谢状态转变为合成代谢状态时所引起的电解质失衡和其他代谢紊乱。
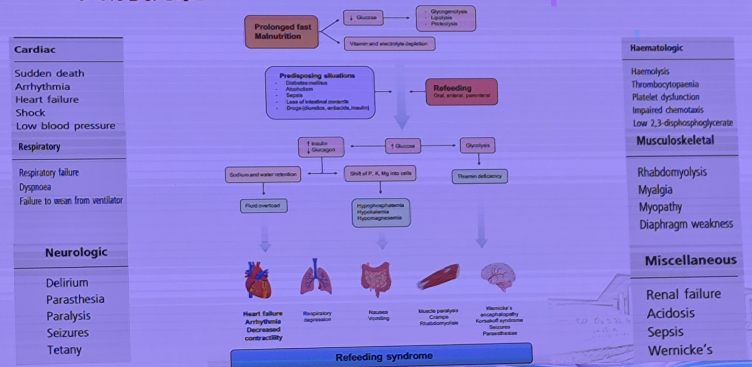
03 RFS高危人群
神经性厌食(AN):持续性的能量摄取限制、强烈害怕体质量增加或变胖或持续性妨碍体质量增加的行为、对自我的体质量或体形产生感知紊乱为临床特征的一类进食障碍。据数据显示,AN终生患病率为 0.6%,常见于青少年女性和年轻女性,男女比例约为1:11,且发病年龄早,为 13~20 岁,中位数为 16 岁,发病的两个高峰年龄分别是 13~14岁和 17~18岁。AN 的死亡率高达 5%~15%,在所有精神障碍中死亡率最高。2022 年美 国《精神疾病诊断与统计手册》第5版修订版(DSM-5-TR)和 2023 年《国际疾病分类》第 11 版(ICD-11)中均对 AN 的诊断标准修订。
肿瘤:化疗或放疗引起的口腔炎和食欲下降经常限制患者的进食和饮水能力。化疗引起的呕吐、脑转移、放疗或恶性肠梗阻可能导致磷酸盐、镁和钾的耗竭。引起的电解质耗竭的药物为利尿剂。发热会增加TNF和IL-2等耗尽磷酸盐的细胞因子。
ICU患者:在重症监护病房中,患者常常经历所谓的“早期分解代谢反应”(Early Catabolic Response to Critical Illness and Trauma),这是机体对严重疾病或创伤的一种急性生理反应。这种反应是为了应对急性生理压力,但它也可能导致代谢紊乱和其他并发症。
低磷血症:成人低磷血症血清磷低于0.8 mmol/L(2.5 mg/dL)的一种病理生理状态,细胞外液可被测量的游离血清磷仅有 1%。轻度低磷:血清磷:0.65~0.8mmolL(2~2.5 mg/dL),中度低磷:血清磷:0.32~0.65 mmolL(1~2 mg/dL),重度低磷:血清磷:<0.32 mmol/L(<1 mg/dL)。
04 RFS分级和营养评估
RFS的评估和分级对预防和管理至关重要。RFS的诊断和管理需要基于临床评估和实验室参数来进行,以识别高风险患者并实施适当的预防措施。一项单中心、观察性、回顾性队列研究对478名NCU成年重症惠者进行研究,结果显示,SNAQ、GLIM、mNICE和ASPEN在识别高风险神经重症患者方面表现不佳。
基于现有的临床经验和指南,可以将RFS的风险分为不同的等级:低风险、中风险和高风险。
低风险:
营养状态良好:没有明显的营养不良迹象。
近期摄入正常:过去几周内饮食摄入基本正常,无显著的体重下降。
电解质水平正常:血清磷、钾、镁等电解质水平均在正常范围内。
中风险:
轻度至中度营养不良:体重下降不超过15%,存在轻度至中度的蛋白质能量营养不良。
近期摄入减少:过去几周内摄入量有所减少,但未达到严重程度。
电解质轻度异常:血清磷、钾、镁等电解质水平略有波动,但仍接近正常范围。
高风险:
重度营养不良:体重下降超过15%,存在显著的蛋白质能量营养不良。
近期摄入显著减少:近期内摄入量大幅下降,可能伴有体重急剧下降。
电解质显著异常:血清磷、钾、镁等电解质水平明显低于正常范围,尤其是血磷水平低于1.3 mg/dL(0.42 mmol/L)。


05 RFS营养防治和随访
为有效预防和管理RFS,首先需要进行全面的风险评估。这包括详细的病史调查、体格检查以及实验室检测,特别是电解质(如磷、钾、镁)和维生素水平的监测。使用标准化的营养筛查工具(如NRS 2002、MUST、PG-SGA等)有助于识别高风险患者。此外,渐进式的营养支持策略至关重要,即从低热量摄入开始,逐步增加至目标热量,确保营养素平衡,重点补充硫胺素等关键维生素。

在具体实施营养支持时,应制定个性化的治疗计划,根据患者的具体情况调整营养成分、摄入量和给药方式。电解质和维生素的补充是预防RFS的关键措施之一,特别是在营养支持的初期,应每日监测电解质水平,并及时调整补充方案。此外,临床症状的观察也不容忽视,如心律失常、肌肉无力等,这些可能是RFS的早期迹象。通过多学科团队的合作,包括营养师、医生和护士的共同努力,可以确保患者获得全面的护理和支持。

为了确保患者在营养支持过程中的安全性和有效性,短期随访至关重要。在开始营养支持后的前三天内,每日监测电解质水平,并观察临床症状。随后的第一周内,至少每隔一天进行一次监测,并根据需要调整营养支持计划。在第一个月内,每周至少进行一次全面的营养评估。对于需要长期营养支持的患者,建议每月进行一次全面评估,直至营养状态稳定。对于存在慢性疾病或长期营养不良风险的患者,则应进行季度或半年度的复查,以确保持续的营养管理,预防RFS的发生。通过持续的随访和监测,可以及时调整治疗方案,确保患者长期健康。


