【衡道丨病例】Kimura病(木村病)如何诊断?
时间:2024-10-31 14:00:44 热度:37.1℃ 作者:网络
患者病史
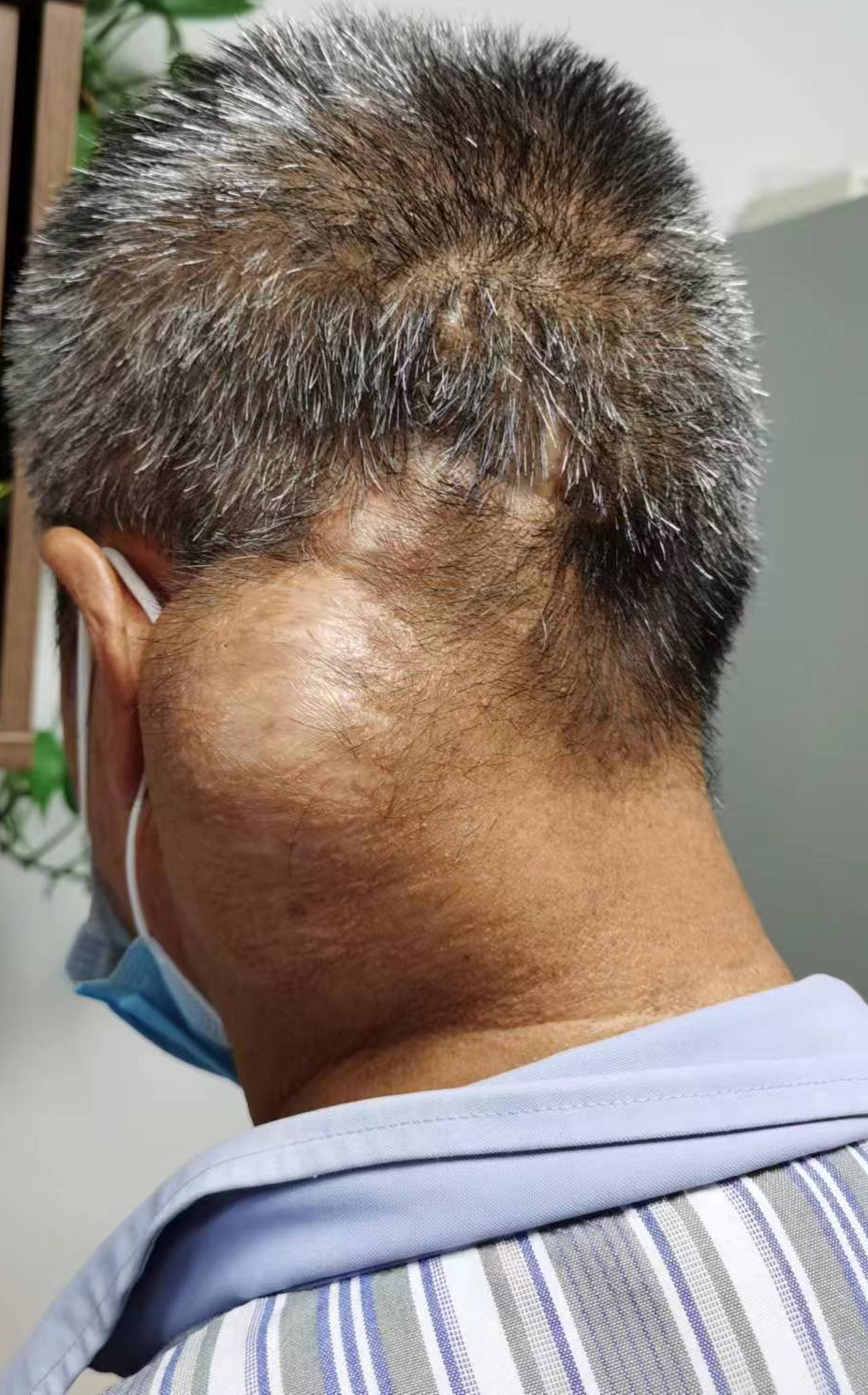
患者男性,57岁,7年前发现左侧颞顶部肿物,未重视。
6年前肿物有所增大,遂至外院予手术切除(具体不详)。
4年前肿物长大,再次手术切除,当地病理示:血管纤维瘤。
1年前左侧顶颞枕部、右侧颞部、双侧颈部皮下再发结节,(左侧巨大) 外院头颅MRI增强:考虑神经纤维瘤病可能。
1年前外院行左侧较小肿物之一切除术,术后病理提示:
(左头顶)慢性炎性纤维硬化性病变,鉴于IgG4 阳性细胞>50 个/HPF,IgG4/IgG 比例>50%,考虑为IgG4 相关的硬化性疾病。
现为明确病因来我院会诊。
影像检查

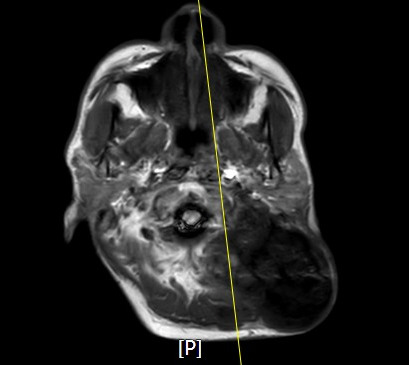
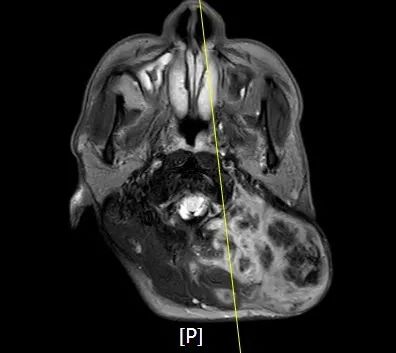
镜下形态
下面我们来看一下这个病例的HE切片
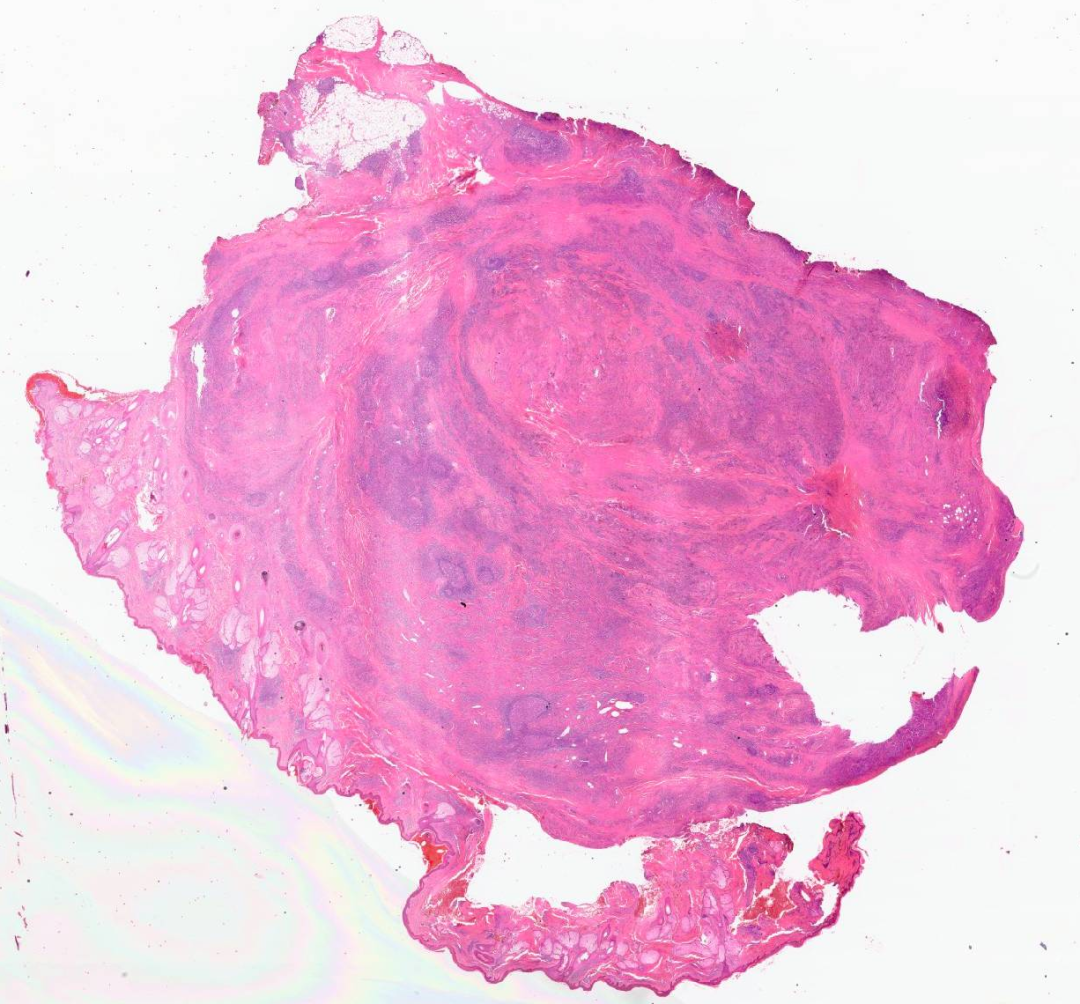
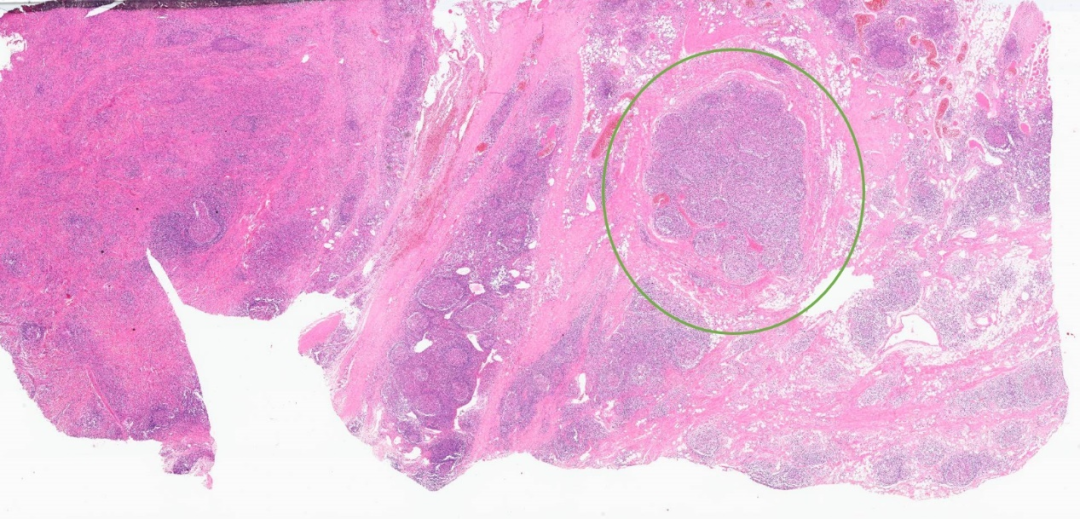
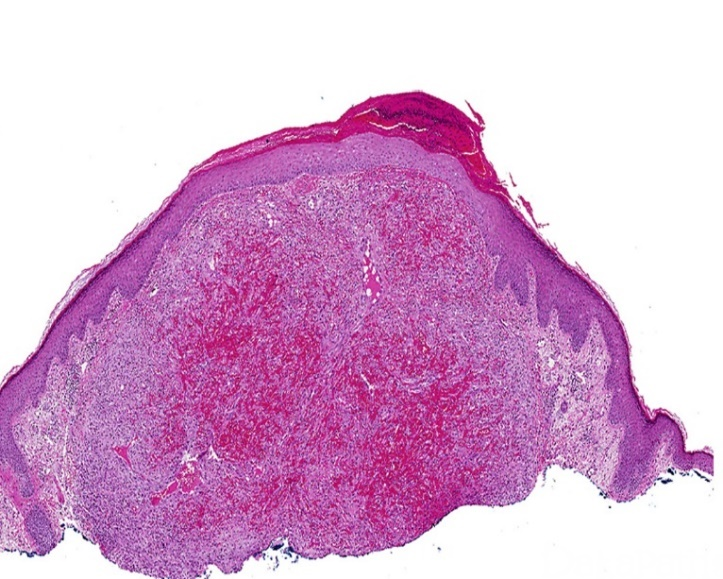
圆形的皮下肿物
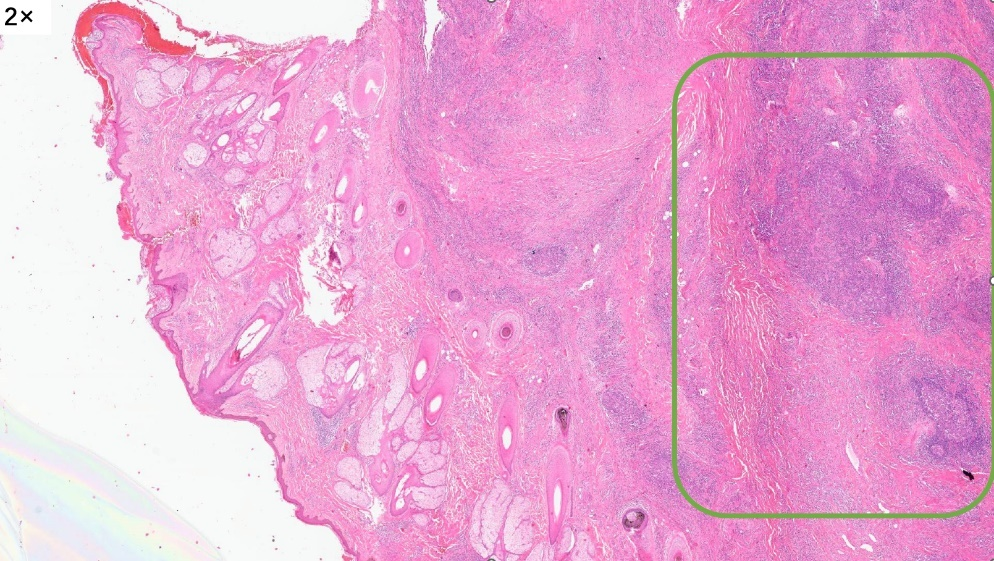
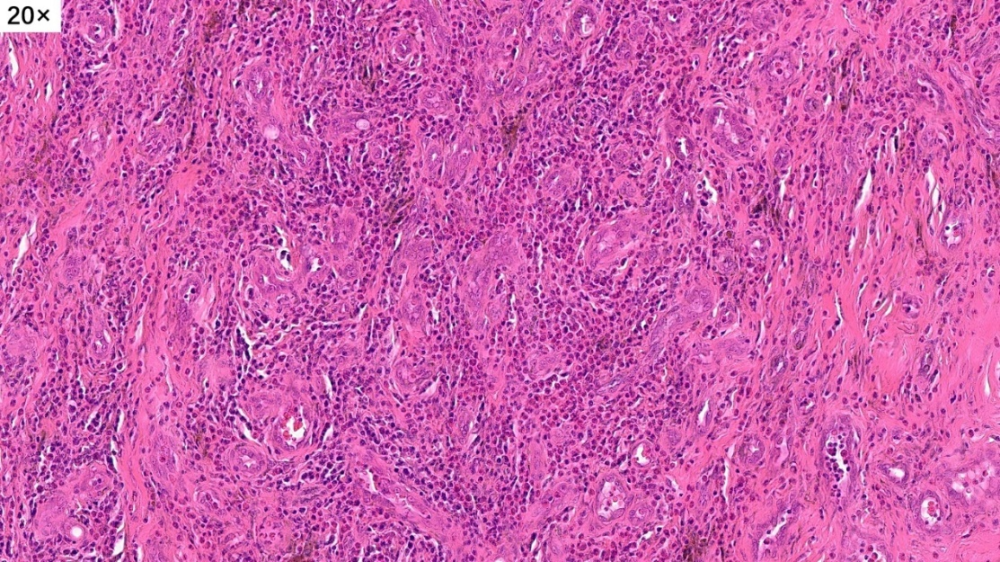
取材部位位于头皮,皮脂腺及毛囊较丰富,表皮层和真皮浅层没有看到明显病变,病变主要位于真皮层的深层
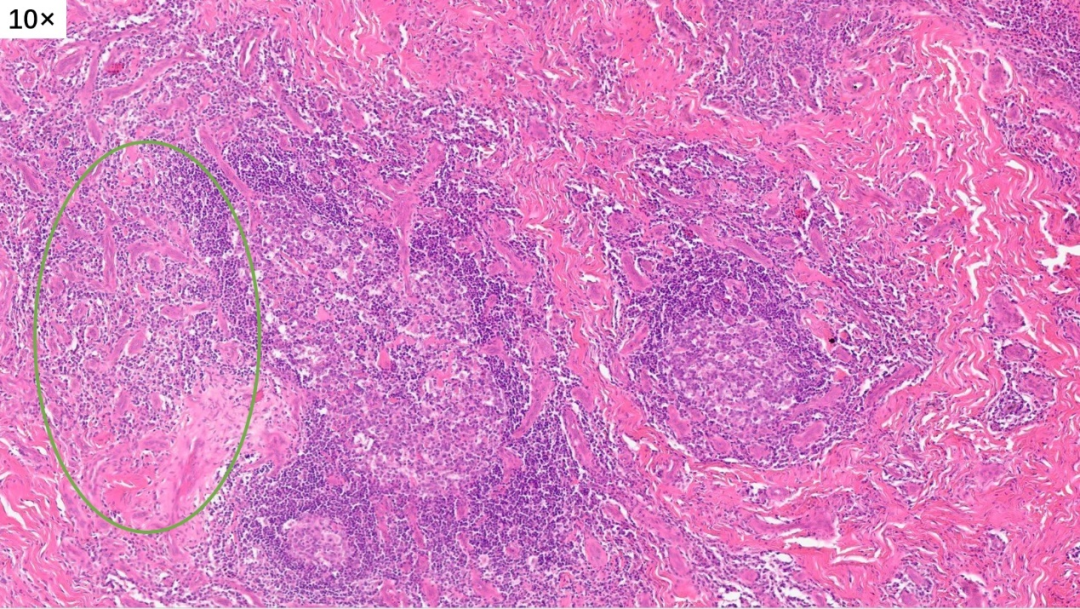
淋巴滤泡形成,间质有胶原化,局部有很多小血管增生
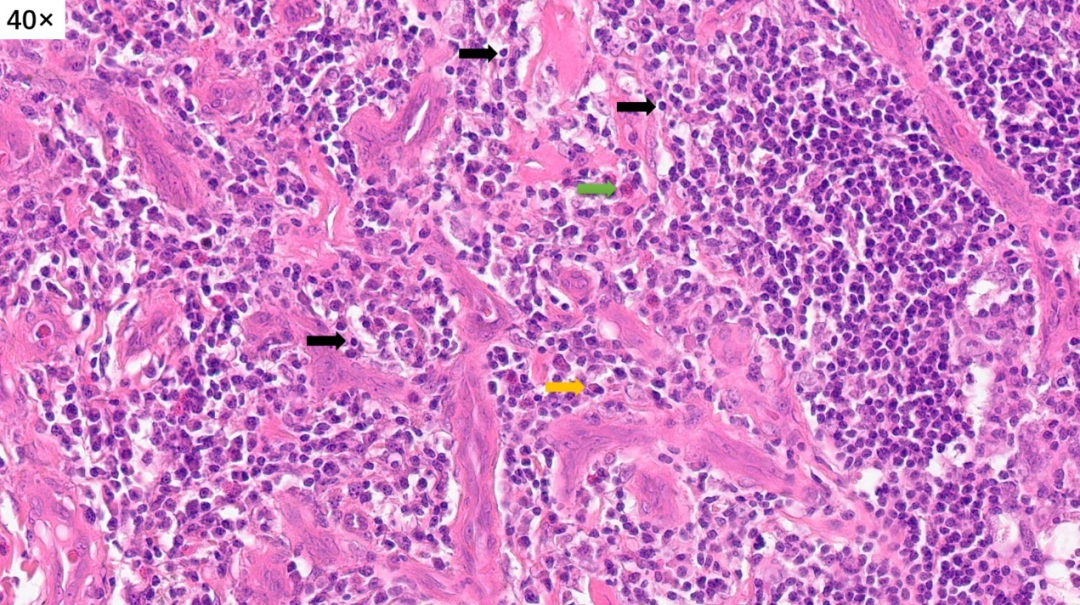
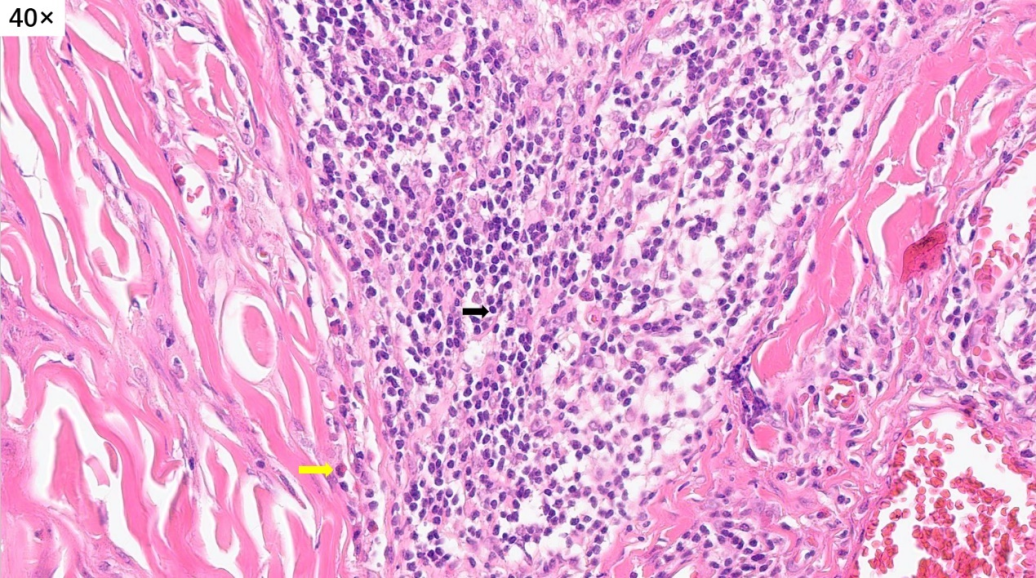
高倍镜下,可以看到很多的淋巴细胞,嗜酸性粒细胞和浆细胞,间质内可以看到大量增生高内皮小静脉。这些小淋巴细胞,核小,深染,没有异型性
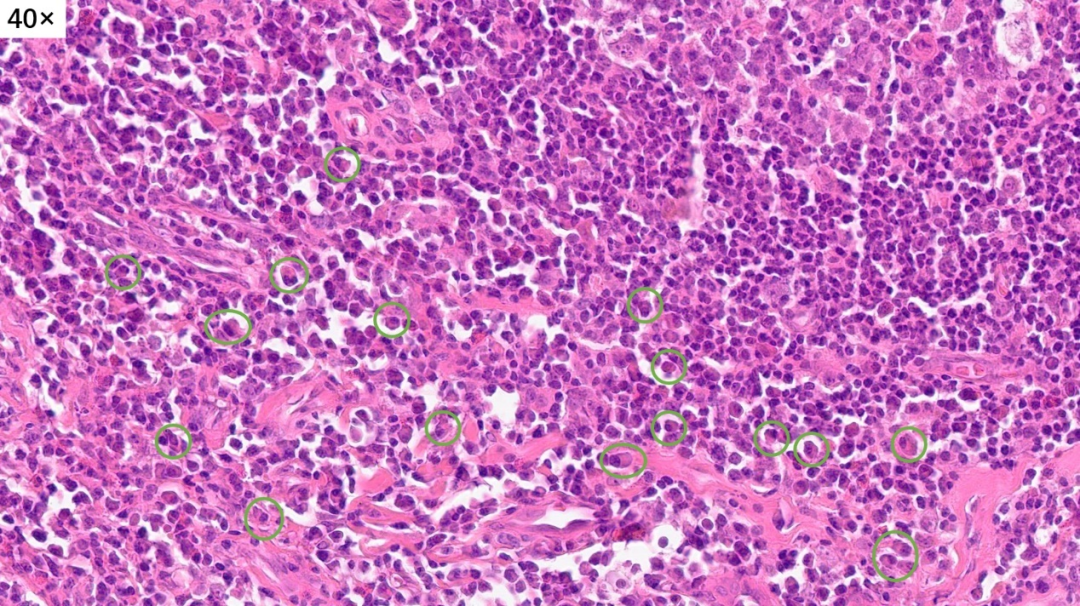
大量的浆细胞
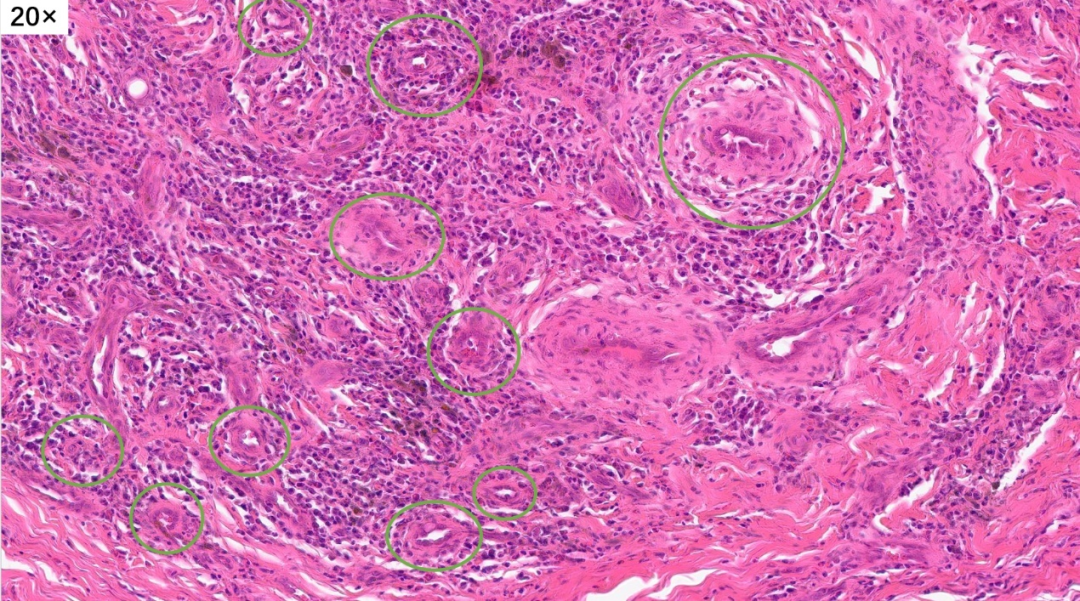
再来看一下这些增生的小血管
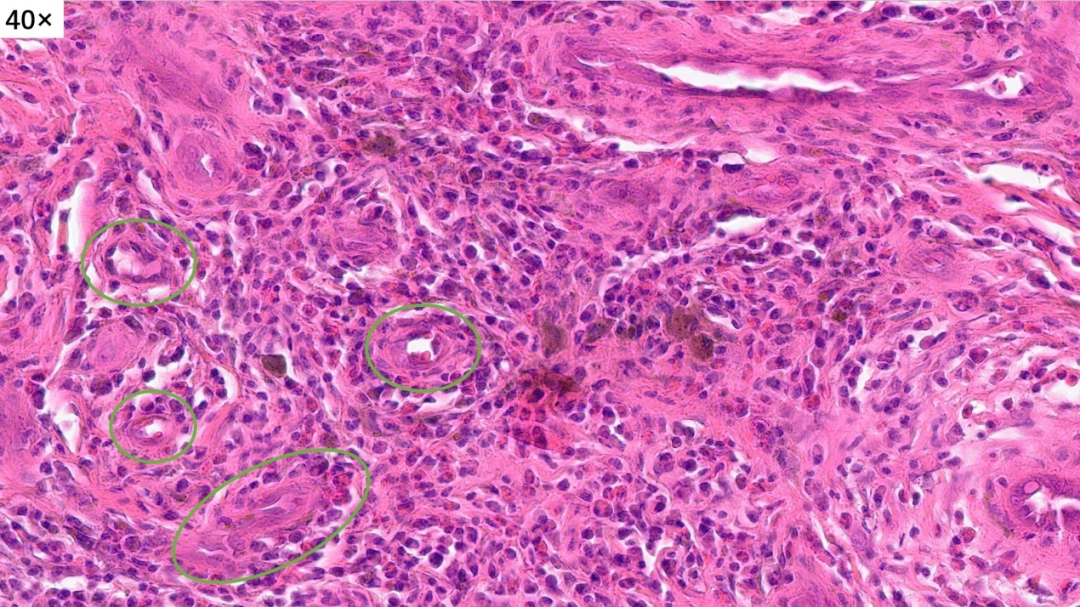
血管周围有大量的炎细胞浸润
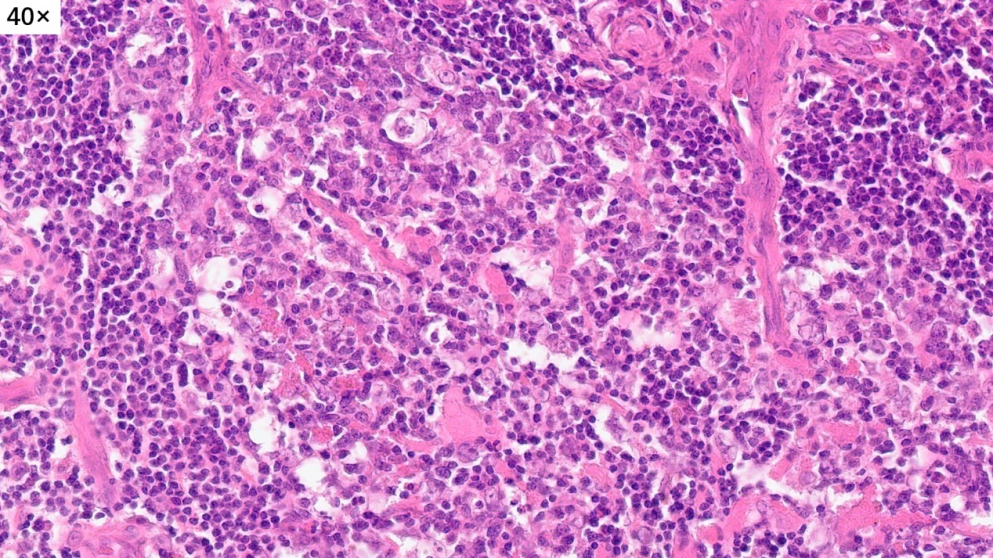
放大生发中心,可以看到类似的组织学形态
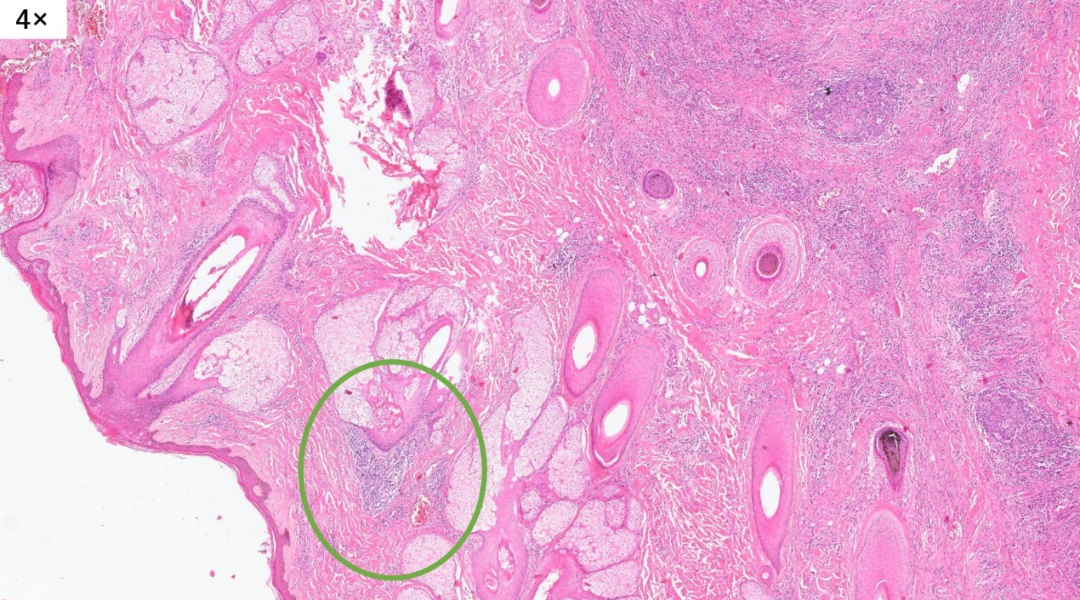
病变主要位于真皮层的深层,但是真皮浅层也有累及
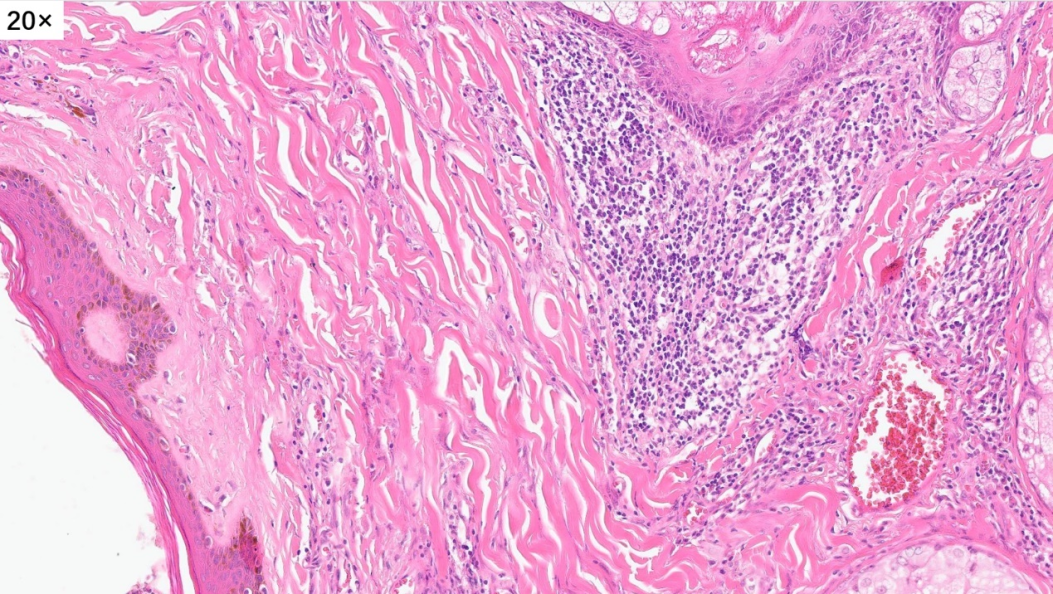
真皮浅层局灶淋巴细胞、浆细胞、嗜酸性粒细胞浸润
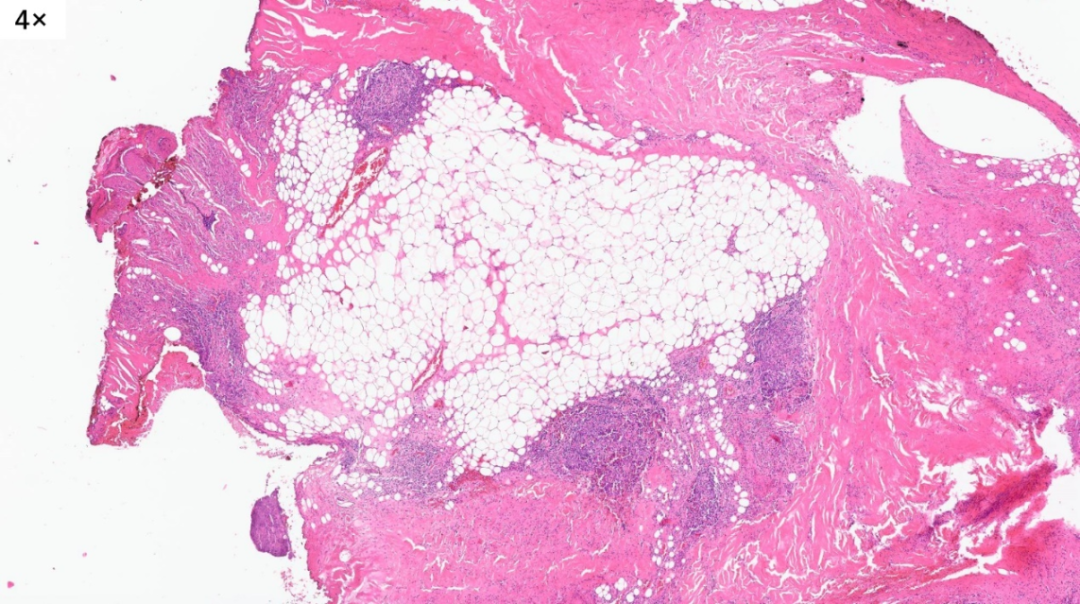
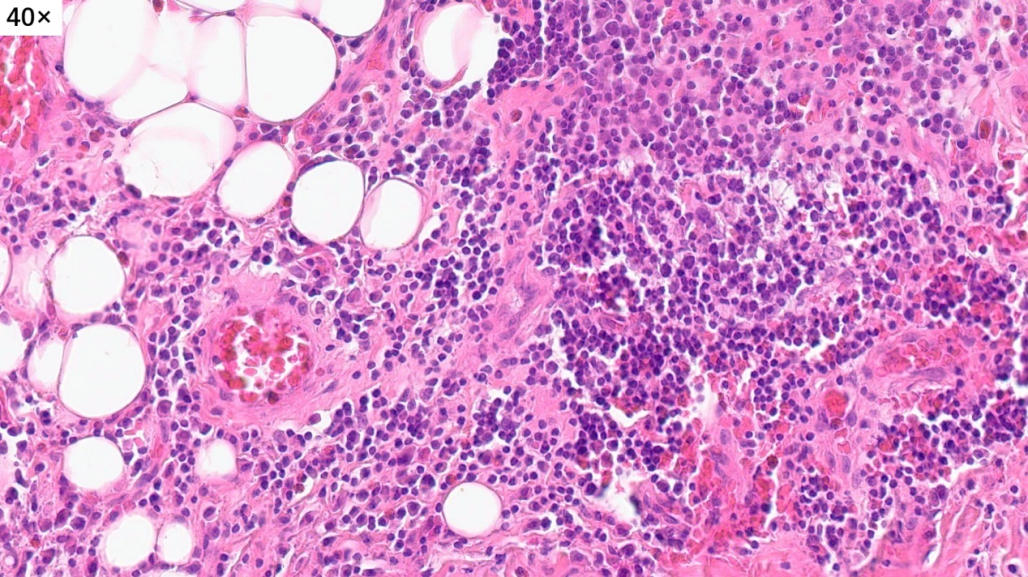
病灶还累及到了皮下脂肪组织
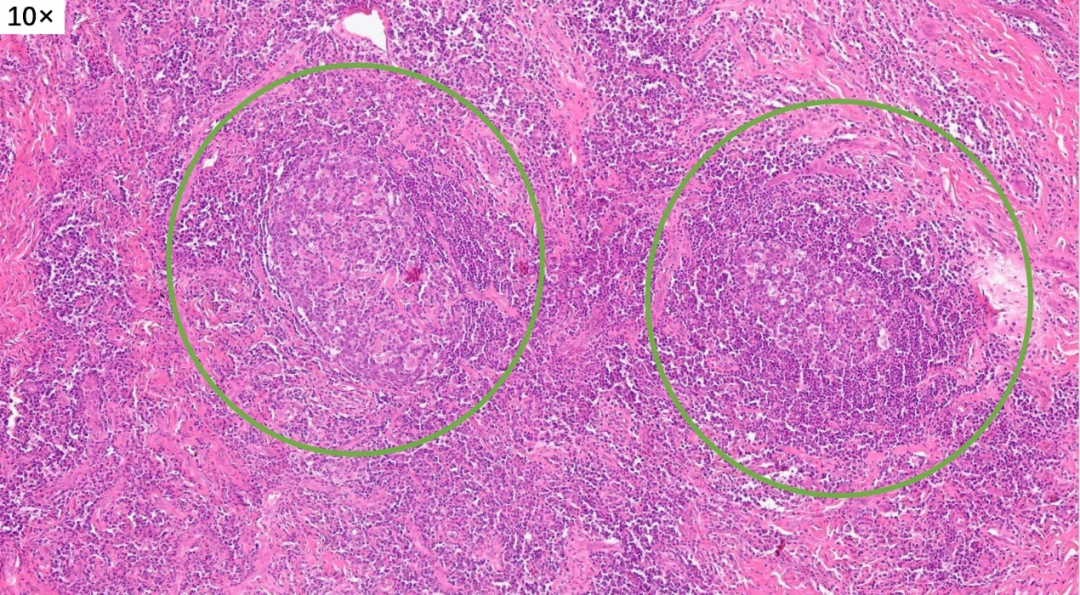
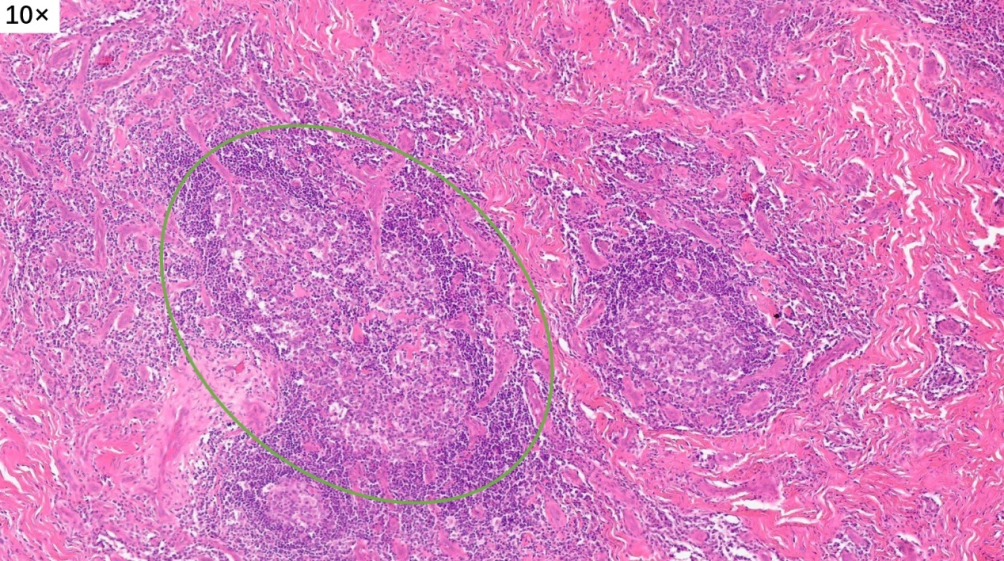
皮下真皮深层,增生的胶原纤维中可见淋巴滤泡形成
大量淋巴组织增生和淋巴滤泡形成
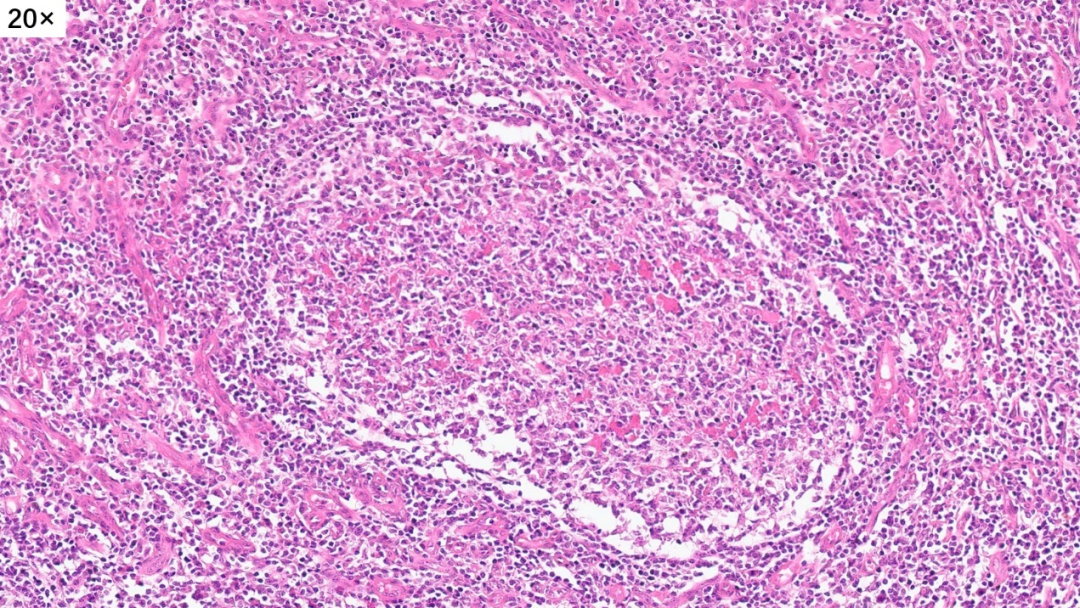
淋巴滤泡没有正常的明区和暗区,套区和边缘区也不清晰,与周围组织的界限不清楚,滤泡中心可见嗜伊红色的物质沉积(滤泡溶解)
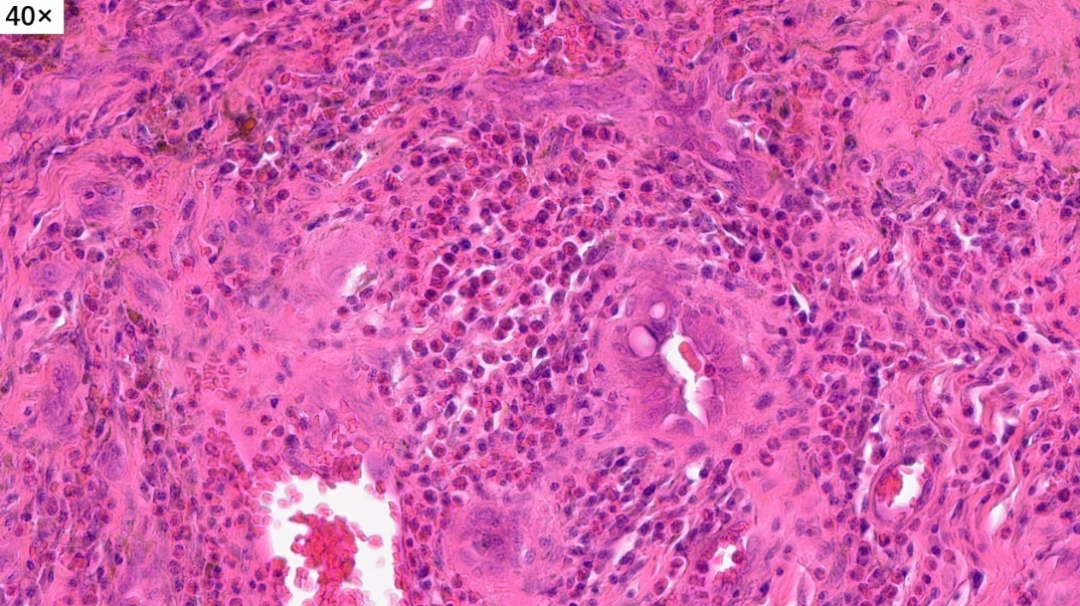
在部分区域还可以看到嗜酸性粒细胞聚集,有微脓肿形成趋势(嗜酸性脓肿)
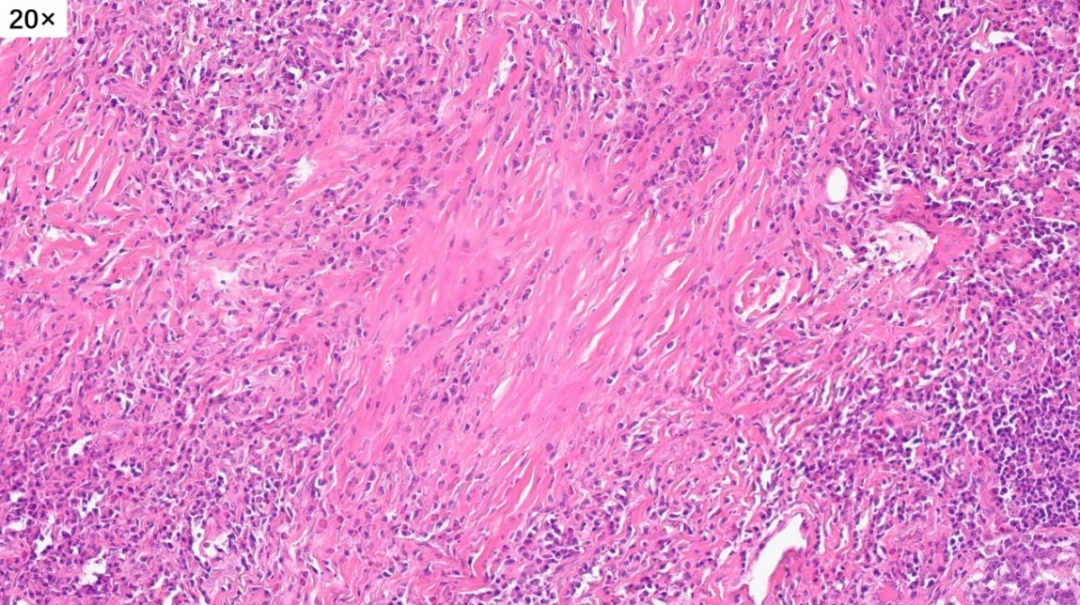
大量的间质胶原化
免疫组化
1、CD21(FDC网+)
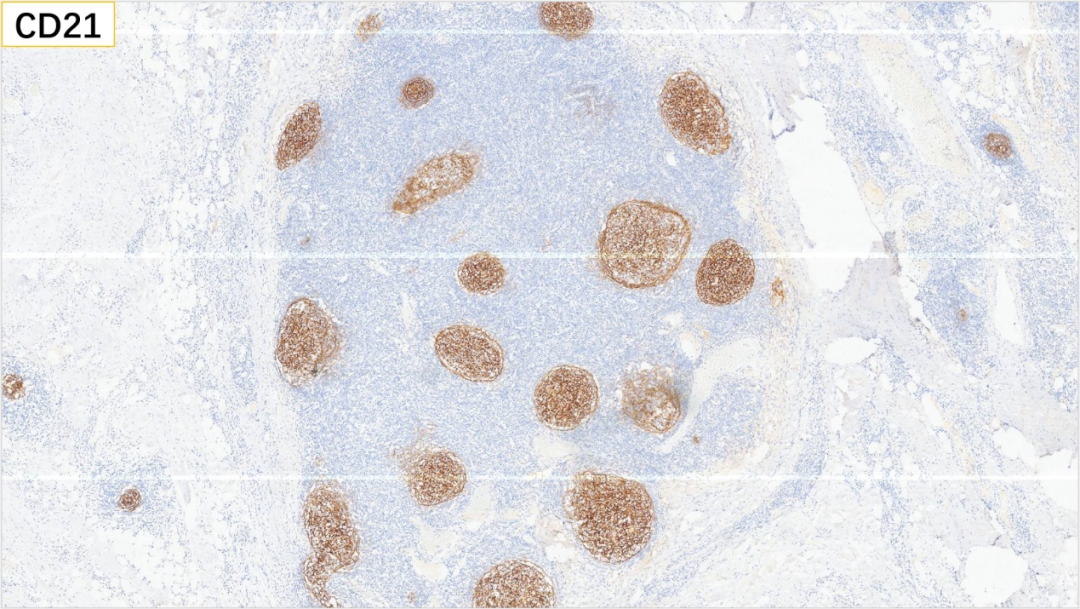
FDC:滤泡树突状细胞(位于淋巴结及脾脏滤泡中的树突状细胞)
2、滤泡区:CD20(+)
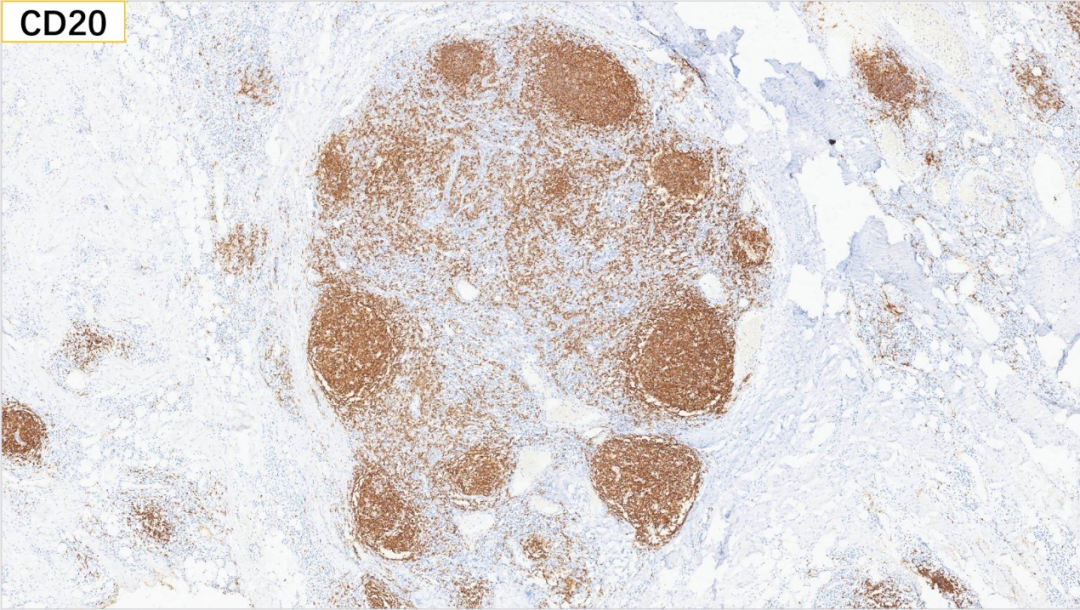
CD20标记生发中心阳性,没有破坏改变
3、滤泡区:CD79a(+)
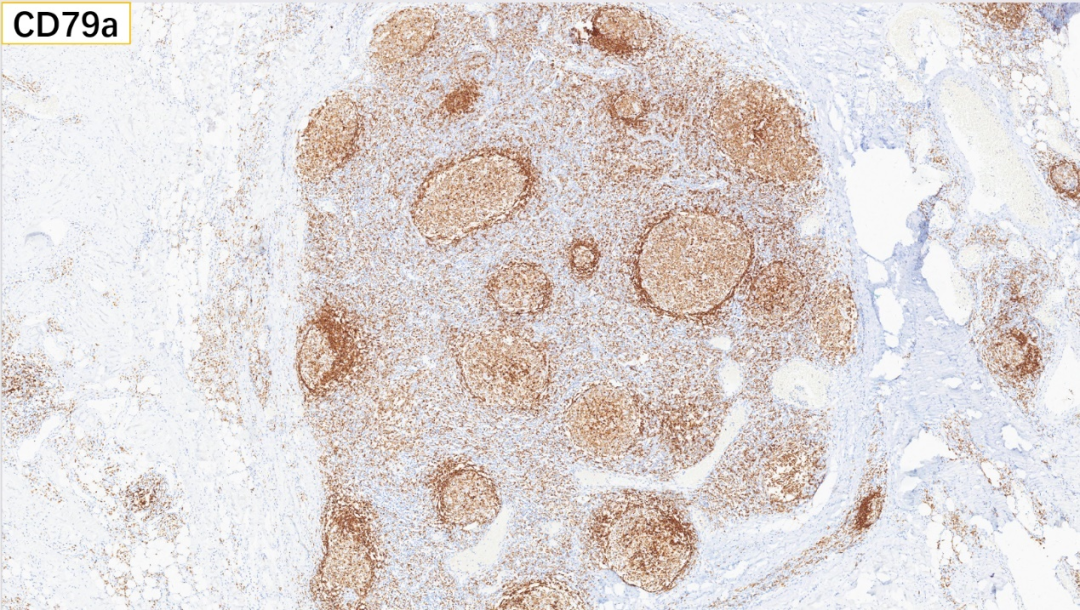
4、滤泡区:IgD(套区+)
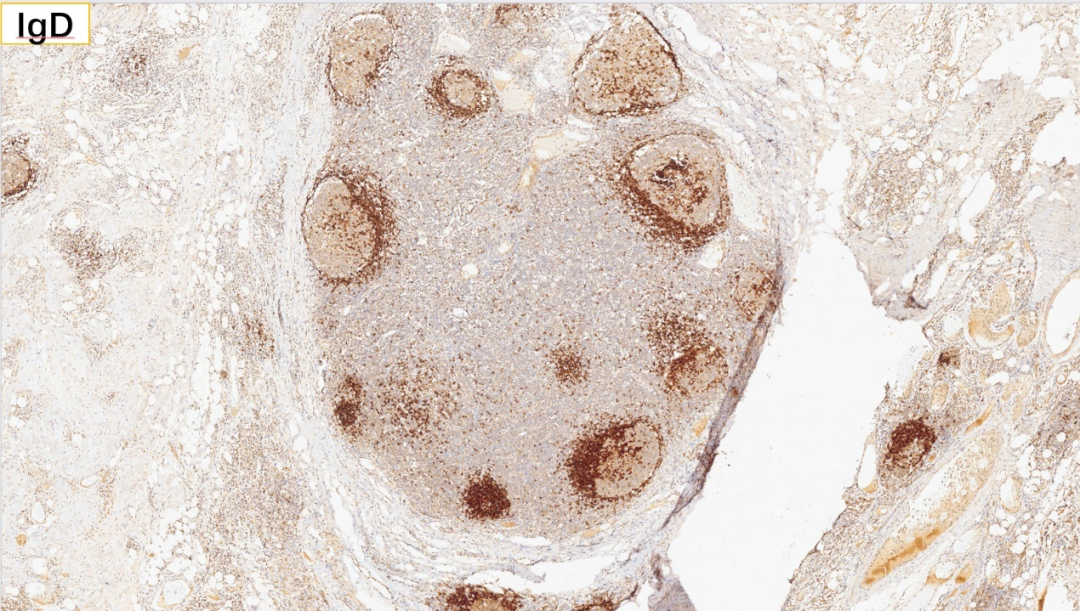
5、生发中心:BCL-2(-)
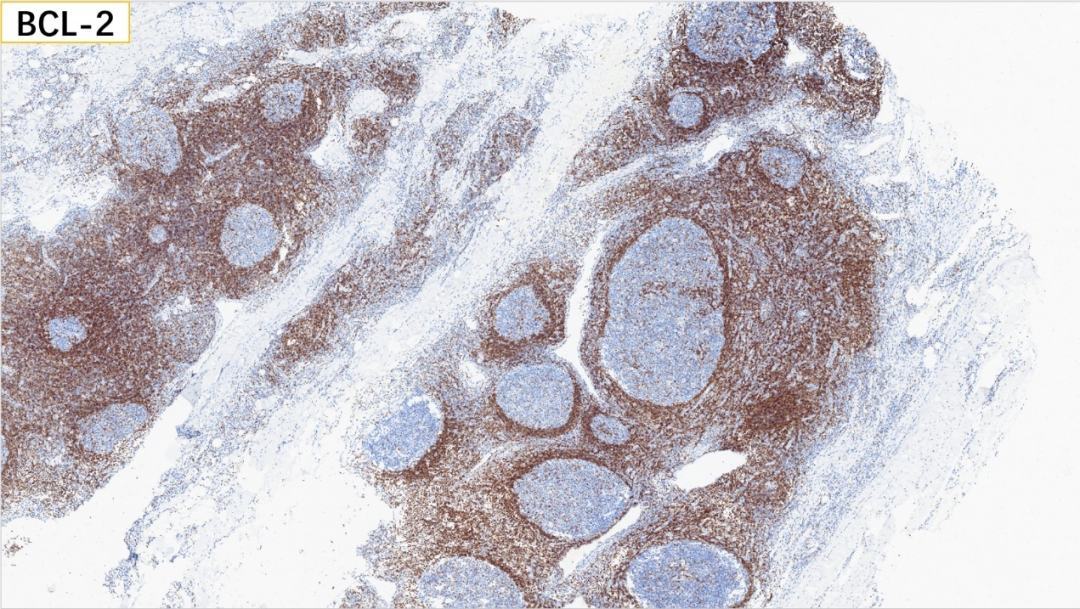
6、生发中心:BCL-6(+)
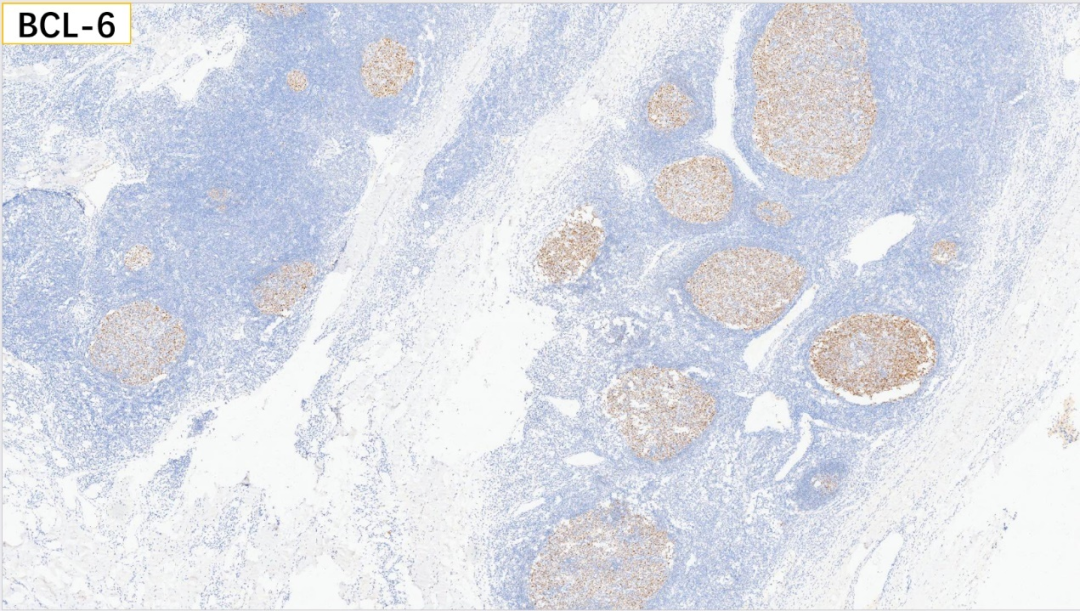
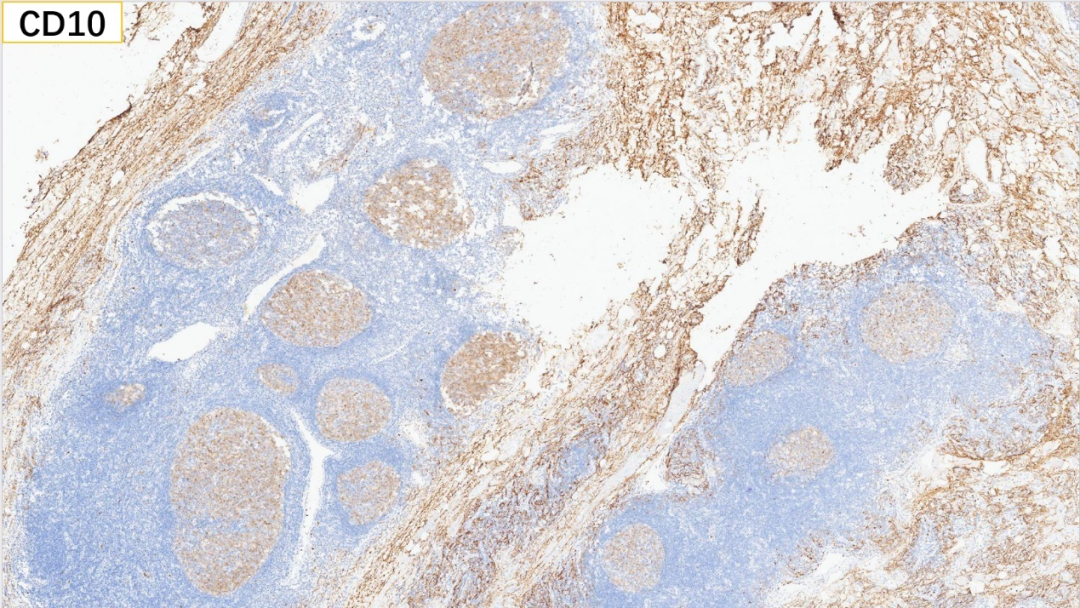
7、生发中心:CD10(+)
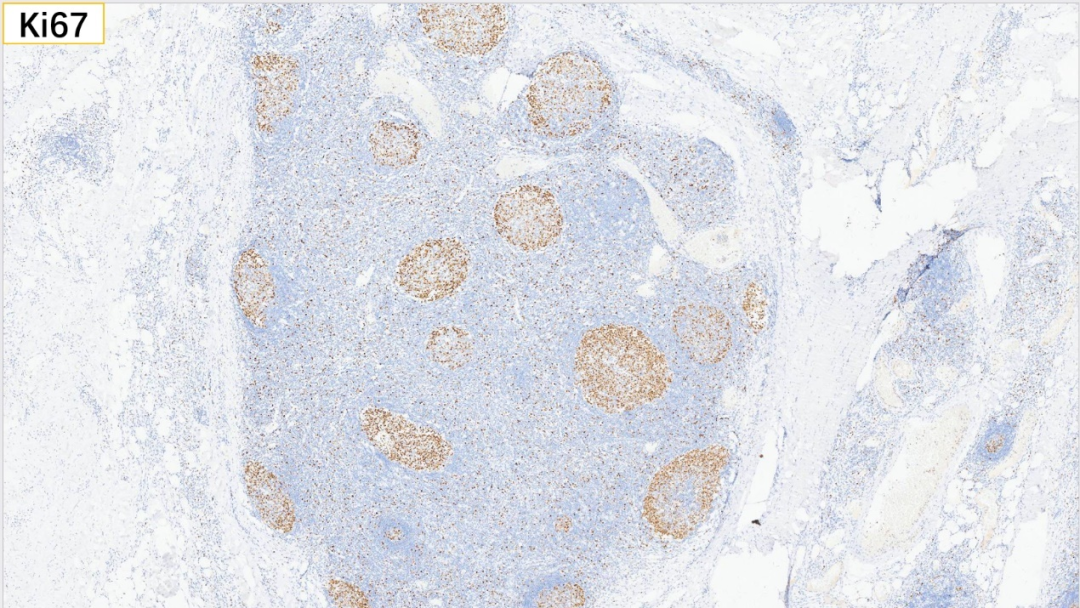
8、生发中心 Ki67(>50%+)
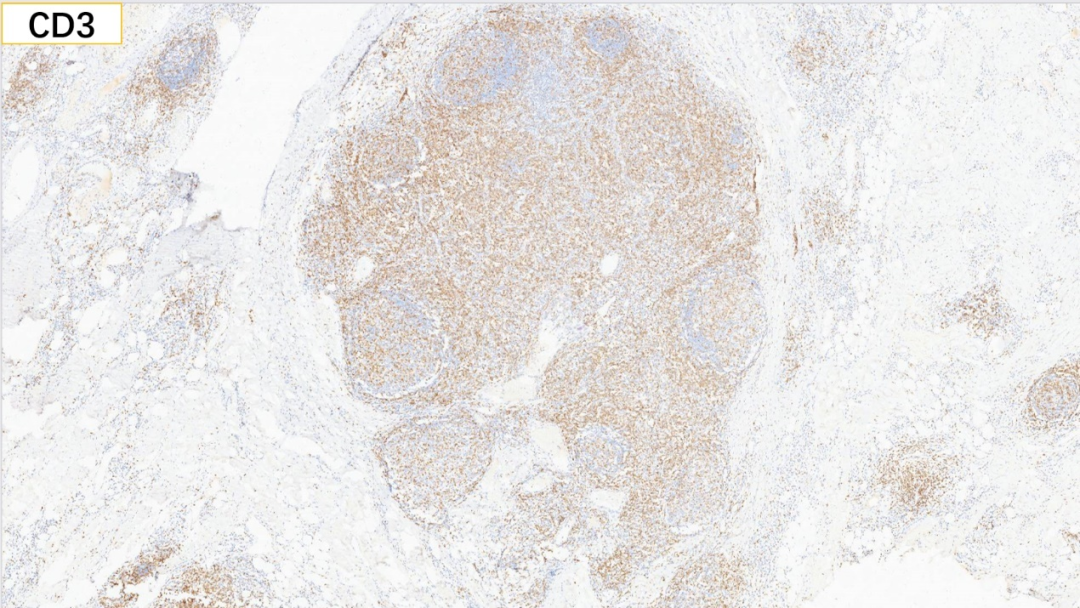
9、滤泡外:CD3(+)
10、滤泡外:CD5(+)
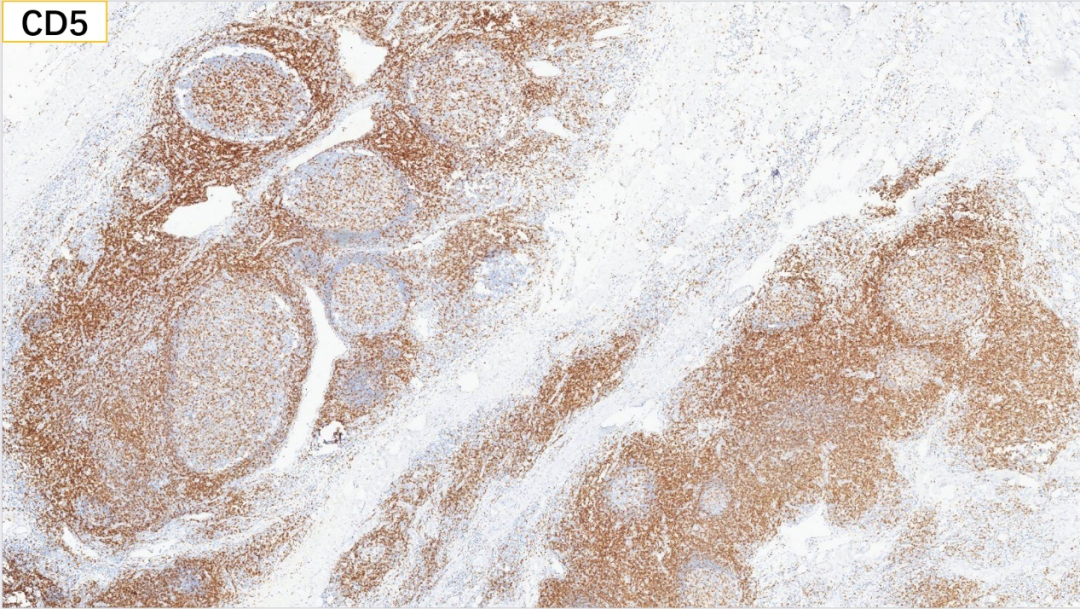
11、滤泡外 CD8(部分+)
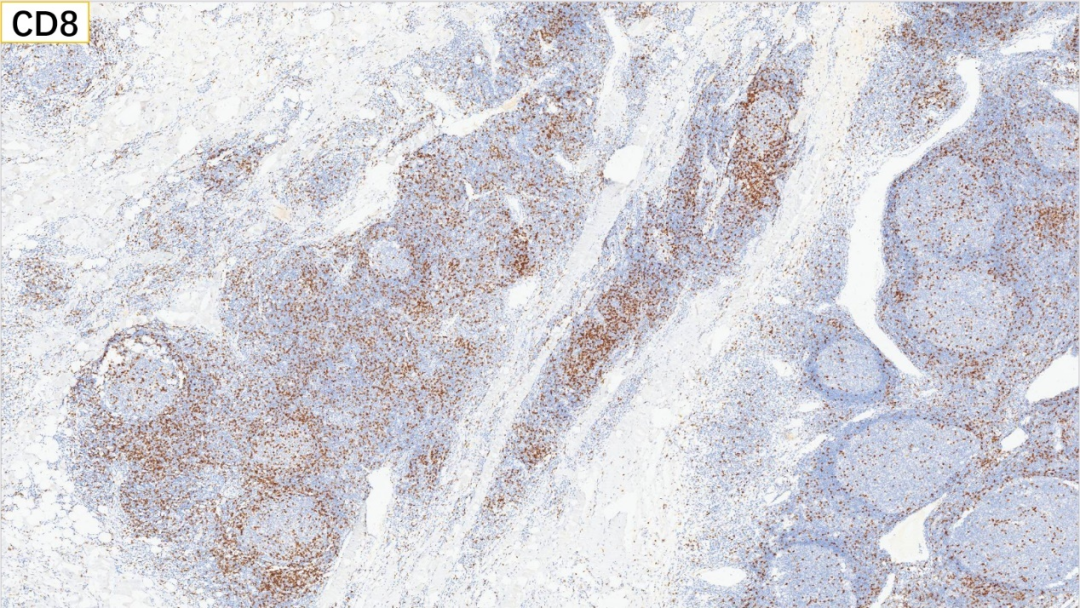
12、滤泡外 CD4(部分+)
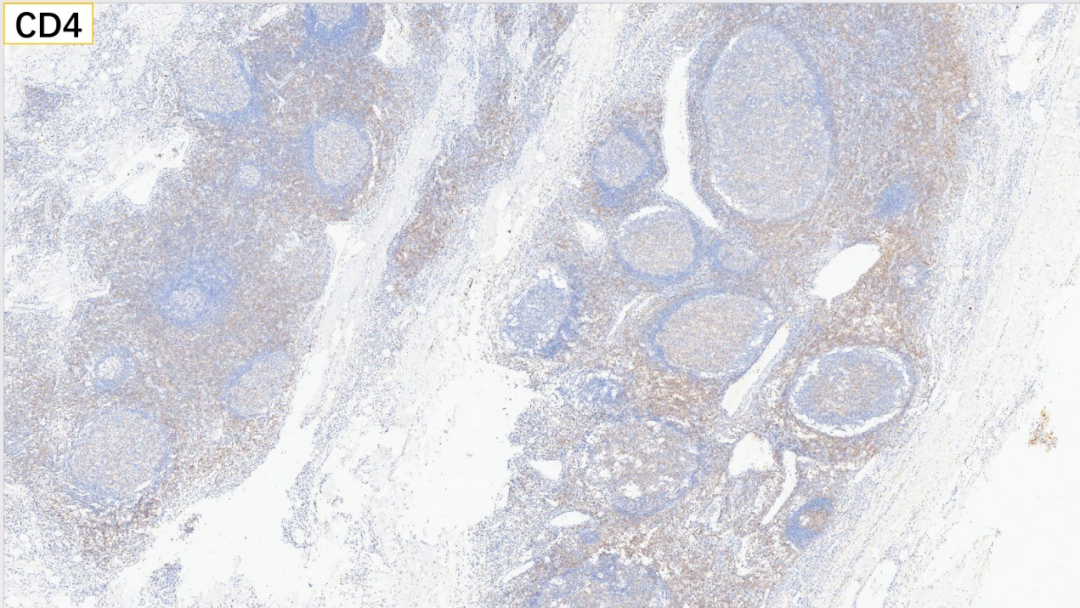
13、浆细胞 CD38(+)
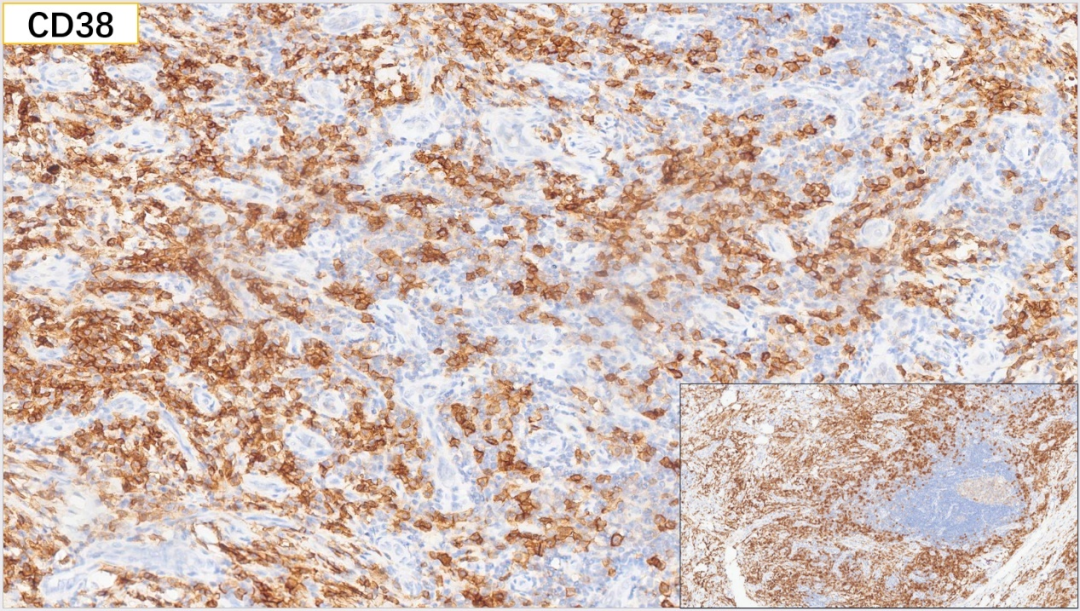
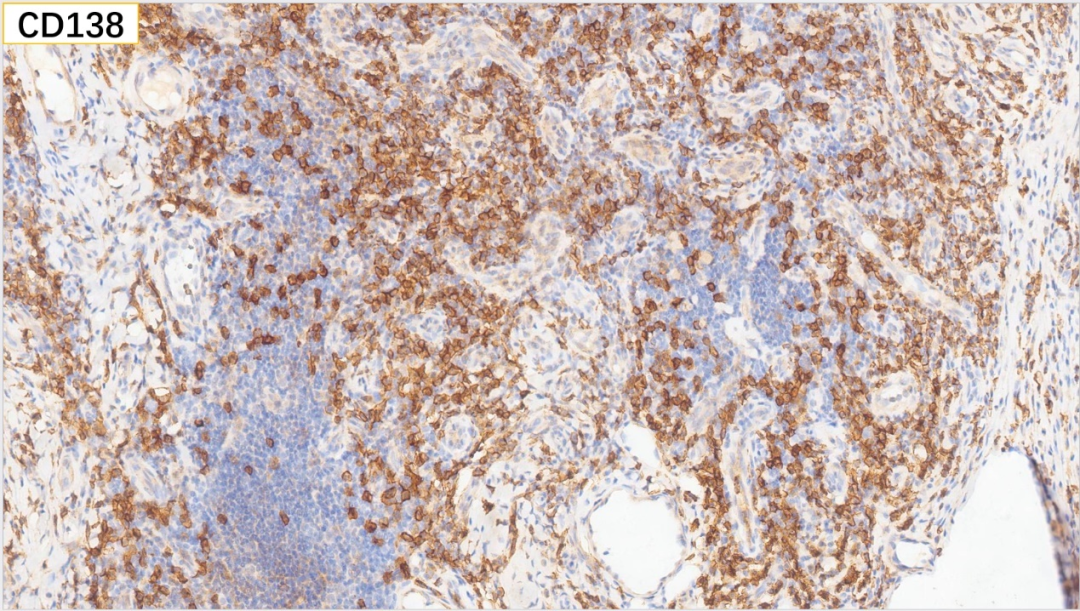
14、浆细胞 CD138(+)
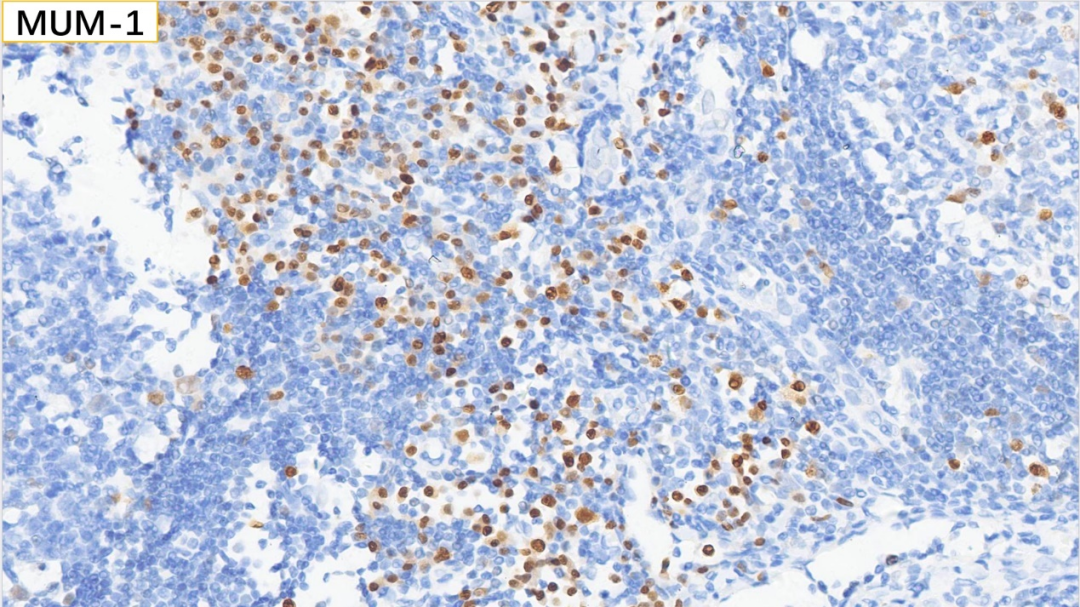
15、浆细胞 MUM-1(+)
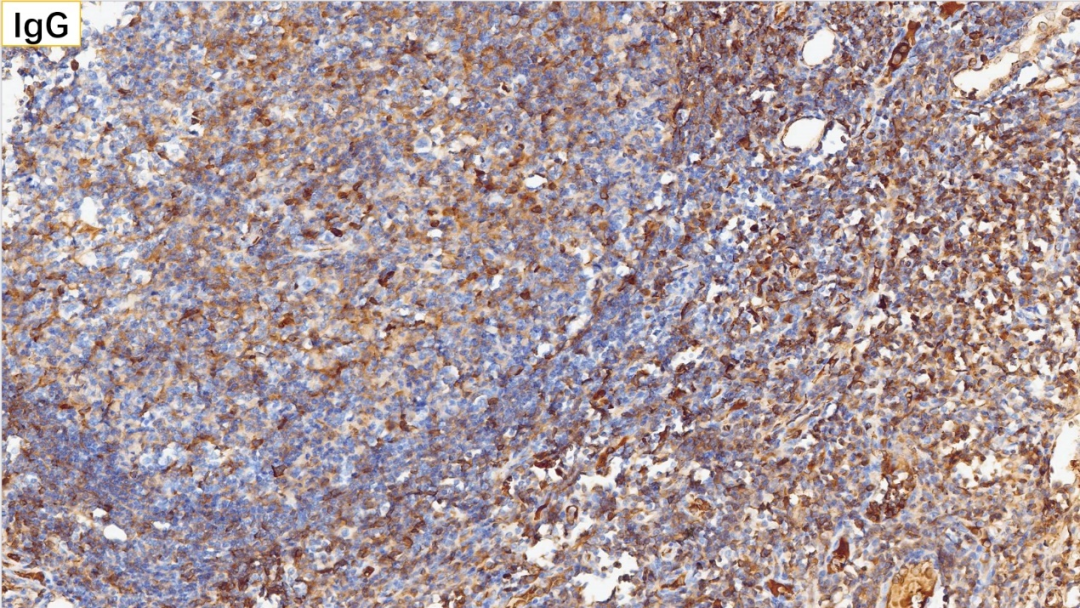
16、浆细胞 IgG(+)
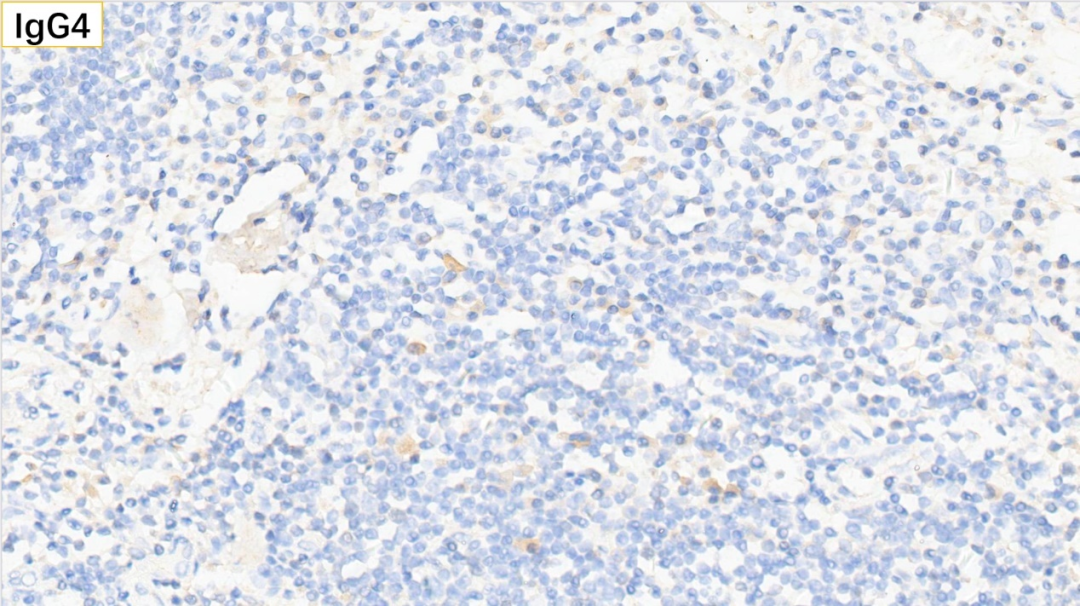
17、浆细胞 IgG4(散在极少数弱+,<10个/HPF)
18、浆细胞 Kappa(部分+)
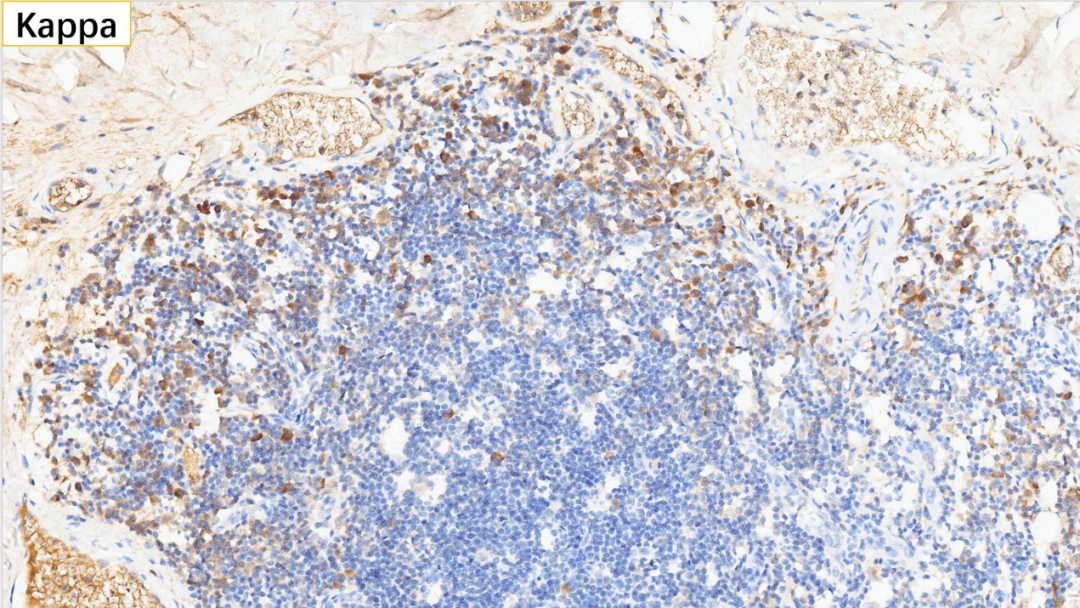
19、浆细胞 Lambda(部分+)
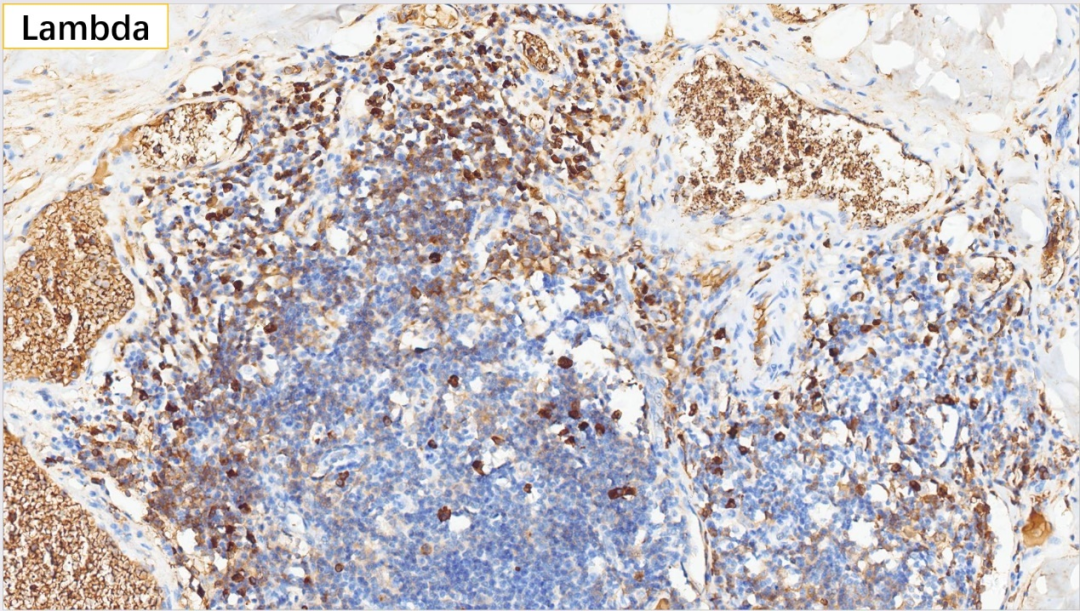
无轻链限制性
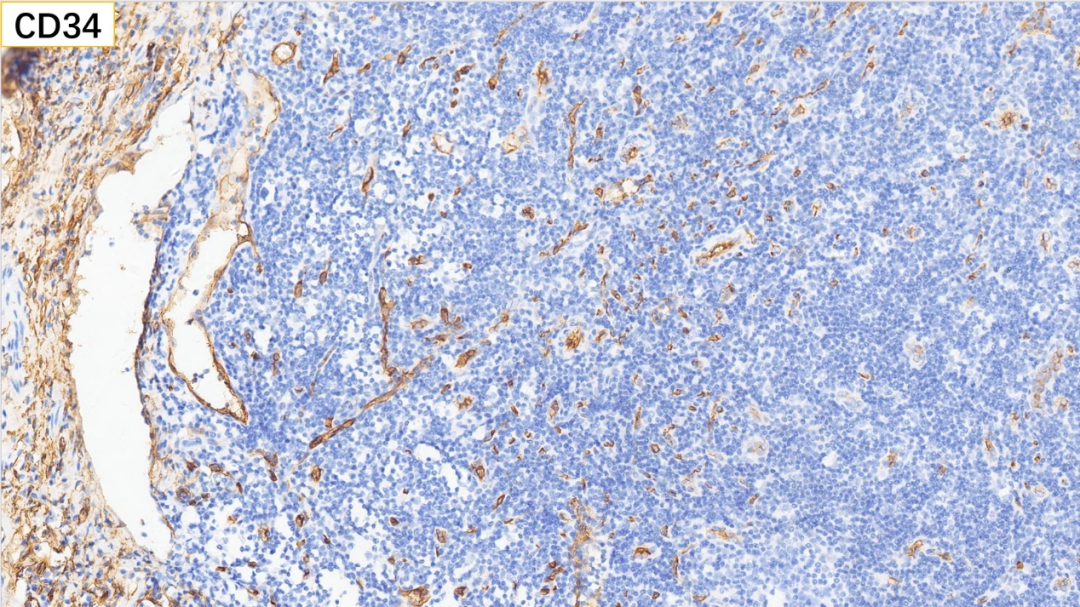
20、内皮细胞 CD34(+)
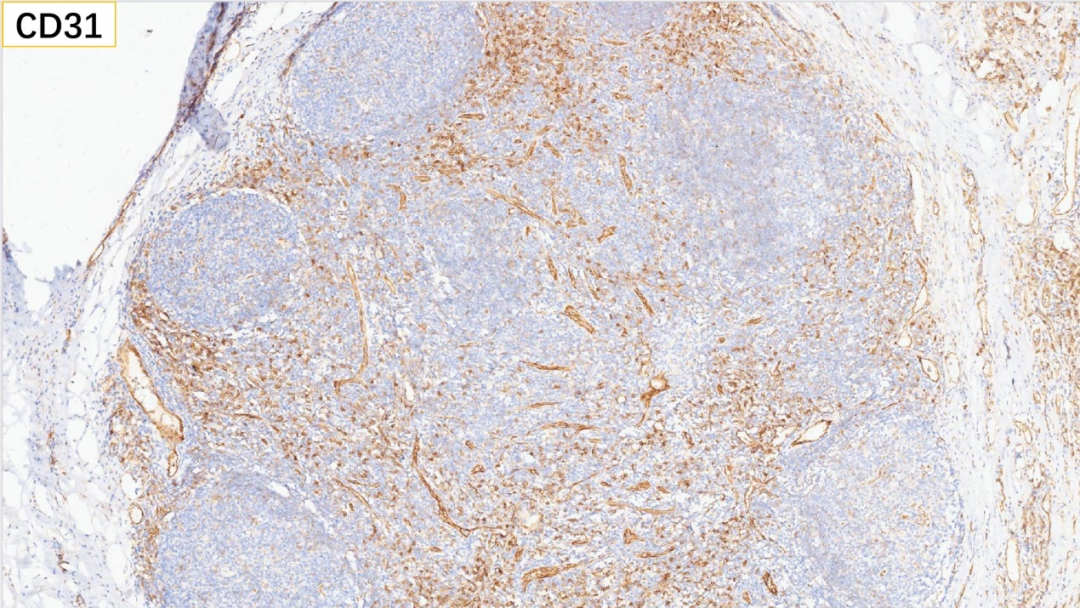
21、内皮细胞 CD31(+)
22、内皮细胞 ERG(+)
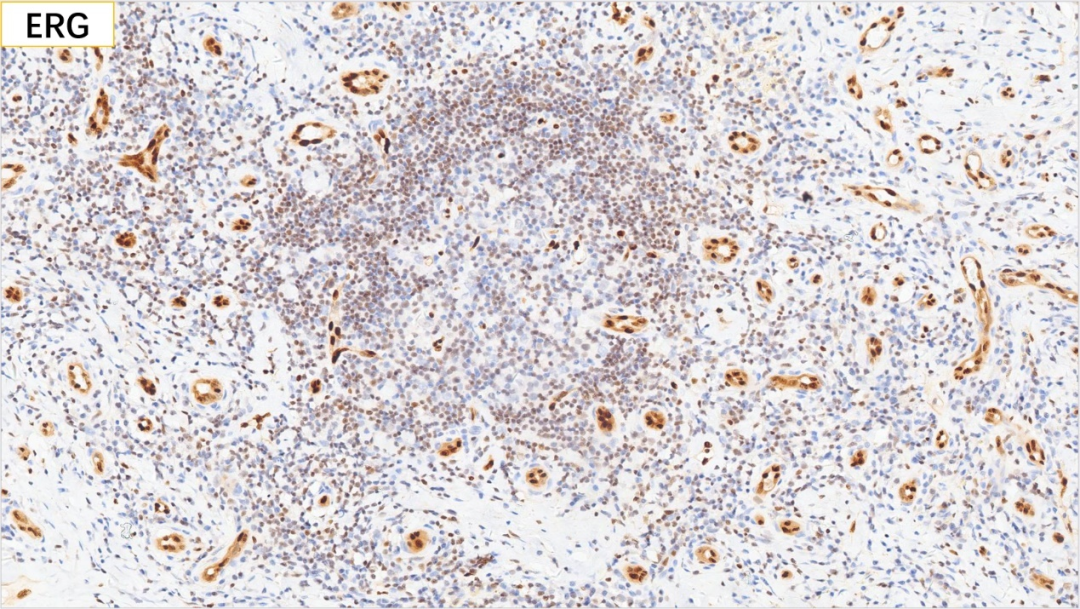
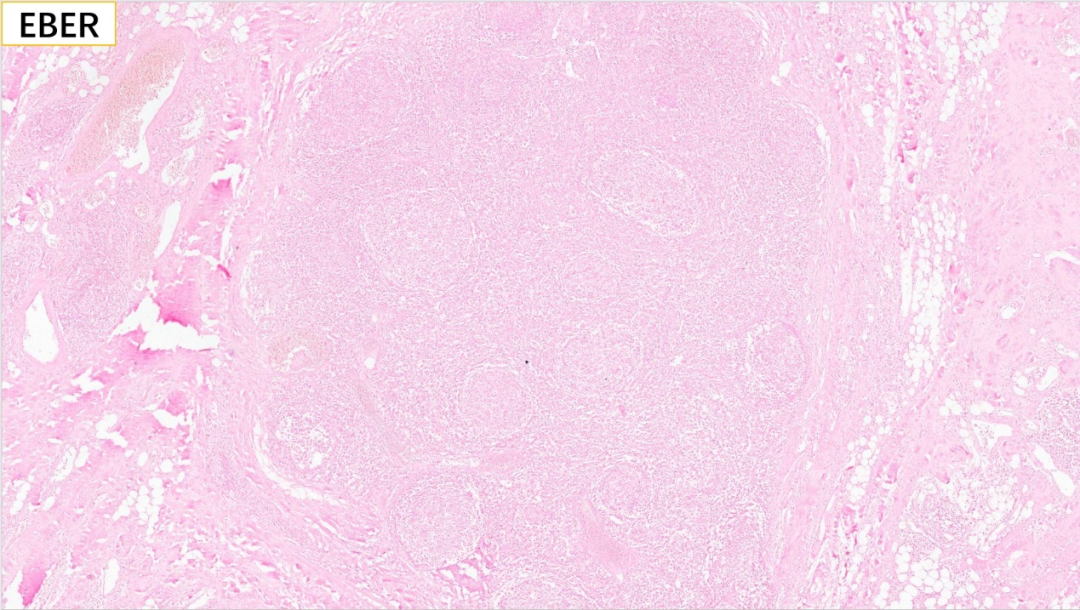
23、EBV原位杂交:EBER(-)
免疫组化结果汇总:
阳性标记:
滤泡区:CD21(FDC网+), CD20(+), CD79a(+), IgD(套区+)
生发中心:BCL-6(+), CD10(+), Ki67(>50%+)
滤泡外:CD3(+), CD5(+), CD8(部分+), CD4(部分+)
浆细胞:CD38(+), CD138(+), MUM-1(+), IgG(+), IgG4(散在极少数弱+,<10个/HPF),Kappa(部分+), Lambda(部分+)
内皮细胞:CD34(+), CD31(+), ERG(+)
阴性标记:
BCL-2(-),EBER(-)
实验室检查
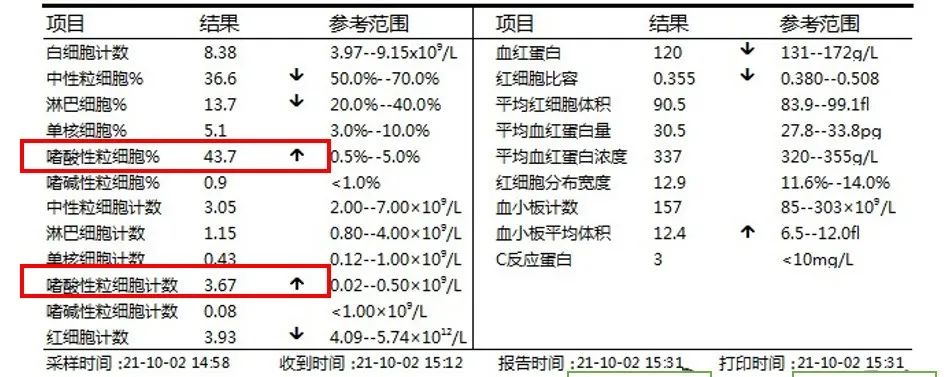
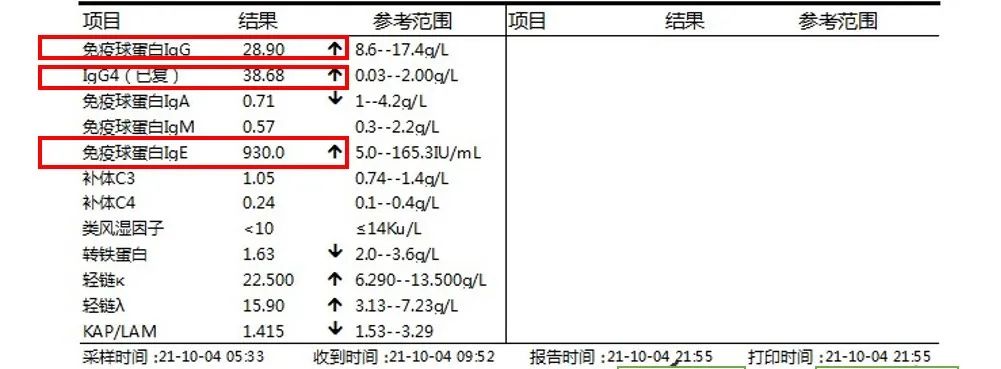
最终诊断
“左头顶肿物”“右顶部、右枕后、枕部肿物等皮肤组织”:
病灶内淋巴细胞及浆细胞增生,淋巴滤泡形成,可见“滤泡溶解”现象,大量嗜酸性粒细胞浸润,间质内高内皮小静脉及胶原纤维显著增生,免疫组化标记结果未显示IgG4阳性浆细胞增生,诊断IgG4相关硬化性病变依据不足,符合“Kimura病”(又称木村病),请进一步结合临床、外周血常规及血清免疫球蛋白检测等结果。
随访
-
患者入院期间,予甲强龙80mg、拜新同降压、利福平+异烟肼预防性抗痨,并护胃、补钙等辅助支持治疗后,头颈部肿物大小较前有缩小,张力降低。
-
出院后,继续保守治疗,未行手术。
Kimura病(木村病)
嗜酸性粒细胞增生性淋巴肉芽肿(Kimura病):慢性免疫炎性疾病
-
原因不明
-
进展缓慢
-
无痛性肿块
-
进行性增大
命名
1937年由我国金显宅医生于首先报道,以嗜伊红细胞性增生性淋巴肉芽肿命名。
1948年日本学者木村对该病进行了系统性研究和解释,因此命名为“木村病”。
临床特点
主要症状:
-
单发或多发,缓慢生长,头颈部皮下软组织或大唾液腺肿块;
-
常伴区域淋巴结肿大;
-
表面可伴有色素沉着、皮肤瘙痒;
-
病程进展较为缓慢,早期常因无明显临床症状而被忽视或误诊;
-
约12%-16%累及肾脏,主要表现为肾病综合征。
病因学:
-
病因及发病机制:目前仍然不明;
-
部分研究根据患者外周血中嗜酸性粒细胞增多和血清IgE水平升高推测,认为很可能与寄生虫感染或自身免疫、过敏反应有关。
血液检查:
-
外周血中嗜酸性粒细胞和lgE水平的增高;
-
伴发肾脏疾病的患者中,可能有lgG4升高、血沉加快、白细胞增多、C反应蛋白升高等现象出现。
治疗:
-
首选手术治疗,完整切除后多可治愈, 但有复发;
-
其他治疗包括激素、化疗、冷冻和放射治疗,特别是针对多发性或复发性病例。
预后:
-
过去认为木村病是一种慢性良性疾病,一般无恶变倾向;
-
近年来有多篇文献报道木村病伴发肾病综合征者出现肾功能衰竭,以及木村病患者发生淋巴瘤的病例;
-
提示木村病不仅易复发,亦有导致严重病例的可能,应加强对木村病患者的随访。
病理学特征
①淋巴细胞增生,滤泡形成,可见滤泡溶解。
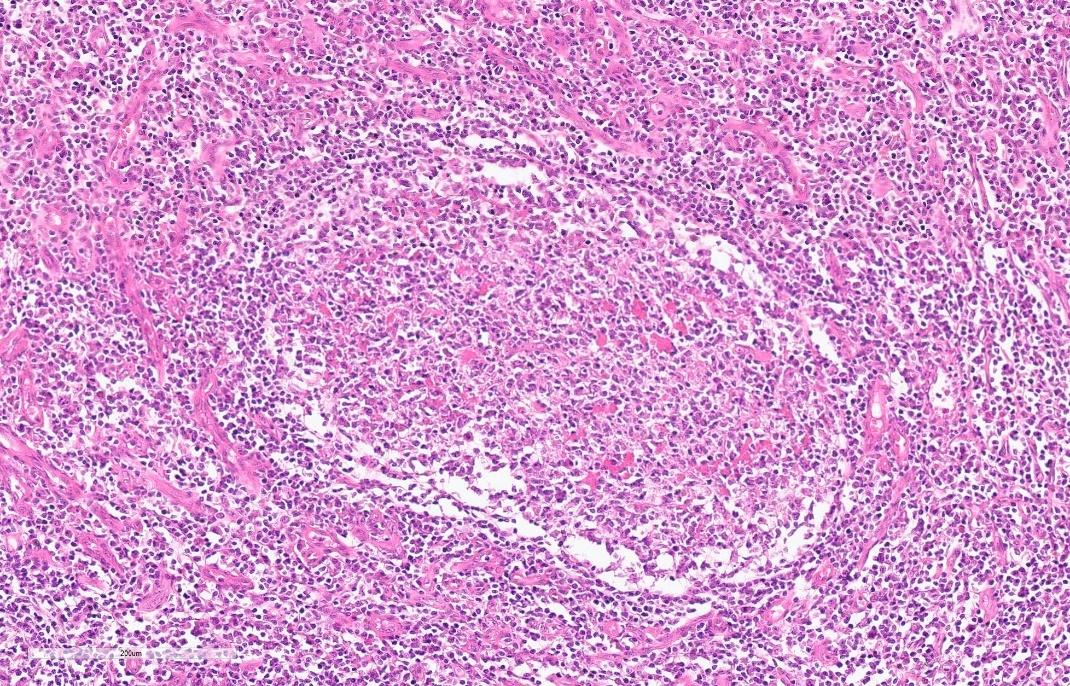
② 滤泡间嗜酸性粒细胞浸润,可形成嗜酸性脓肿。
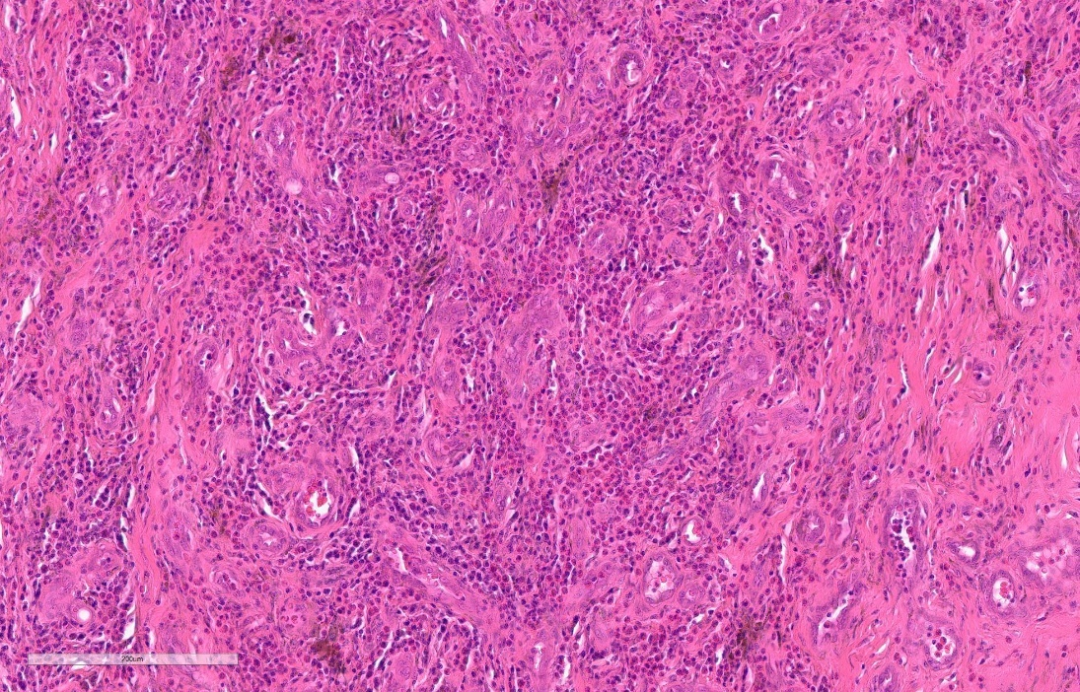
嗜酸性微脓肿:
嗜酸性粒细胞相对集中分布在病灶内,借用脓肿的概念,真正的脓肿是由中性粒细胞聚集,溶解坏死组织形成的。
③血管增生,内皮细胞常呈扁平状。
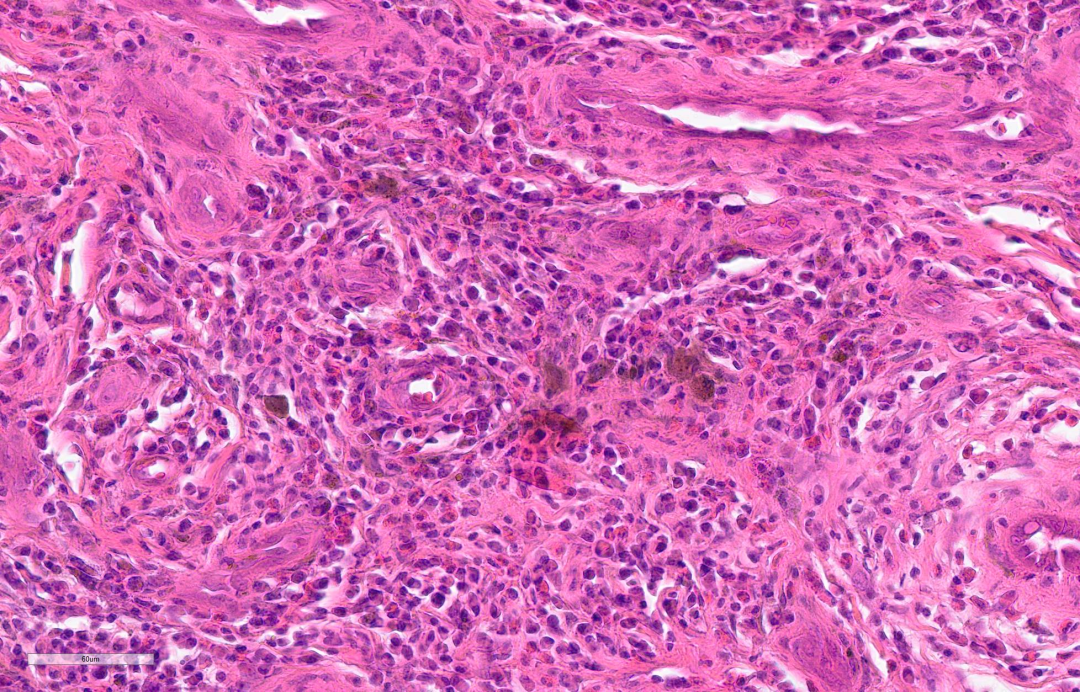
④ 不同程度的纤维化。
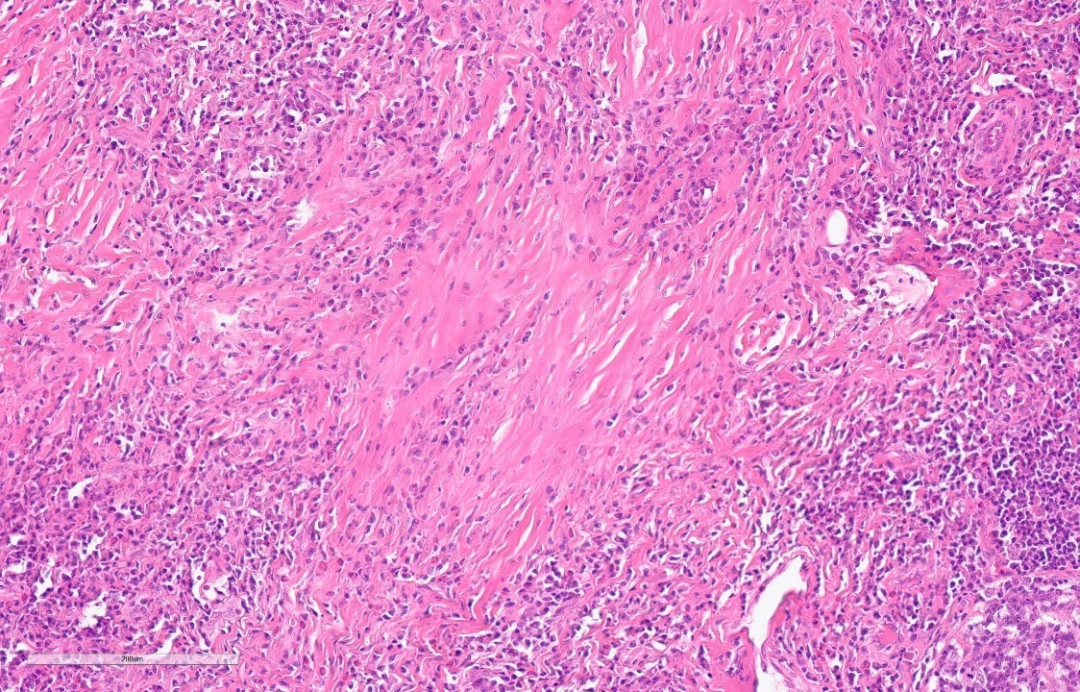
鉴别诊断:
1、IgG4相关的硬化性疾病
与人体免疫系统反应异常有关的全身性慢性炎症伴纤维化。
临床特点:
①可累及多器官和部位,引起各自相应的症状,总体预后较好;
②患者血清中IgG4水平异常增高(最显著)。
病理学特点:
①弥漫性淋巴细胞、浆细胞浸润:IgG4(+)浆细胞量增多,IgG4/IgG比值>40%;
②广泛的纤维硬化;
③可见闭塞性静脉炎。

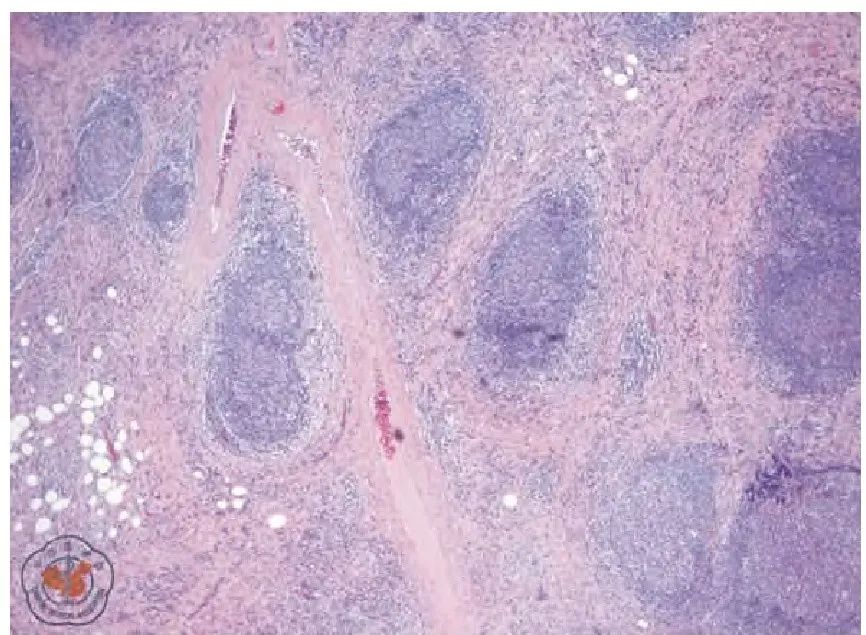
滤泡间区纤维组织增生、硬化伴较多淋巴细胞、浆细胞浸润
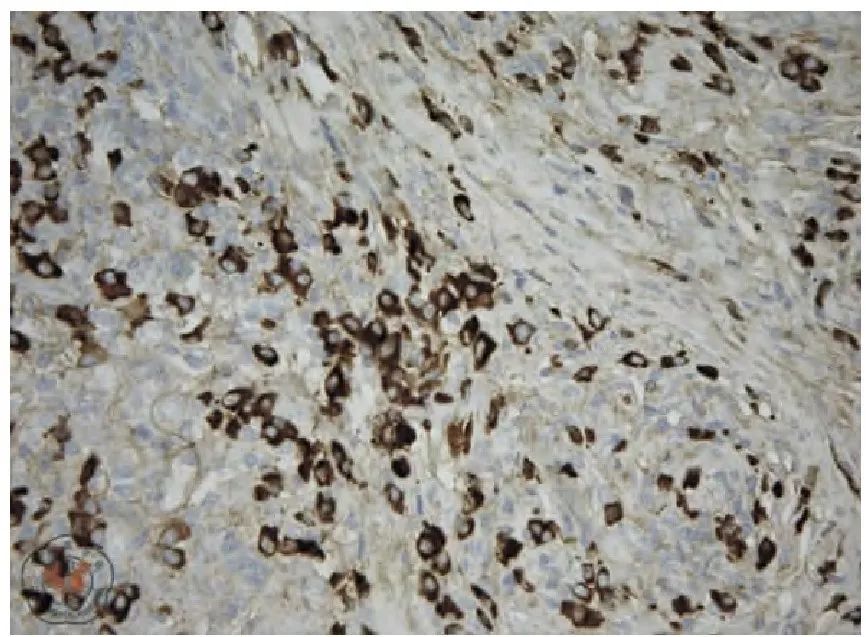
滤泡间区见较多IgG4阳性的浆细胞浸润
2、上皮样血管瘤 (Epithelioid Hemangioma, EH)
又称嗜酸性粒细胞增多性血管淋巴样增生 (angiolymphoid hyperplasia with eosinophilia, ALHE)
-
原因不明的血管增生性疾病
-
多发于头部及颈部,亦可见于四肢、臀部及躯干等
-
单个或多个淡红至暗红色皮下或皮内结节
-
肿块常较小,0.5-2.0cm, >5cm罕见
-
多孤立存在,部分可融合,质坚实
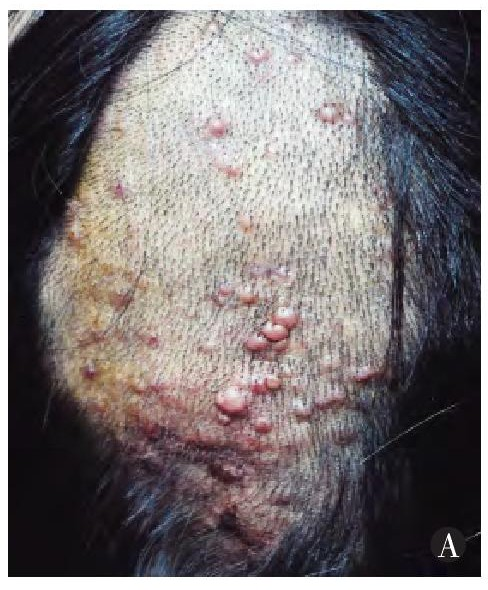
枕部多个孤立的淡红色或红色丘疹, 部分融合成结节, 表面光滑无鳞屑
组织结构
-
境界清楚(发生于真皮者境界可能不清楚)
-
分叶状/结节状
-
病变周围血管腔形成较成熟
-
管腔形成充分的血管具有血管周细胞
-
部分病例可能表现为围绕小动脉呈离心性生长,甚至完全在血管内生长
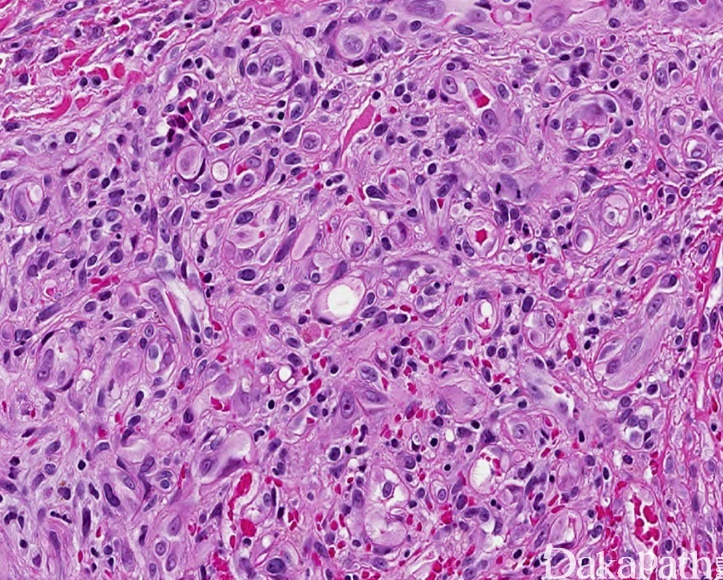
病变细胞上皮样实性排列,胞浆丰富嗜酸性,散在可见胞浆内空泡,核染色质均匀,可见核仁,背景出血较明显。淋巴滤泡较少见。
细胞特点(上皮样)
增生的血管内皮细胞呈特征性的上皮样
-
胞浆:丰富,嗜酸;胞浆内空泡(水疱细胞)
-
胞核:类圆形,染色质细腻或呈空泡状;异型性小,分裂像少。
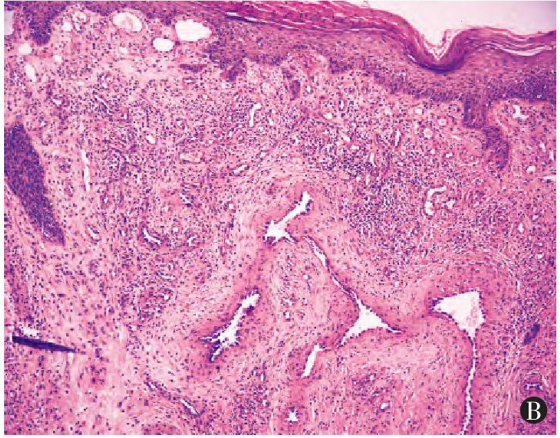
真皮内见增生扩张的血管
间质
-
常有水肿样间质
-
实体区域可能有出血
-
明显淋巴细胞/浆细胞、嗜酸性粒细胞浸润
-
淋巴滤泡形成(头颈部)
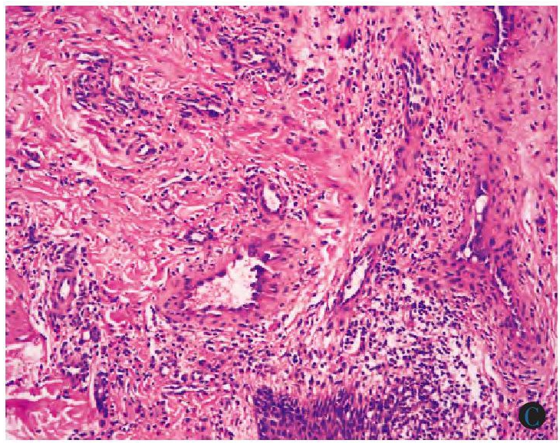
血管周围有较多的淋巴样细胞和嗜酸性粒细胞浸润
免疫表型
-
表达CD31、FLI-1、ERG
-
CD34表达程度低
-
可表达CK、EMA
-
约54%表达FOSB
-
血管周细胞SMA+
分子异常
约50%病例有 FOS/FOSB 重排(融合基因:LMNA,MBNL1,VIM)

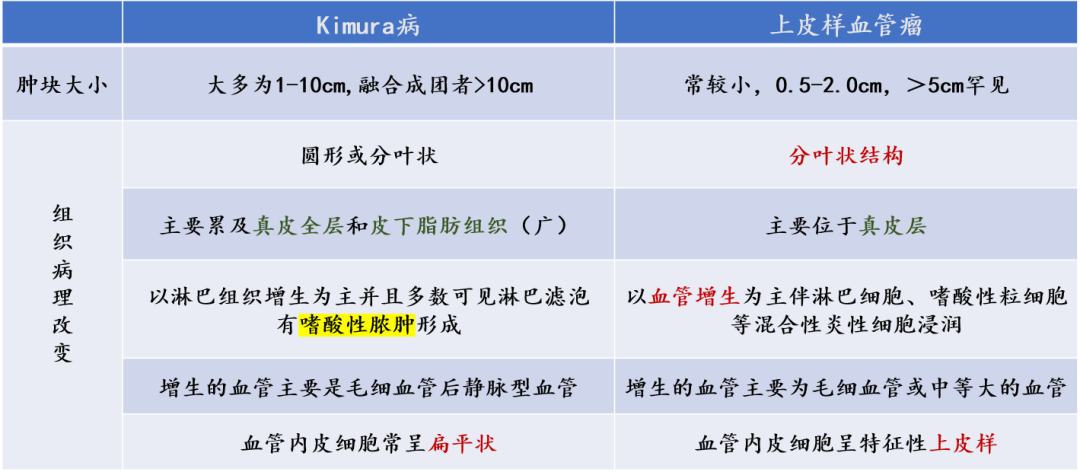
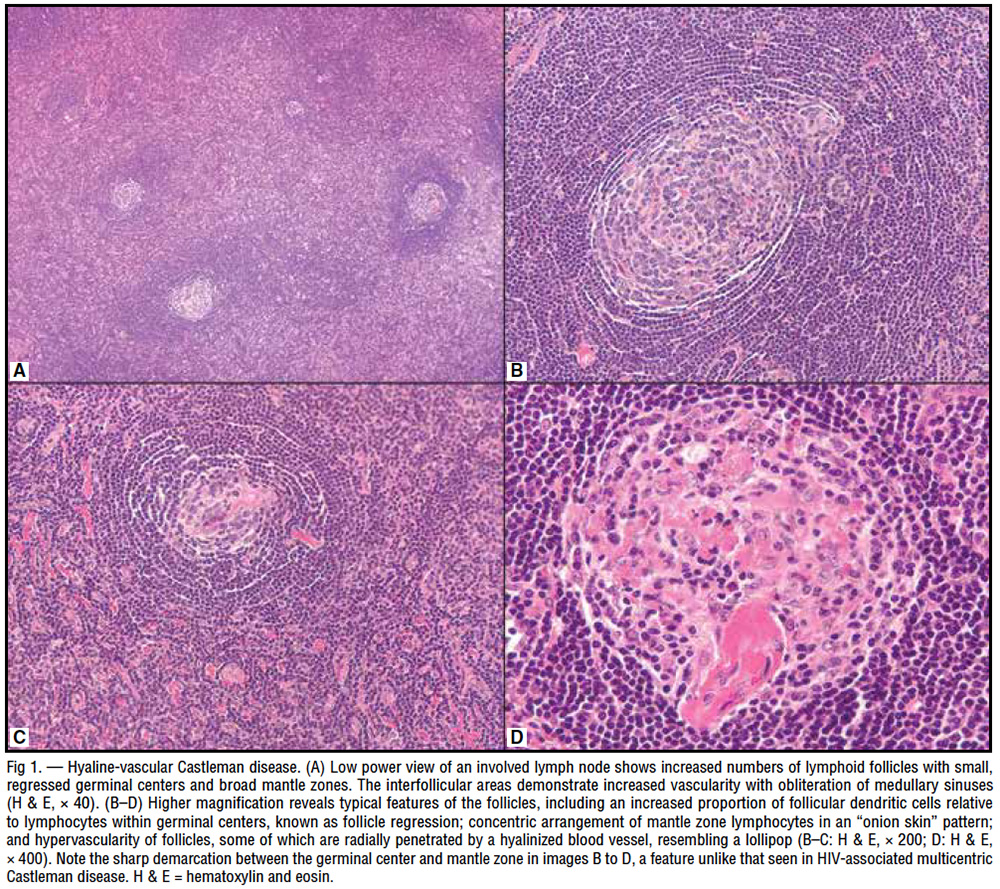
3、Castleman病(又称:巨大淋巴结增生)
-
单发或全身多发的淋巴结肿大
-
分型
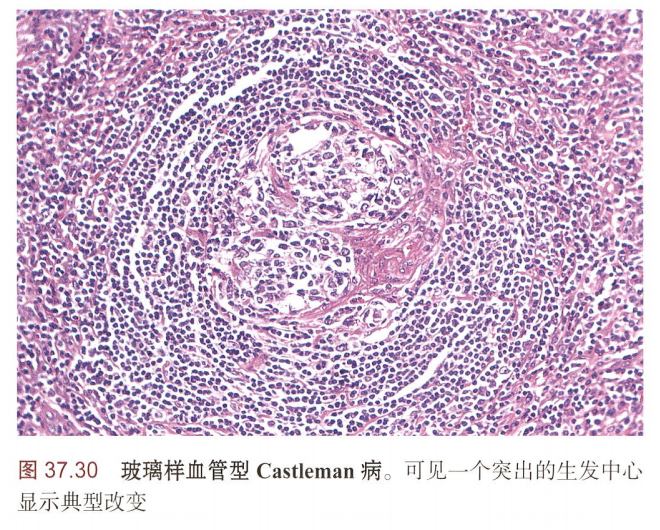
透明血管型:生发中心退化和显著的血管化
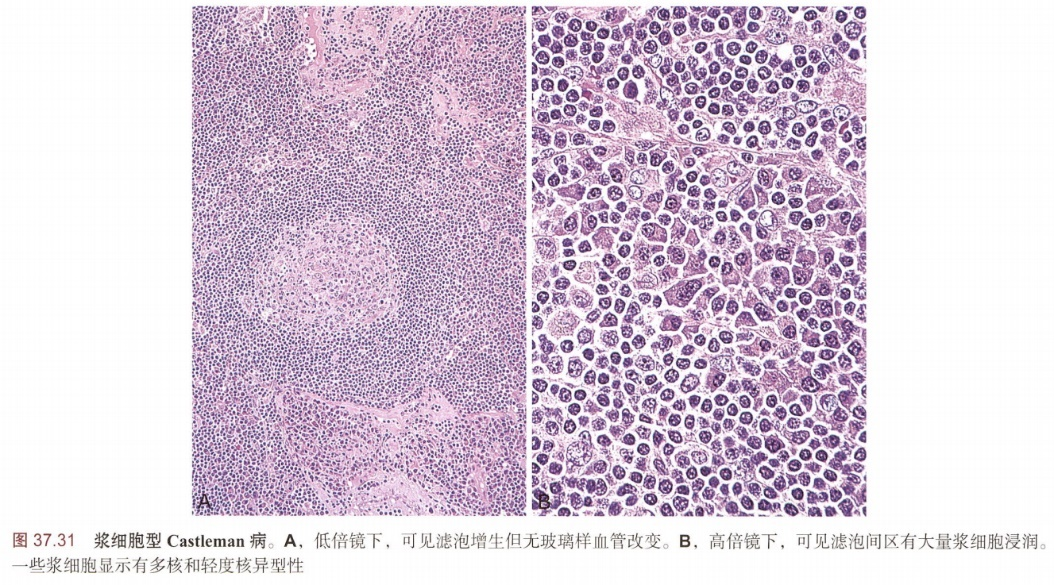
浆细胞型:生发中心浆细胞数目增多
混合型:兼具两者组织学特点
-
淋巴结病理:特征性“洋葱皮”样外观,及“棒棒糖”样结构
-
无嗜酸性粒细胞增多、IgE升高表现
哪些疾病可见大量的嗜酸性粒细胞?
-
过敏、寄生虫感染
-
朗格汉斯组织细胞增生症
-
Kimura病
-
上皮样血管瘤
-
经典性霍奇金淋巴瘤
-
少数外周T细胞淋巴瘤
……
参考文献及书籍:
1.汪淼,侯劲松,黄洪章,肖刚.口腔颌面部IgG4相关硬化性疾病15例临床病理分析[J].中华口腔医学研究杂志(电子版),2012,6(02):167-173.
2.孙兰,王翠彦,黄长征,段逸群.嗜酸性粒细胞增多性血管淋巴样增生1例[J].临床皮肤科杂志,2015,44(10):639-640.
3.《罗塞和阿克曼外科病理学》(第11版)


