Nature:发育与肿瘤新探索:多模式时间记录揭示胚胎发育与癌前期肿瘤起源
时间:2024-11-03 11:00:12 热度:37.1℃ 作者:网络
引言
哺乳动物的发育过程从单个受精卵开始,经历高度精确的细胞分裂和谱系分化,逐渐分化出不同的细胞类型和组织。细胞间通过复杂的信号传递相互作用,协调其分化和功能。这一过程不仅决定了胚胎发育的成功与否,也为理解癌症等病理状态下的组织发生和发展提供了重要线索。因此,重建发育过程中的细胞谱系以及理解其时间顺序,对于发育生物学和癌症生物学的研究具有重要意义。
尽管传统方法(如显微镜直接观察和基于遗传突变的不可逆记录)在细胞发育研究中发挥了重要作用,但它们在追踪细胞状态动态变化和时间信息方面存在显著局限性。尤其是在处理多样且高度动态的细胞行为时,仅靠静态观察难以有效揭示细胞分裂和分化的复杂动态。因此,开发一种能够在体内实时记录细胞事件的新型技术,成为解决这一挑战的关键。10月30日Nature的研究报道“Temporal recording of mammalian development and precancer”,开发了一种新型的分子时间记录策略,通过体内标记和追踪细胞事件的时间顺序,结合细胞状态及谱系信息,从而为理解胚胎发育和肿瘤发生的时空动态提供新的工具和视角。
癌前期肿瘤发生与进展是肿瘤学中的核心科学问题之一。理解癌前组织的多克隆起源对于阐明肿瘤演化路径、设计早期诊断手段和制定干预策略具有重要的理论和临床意义。大多数肿瘤被认为是起源于正常组织中的一个或少数几个细胞,但癌前期这些细胞往往以克隆形式扩展,并形成高度复杂的遗传和表观遗传多样性。因此,揭示癌前期肿瘤的多克隆特性及其动态演化,将有助于在肿瘤的早期阶段进行更为有效的预防和治疗。

该研究采用了一种基于CRISPR的单细胞平台,称为原生单向导RNA捕获与测序(NSC-seq),该平台可以同时捕获信使RNA(mRNA)和向导RNA(gRNA),通过突变积累模式记录细胞事件的时间顺序。NSC-seq技术的优势在于能够将基因表达信息与基因组编辑信息整合,从而利用CRISPR诱导的突变累积,推断细胞事件的发生顺序。这种方法不仅为细胞谱系追踪提供了时间信息,还能结合基因表达分析以了解细胞的状态和功能。
在小鼠胚胎中的应用中,研究人员对不同的发育时间点(E7.75、E8.5、E9.5)进行了采样,并利用NSC-seq技术分析了不同胚胎细胞类型的发育过程和基因表达动态变化。通过捕获这些时间点的数据,研究人员重建了不同组织在发育过程中各阶段的细胞谱系,揭示了组织特异性的发育轨迹及其背后的动态机制。
在人类癌前组织的研究中,研究团队结合了多组学数据,对418例人类大肠息肉进行了克隆分析,以确定癌前组织的多克隆起源。通过深入分析这些息肉的细胞组成和基因特征,研究人员识别出不同克隆群体的起源及其相互关系。这一分析为理解癌前期病变的形成机制提供了新的见解,显示癌前组织可能起源于多个独立的正常细胞,这些细胞在癌前阶段共同参与了病变的形成与扩展。
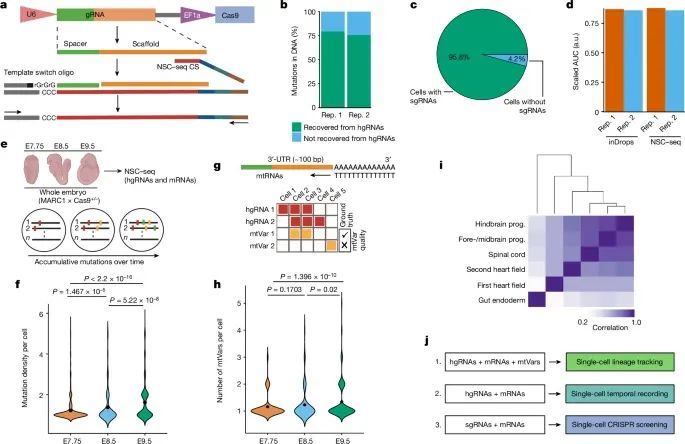
NSC-seq平台在单细胞水平上捕获和记录细胞事件(Credit: Nature)
NSC-seq平台的gRNA捕获示意图:图a展示了NSC-seq平台的gRNA捕获机制。gRNA的靶标区与NSC-seq的捕获序列(CS)退火,并通过细胞条形码和独特的分子标识符(UMI)进行标记,以实现下游文库的扩增。
Cas9诱导突变的恢复:图b比较了通过直接捕获hgRNA与从相同样本中DNA检测到的突变的恢复率,展示了NSC-seq在恢复Cas9诱导突变方面的高效性。
gRNA捕获效率:图c评估了在药物选择的细胞系中,NSC-seq平台对所有含有sgRNA细胞的gRNA捕获效率。
转录组捕获效率对比:图d比较了标准inDrops实验与NSC-seq实验之间的转录组捕获效率,显示NSC-seq在单细胞水平上的捕获效率具有显著优势。
小鼠胚胎中的应用:图e展示了在发育阶段标记的小鼠胚胎中进行的NSC-seq实验,揭示了随着时间推移,条形码区域的积累突变的增加。
线粒体突变变异(mtVar)的检测:图g描述了通过线粒体RNA(mtRNA)对体细胞mtVar的检测过程,并将其用于谱系追踪,与hgRNA突变作为基准相结合。
多模式应用:图j展示了NSC-seq平台在多模式上的应用,包括单细胞时间记录、谱系追踪以及CRISPR筛选的结合。
组织特异性细胞扩展的时间节点
研究发现,在小鼠胚胎发育过程中,不同组织的细胞分化在E7.75之后出现显著差异,标志着组织特异性的细胞分裂和分化过程在这一阶段开始。例如,神经嵴细胞在E8.5之后快速扩展,形成了诸如外周神经系统和色素细胞等多种组织。这一过程受到精细调控,揭示了器官大小和组织分布的关键调节机制。
非传统的细胞发育关系
通过对不同胚胎细胞类型的谱系追踪,研究揭示了一些非传统的细胞发育关系。例如,红细胞祖细胞1(EryPro1)与体节细胞共享共同的谱系祖先,而非通过经典的造血途径生成。这一发现颠覆了经典的造血系统发育观点,提示在胚胎发育后期,体节可能具备更广泛的发育潜能,从而生成不同功能的细胞类型。
癌前组织的多克隆起源
在人类大肠息肉的研究中,结合小鼠肠道肿瘤模型的分析,研究发现约15-30%的结肠癌前病变起源于多个正常细胞,这意味着这些癌前病变具有多克隆起源的特性。多克隆起源不仅挑战了传统的单克隆起源理论,而且指出癌前期病变并非单一细胞独立演化,而是多个细胞群体在微环境的共同影响下协同参与肿瘤的早期演化过程。
持续存在的祖细胞
研究还发现了一类与肠上皮相关的独特祖细胞群体,这些细胞从胚胎时期一直延续到成年期,称为持续存在的肠干细胞(pISCs)。这些细胞在肠道发育和维持过程中充当干/祖细胞,且其克隆贡献率显著高于典型的隐窝柱状细胞(CBCs)。pISCs的存在提示肠上皮的再生与维持过程不仅依赖于CBCs,还可能涉及在发育早期建立的更具持久性的细胞群体,这些细胞在肠道受损时可能发挥关键修复作用。
该研究开发的多模式时间记录平台为追踪哺乳动物发育及癌前组织的演化过程提供了强有力的工具。通过对胚胎发育和癌前组织的详细时间记录,研究揭示了不同组织和细胞类型的起源及其分化机制。这些发现对癌症研究具有重要的临床意义,尤其是在早期干预策略的制定方面。理解癌前期的多克隆起源特性,可能有助于设计针对多个克隆群体的早期干预策略,阻止多种细胞群体同时向恶性转化的进展。
癌前期病变的多克隆起源为癌症的早期预防提供了新的可能性。如果能够在癌前期阶段检测出多克隆扩展的特征,临床上可以采取多靶点干预策略,以提高癌症预防的有效性。此外,持续祖细胞的发现为理解器官的再生与维持提供了新的理论基础,未来可以进一步探索这些细胞在组织修复和疾病中的潜在作用,尤其是在肠道疾病和损伤后的再生中,它们可能成为新的治疗靶点。
在基础研究方面,本研究开发的NSC-seq平台具有广泛的应用前景。该平台不仅限于追踪胚胎发育和肿瘤发生,还可以用于研究其他生物学过程,例如免疫系统的发育和功能、神经系统的分化,以及干细胞在组织修复和再生中的作用。通过与其他单细胞组学技术相结合,NSC-seq有望帮助研究人员更全面地理解细胞在不同生理和病理状态下的行为及其动态变化。
参考文献
Islam M, Yang Y, Simmons AJ, Shah VM, Musale KP, Xu Y, Tasneem N, Chen Z, Trinh LT, Molina P, Ramirez-Solano MA, Sadien ID, Dou J, Rolong A, Chen K, Magnuson MA, Rathmell JC, Macara IG, Winton DJ, Liu Q, Zafar H, Kalhor R, Church GM, Shrubsole MJ, Coffey RJ, Lau KS. Temporal recording of mammalian development and precancer. Nature. 2024 Oct;634(8036):1187-1195. doi: 10.1038/s41586-024-07954-4. Epub 2024 Oct 30. PMID: 39478207.


