Circ Res 天津医科大学王晓虹/北京大学周菁团队合作揭示血流剪切力通过调控Kindlin-2液-液相分离影响血管稳定性
时间:2024-11-06 06:02:52 热度:37.1℃ 作者:网络
血管内皮细胞是循环血液与血管壁之间的重要屏障。内皮细胞的完整性破坏、血管通透性升高是许多血管疾病包括动脉粥样硬化、糖尿病视网膜病变等发生和发展的重要病理基础(Li et al., 2021)。血流剪切力在影响血管内皮细胞的功能和稳态以及血管疾病的发生发展方面起到了重要作用。已知层流剪切力可维持内皮屏障功能,而扰流剪切力可增强内皮通透性。然而,不同的血流剪切力调节血管内皮细胞屏障作用的潜在机制并不十分清楚。
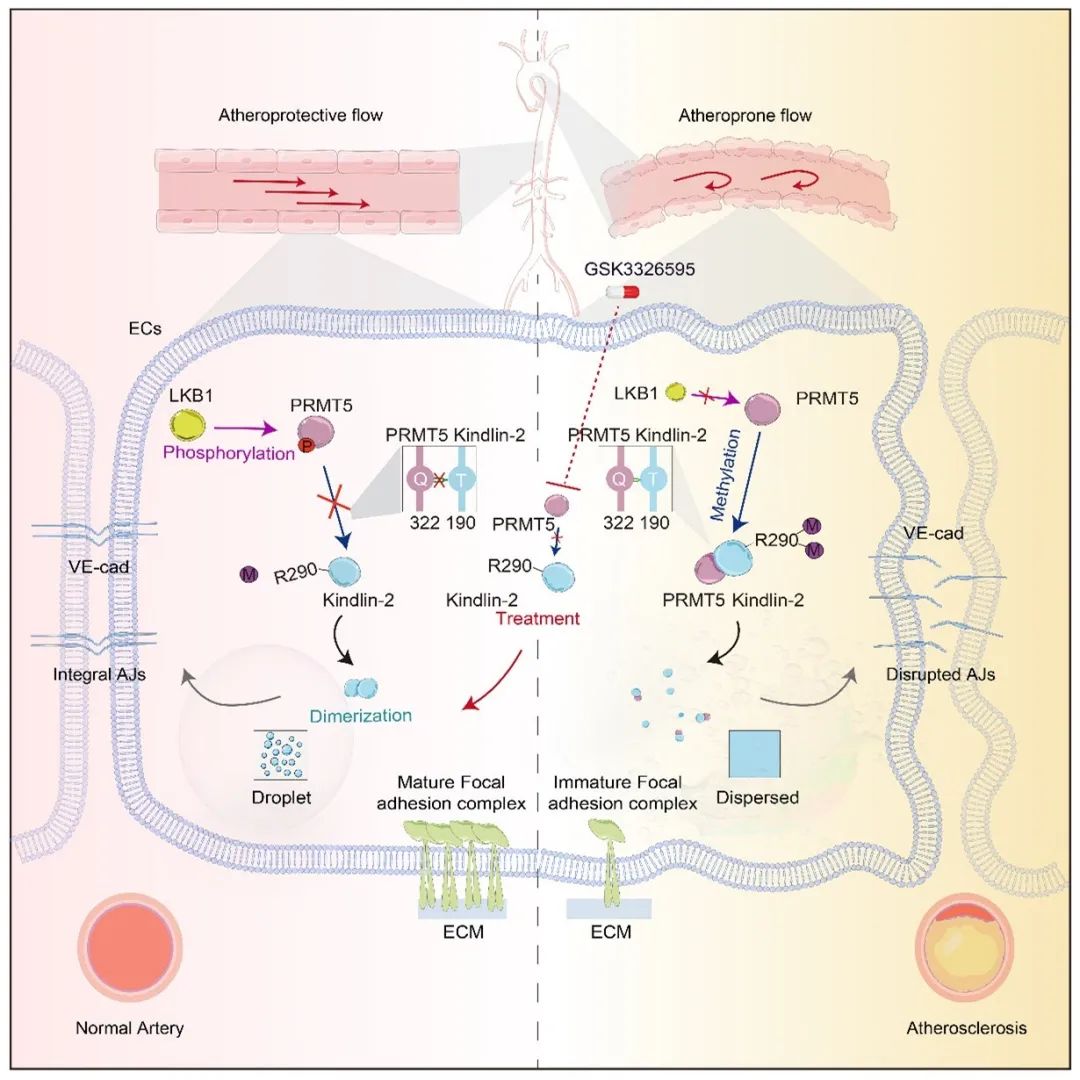
2024年11月4日,天津医科大学王晓虹教授课题组与北京大学医学部周菁教授课题组等合作在Circulation Research杂志上在线发表了题为“Kindlin-2 phase separation in response to flow controls vascular stability”的研究论文。该论文研究发现,内皮细胞中Kindlin-2蛋白会发生液-液相分离(LLPS),进而影响内皮细胞屏障作用和血管稳定性,而扰流剪切力可以通过PRMT5对Kindlin-2进行精氨酸甲基化修饰,影响Kindlin-2的相分离能力,进而损伤内皮屏障功能。该研究进一步发现,利用PRMT5的抑制剂可以减轻扰流引起的血管屏障破坏,缓解血管病变,提示抑制Kindlin-2精氨酸甲基化修饰可能是治疗血管疾病的潜在策略。

Kindlin-2作为黏着斑结构的核心组成成分之一,对于黏着斑的成熟、激活整合素、促进细胞-细胞外基质(ECM)粘附和细胞迁移方面发挥着重要作用。Kindlin-2在血管内皮细胞中高表达,在血管生成过程中通过促进整合素介导的内皮细胞粘附和迁移发挥重要作用(Pluskota et al., 2011)。此外,Kindlin-2被认为是内皮粘附连接的重要组成部分,并有助于稳定和维持内皮细胞屏障功能(Pluskota et al., 2017)。本研究发现,内皮细胞特异性敲除Kindlin-2会导致严重的血管屏障功能破坏和血管渗漏,此外,不同的血流剪切力导致Kindlin-2在内皮细胞中的定位不同。扰流剪切力减少了Kindlin-2在胞间接触附近的聚集,这可能导致Kindlin-2无法在胞间接触附近发挥其维持内皮细胞屏障功能的作用。
细胞内的蛋白质、核酸等大分子通过“液-液相分离”,动态组装成高度浓缩且具有类似液体性质的凝聚体微区,执行不同的生物学功能。近年来,“相分离”现象被证实参与了包括DNA的组装、损伤修复、RNA的转录、细胞的增殖、衰老、细胞信号转导、细胞周期调控、应激保护、神经突触形成等诸多生命活动,然而在血管病生理的功能调控中,相分离的作用此前并未受到广泛关注。2023年周菁课题组与王晓虹课题组、生物物理所的李伟课题组合作的两项工作分别报道了外基质硬度和血流剪切力通过LLPS调控血管平滑肌和内皮细胞中的盘状结构域受体1 (DDR1)相分离,进而影响血管病变的发生(Liu et al., 2023a; Liu et al., 2023b),提示了LLPS响应力学信号对血管功能起到重要调控作用。
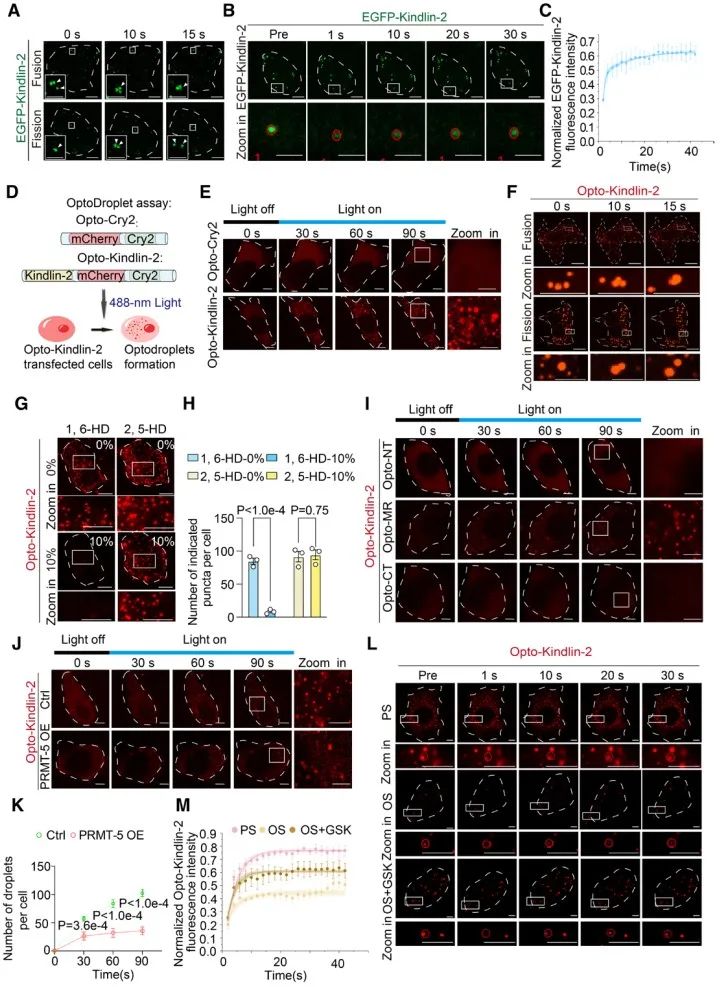
作为细胞黏着斑和内皮粘附连接的关键组成部分,Kindlin-2已被证明能够在体外和细胞中发生LLPS,这个过程对于黏着斑的形成和细胞的粘附功能起到了重要作用(Li et al., 2020)。然而,机械力(尤其是剪切力)是否调节Kindlin-2相分离此前仍不清楚。本研究发现,Kindlin-2在血管内皮细胞中可以以LLPS的形式形成凝聚体,而暴露于扰流的内皮细胞中的Kindlin-2蛋白LLPS能力显著降低。
为探究其机制,研究人员在HUVECs中施加层流(12±4 dyn/cm2)或扰流(0.5±4 dyn/cm2),并通过感染腺病毒过表达Kindlin-2,使用磁珠富集不同剪切力模式下与Kindlin-2结合的蛋白,并进行质谱分析,发现扰流剪切力可以显著促进蛋白质精氨酸甲基转移酶PRMT5与Kindlin-2的结合。蛋白质精氨酸甲基化是一种常见的蛋白质翻译后修饰,由蛋白质精氨酸甲基转移酶(PRMT)催化。蛋白的翻译后修饰对LLPS具有重要的调控作用,其中,精氨酸甲基化被证明是调控LLPS的重要修饰方式之一。精氨酸带正电荷的胍侧链介导了一系列重要的分子内和分子间相互作用,而精氨酸的甲基化则会减弱这种相互作用,进而抑制LLPS (Wu et al., 2021)。虽然蛋白质精氨酸甲基化在各种生物过程中的作用逐渐受到关注,然而其是否能受到机械力尤其是血流剪切力的调节,以及它的病理生理学意义如何,仍有待被探究。本研究发现内皮细胞暴露于扰流剪切力后,PRMT5与Kindlin-2的结合显著增加,这会进一步导致Kindlin-2的精氨酸对称二甲基化水平上升;同时,PRMT5在内皮细胞中对于Kindlin-2的LLPS起到了反向调节作用,即抑制PRMT5会促进Kindlin-2的相分离能力。
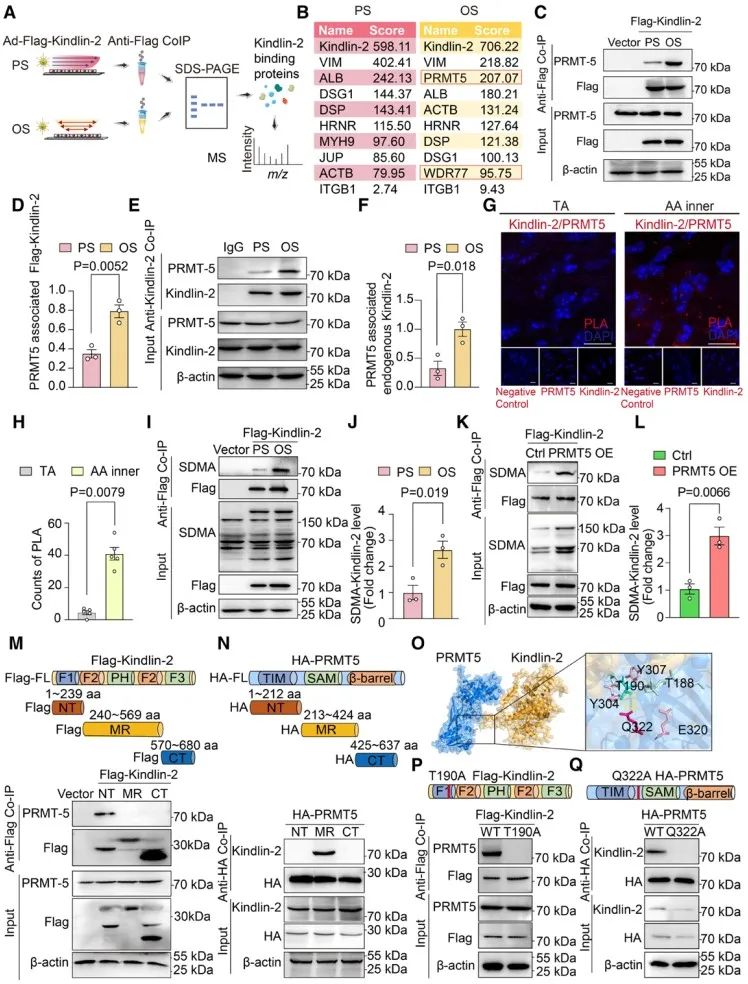
PRMT正在成为有吸引力的治疗靶点。目前,针对PRMT5和I型PRMT的抑制剂已进入针对血液恶性肿瘤或晚期实体瘤患者的临床实验阶段。其中GSK3326595是一种有效且高选择性的PRMT5抑制剂。研究人员发现给予小鼠进行GSK3326595口服给药,可以显著缓解扰流引起的血管渗漏。最后,以动脉粥样硬化小鼠为模型,作者发现GSK3326595可以显著缓解血管病变。
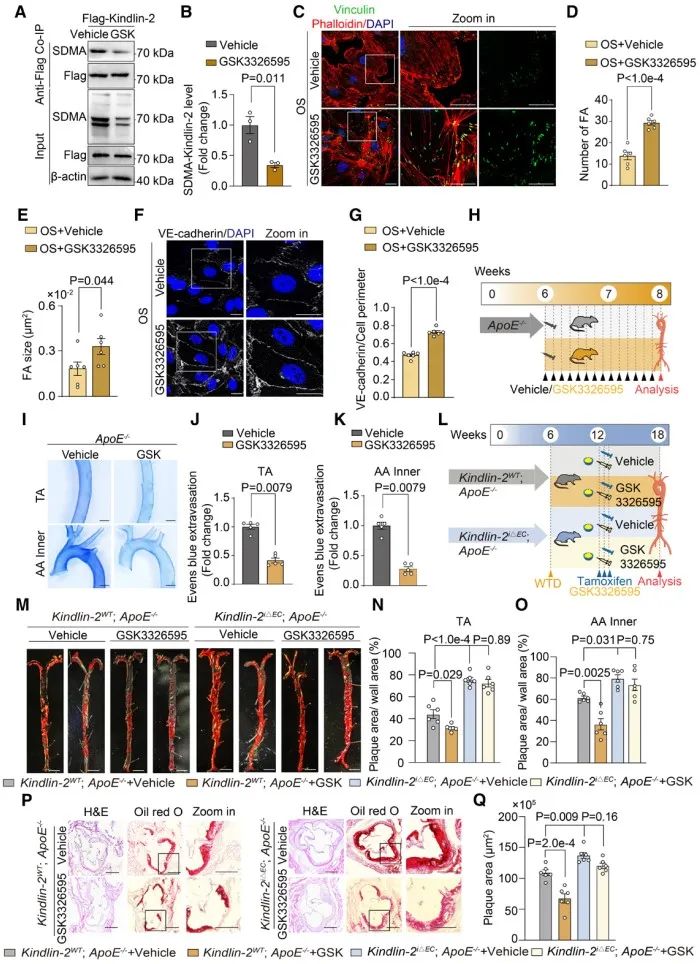
综上所述,该研究结果表明,扰流剪切力可以通过精氨酸甲基转移酶PRMT5对Kindlin-2进行精氨酸甲基化修饰,该过程抑制了Kindlin-2的LLPS,使得内皮细胞的黏着斑成熟和胞间连接完整性受损,最终损伤了内皮屏障功能。这些发现为蛋白质液相稳态调节血管功能提供了新机制,提示精氨酸甲基化修饰可能成为治疗血管疾病的新的干预靶点。
天津医科大学基础医学院王晓虹教授、北京大学基础医学院周菁教授为该论文的共同通讯作者;天津医科大学基础医学院博士生马妮娜为该论文的第一作者,天津医科大学艾玎教授、张恒教授,美国加州大学圣地亚哥分校方希教授、中科院交叉中心胡军浩研究员也对该研究提供了大力支持。该研究受到了天津医科大学卓越人才计划、国家自然科学基金、科技部重点研发计划等项目的支持。
参考文献:
Li, J., Xie, R., Jiang, F., Li, Y., Zhu, Y., Liu, Z., Liao, M., Liu, Y., Meng, X., Chen, S., et al. (2021). Tumor necrosis factor ligand-related molecule 1A maintains blood-retinal barrier via modulating SHP-1-Src-VE-cadherin signaling in diabetic retinopathy. FASEB J 35, e22008.
Liu, J., Wang, J., Liu, Y., Xie, S.A., Zhang, J., Zhao, C., Zhou, Y., Pang, W., Yao, W., Peng, Q., et al. (2023a). Liquid-Liquid Phase Separation of DDR1 Counteracts the Hippo Pathway to Orchestrate Arterial Stiffening. Circ Res 132, 87-105.
Liu, J., Zhao, C., Xiao, X., Li, A., Liu, Y., Zhao, J., Fan, L., Liang, Z., Pang, W., Yao, W., et al. (2023b). Endothelial discoidin domain receptor 1 senses flow to modulate YAP activation. Nat Commun 14, 6457.
Pluskota, E., Bledzka, K.M., Bialkowska, K., Szpak, D., Soloviev, D.A., Jones, S.V., Verbovetskiy, D., and Plow, E.F. (2017). Kindlin-2 interacts with endothelial adherens junctions to support vascular barrier integrity. J Physiol 595, 6443-6462.
Pluskota, E., Dowling, J.J., Gordon, N., Golden, J.A., Szpak, D., West, X.Z., Nestor, C., Ma, Y.Q., Bialkowska, K., Byzova, T., et al. (2011). The integrin coactivator kindlin-2 plays a critical role in angiogenesis in mice and zebrafish. Blood 117, 4978-4987.
Wu, Q., Schapira, M., Arrowsmith, C.H., and Barsyte-Lovejoy, D. (2021). Protein arginine methylation: from enigmatic functions to therapeutic targeting. Nat Rev Drug Discov 20, 509-530.
Li Y, Zhang T, Li H, Haibin Yang, Ruihong Lin, Kang Sun, Lei Wang, Jing Zhang, Zhiyi Wei, Yu C. Kindlin2-mediated phase separation underlies integrin adhesion formation. 2020.
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.124.324773


