Cell:揭示肺癌中的免疫新势力:成纤维网状细胞(FRCs)如何驱动抗肿瘤反应
时间:2024-11-21 17:00:32 热度:37.1℃ 作者:网络
引言
癌症是当今世界上最具挑战性的健康问题之一,尤其是肺癌,作为致死率最高的癌症类型,每年夺走数百万人的生命。随着研究人员对癌症的深入研究,人们逐渐认识到,癌症不仅仅是恶性细胞的过度增殖,更是一种与“宿主”复杂相互作用的生态系统。肿瘤微环境(Tumor Microenvironment, TME)是这个生态系统的核心,包含着癌细胞与免疫细胞、成纤维细胞及各种细胞因子之间错综复杂的交互作用。11月19日Cell最新的研究“Fibroblastic reticular cells generate protective intratumoral T cell environments in lung cancer”,发现成纤维网状细胞(Fibroblastic Reticular Cells, FRCs)在肿瘤微环境中扮演了一个关键的角色,它们不仅参与构建微环境,还积极影响免疫系统对肿瘤的反应。FRCs通过生成一个复杂的“免疫孤岛”,能够有效地激活和招募T细胞,这为抗击肿瘤带来了新的希望。

癌症,是一种由于体内细胞异常增殖引起的疾病。尽管癌细胞来源于自身,但它们依然可以成功躲避免疫系统的识别,逃脱其监视,进而失控生长。这种复杂的逃逸过程使得免疫系统在应对癌细胞时面临巨大挑战。而在过去十年间,研究者们开始关注肿瘤微环境(Tumor Microenvironment, TME)这一关键因素,尤其是其中的成纤维网状细胞(Fibroblastic Reticular Cells, FRCs),它们在增强和调节抗肿瘤免疫反应中起到了至关重要的作用。
FRCs是一种特殊类型的成纤维细胞,主要存在于次级淋巴器官中。它们通过构建复杂的微环境,帮助免疫细胞更好地迁移、存活并发挥功能。在非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)中,FRCs的存在不仅构建了一个由T细胞组成的网络,而且有效地促进了抗肿瘤免疫反应。理解这些机制对于我们深入把握肿瘤微环境中的调控路径,以及如何通过调节FRC来优化免疫治疗,具有重大意义。
肺癌中的FRCs:调控免疫微环境的主导力量
研究的核心发现是,FRCs通过分泌趋化因子CCL19和CCL21,在肿瘤内部形成了特殊的T细胞环境(T cell Environments, TEs),包括三级淋巴样结构(Tertiary Lymphoid Structures, TLSs)和T细胞轨迹(T cell tracks)。这些FRC主导的“免疫孤岛”能够激活并吸引T细胞,从而强化对肿瘤细胞的免疫监视和攻击。这一发现揭示了肿瘤微环境中局部免疫反应的复杂性和特异性,强调了肿瘤微环境在抗肿瘤反应中的中心作用。
研究团队通过免疫组化分析对7例NSCLC患者的肿瘤样本进行了深入研究,发现肿瘤中央区域(Central Margin, CM)与靠近胸膜的边缘区域(Subpleural Margin, SM)内免疫细胞的分布存在显著差异。在CM区域,T细胞和B细胞的密集程度更高,分别为每平方毫米58个和24个细胞(p<0.05),形成了复杂的免疫细胞聚集体。这种聚集被认为是强效免疫反应的关键标志,有助于对肿瘤细胞进行有效的监控和清除。同时,在CM区域,FRC分泌的CCL19和CCL21 mRNA表达水平显著高于SM区域(p<0.01),这进一步证实了FRC在调控肿瘤内免疫反应中的重要作用。
此外,通过对多个患者样本的分析,研究人员发现TLS的数量和密集程度与患者的生存期呈显著正相关。拥有更多TLS的患者,整体生存率显著提高,这表明FRC在形成TLS并促进有效抗肿瘤免疫反应中的作用不可忽视。这些数据不仅揭示了肿瘤微环境中的空间异质性,还为我们提供了通过调控FRC功能来优化肿瘤免疫治疗的新视角。
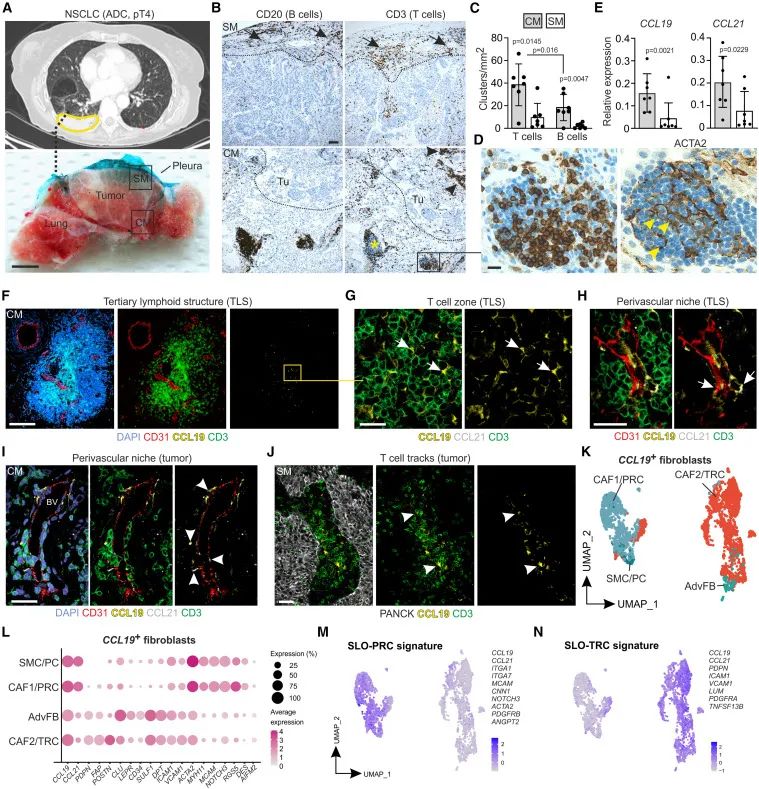
CCL19表达的纤维细胞网状细胞在NSCLC肿瘤微环境中的空间分布和功能特征,尤其是在中央和边缘区域之间的免疫细胞分布及其与FRC的关系(Credit: Cell)
胸部计算机断层扫描: (A) 显示了患者NSCLC2的胸部CT扫描,肿瘤位于右下肺叶,用黄色线标示肿瘤位置。虚线标示了横截面的近似位置,并标记了中央区域(CM)和靠近胸膜的边缘区域(SM)。
免疫组化染色: (B) 展示了来自SM和CM区域的NSCLC切片的免疫组化染色结果。虚线标明了肿瘤巢(Tu)与CM/SM区域之间的边界,箭头显示了T细胞和B细胞的位置,星号标示了三级淋巴样结构(TLS),箭头头则指示了肿瘤内的T细胞轨迹。
T细胞和B细胞的聚集量化: (C) 对SM和CM区域中的T细胞和B细胞聚集进行了量化,显示了两个区域在免疫细胞密度方面的显著差异(n = 7)。
TLS中的T细胞: (D) 展示了中央区域TLS中的T细胞,右侧图像显示了同一区域连续切片,用针对ACTA2的抗体染色。
趋化因子表达的比较: (E) 展示了从CM和SM区域分离的成纤维细胞中CCL19和CCL21 mRNA的相对表达,通过定量实时PCR进行测定(n=7)。
TLS的共聚焦显微镜结果: (F) 共聚焦显微镜显示了NSCLC中央区域的TLS,框中区域进一步展示了TLS内的T细胞区。
T细胞区最大强度投影: (G) 共聚焦显微镜显示了TLS中T细胞区的最大强度投影,箭头指示了CCL19+细胞与T细胞的相互作用。
TLS中的血管周围区域: (H) 展示了TLS中的血管周围区域,箭头指示了CCL19+和CCL21+细胞。
CM中血管周围的特定相互作用: (I) 展示了CM中的血管周围区域,箭头指示了CCL19+和CCL21+细胞与CD3+ T细胞的相互作用。
SM中的T细胞轨迹: (J) 显示了SM中的T细胞轨迹,箭头指示了CCL19+细胞与T细胞的相互作用。
UMAP图显示FRC亚群的分布: (K) 展示了来自CM、SM(CAF1/PRC和CAF2/TRC)和未受影响肺组织(SMC/PC和AdvFB)的CCL19表达的成纤维细胞的UMAP表示,共分析了来自5例NSCLC患者的3004个成纤维细胞。
基因表达: (L) 展示了各亚群中一般成纤维细胞和FRC基因的平均表达,点的大小表示细胞的比例。
PRC和TRC的基因表达签名特征: (M 和 N) UMAP展示了从次级淋巴器官中获得的PRC和TRC的基因表达特征。
趋化因子与免疫调控的具体机制
CCL19和CCL21的高表达是FRC在肿瘤微环境中发挥功能的关键。它们通过引导T细胞在特定微环境中聚集,从而增强抗肿瘤的免疫效应。研究表明,CCL19高表达的FRC不仅在TLS中活跃,还在肿瘤内部的轨迹中支持T细胞的活化与迁移。这些“轨迹”类似于通道,使得T细胞可以有效深入肿瘤组织,找到并攻击癌细胞,进而发挥其核心作用。
通过高分辨率共聚焦显微镜,研究者们发现FRC与T细胞之间存在直接的细胞膜接触,这种接触对于T细胞的活化尤为重要。在TLS中,CCL19+ FRC细胞与CD3+ T细胞形成紧密的相互作用区域,这被认为能够有效增强T细胞的增殖能力和效应功能。定量分析表明,TLS中FRC的CCL19和CCL21的表达水平与T细胞的聚集数量呈显著正相关(r=0.85,p<0.01)。此外,研究还揭示了这些趋化因子在不同区域的表达变化与肿瘤细胞异质性之间的联系,为我们理解肿瘤内部复杂的免疫调控机制提供了新的视角。
FRC的起源与分化机制
为了揭示FRC在肿瘤微环境中的起源,研究团队应用单细胞转录组分析(Single-cell Transcriptomics)对人类和小鼠的肺癌样本进行了研究。结果显示,肿瘤中的FRC主要来源于两类前体细胞:围绕血管的前体细胞(Perivascular Progenitors)和来自外层组织的附壁前体细胞(Adventitial Progenitors)。这些前体细胞通过分化,形成了PRC(Perivascular Reticular Cells)和TRC(T Cell Zone Reticular Cells)两种亚型,它们分别在血管周围和肿瘤内部的T细胞区域中发挥作用。
通过细胞命运追踪(Fate-mapping)分析,研究人员发现FRC的分化过程与肿瘤微环境的免疫重塑密切相关。当缺乏FRC前体细胞时,小鼠肿瘤模型中的CD8+ T细胞活性显著降低,导致肿瘤体积增大约30%(p<0.05)。相反,使用冠状病毒载体(如mCOV-Flt3l-gp33)激活免疫反应后,肿瘤内TLS的形成显著增加,肿瘤体积减少约25%(p<0.01)。这些结果进一步证明了FRC在抗肿瘤免疫中的关键作用。
在进一步研究中,研究团队对FRC在不同肿瘤类型中的作用进行了比较,结果表明FRC的起源和分化途径在不同类型的实体瘤中存在显著差异。例如,在乳腺癌和黑色素瘤中,FRC的分化涉及更多的前体细胞亚型,并且它们对不同趋化因子的响应也有所不同。这些结果强调了在不同肿瘤背景下对FRC的深入研究对于理解其独特功能的必要性。
实验数据支持FRC与T细胞的相互作用
通过高分辨率共聚焦显微镜观察到FRC与T细胞之间存在直接的物理接触,特别是在肿瘤中央区域,CD3+ T细胞聚集在表达肌动蛋白α2(ACTA2)的FRC周围,且FRC中的CCL19和CCL21的高表达进一步增强了这种相互作用。
流式细胞术的结果进一步证实,在CCL19和CCL21高表达区域,CD8+ T细胞的增殖水平显著提高,Ki-67阳性细胞比例达到65%,而在低表达区域仅为30%(p<0.01)。此外,这些区域的T细胞中干扰素γ(IFN-γ)水平显著增加,表明它们处于高度活化状态。研究还表明,FRC与T细胞之间的相互作用显著增强了T细胞的代谢活性,包括糖酵解和氧化磷酸化的上调,这对于维持T细胞的持久性和效应功能至关重要。
在小鼠模型中,实时成像技术显示FRC与T细胞之间的相互作用是动态且高度同步的。当FRC在肿瘤生长区域重新分布时,CD8+ T细胞的杀伤活性显著增加,伴随着肿瘤细胞凋亡率的提高。这些发现进一步强调了FRC在调节肿瘤免疫反应中的中心地位,以及它们在空间和时间上精准调控T细胞功能的复杂机制。
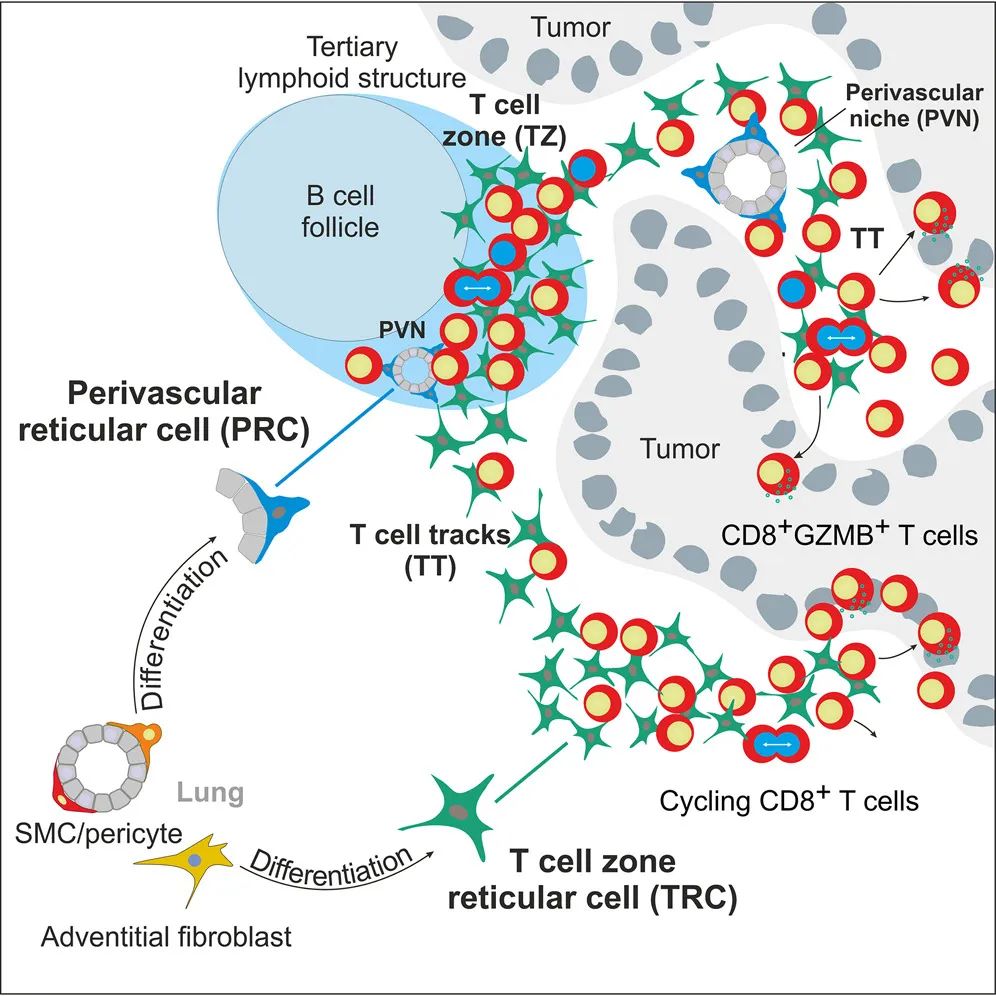
模式图(Credit: Cell)
FRC在肿瘤免疫治疗中的潜在应用
该研究的另一个重要启示是FRC在肿瘤免疫治疗中的潜在应用。近年来,免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs)已被广泛应用于癌症治疗,但并非所有患者都能受益。该研究表明,FRC生成的肿瘤内T细胞环境与免疫治疗的有效性密切相关。肿瘤中的TLS与B细胞和T细胞的协同作用显著提高了患者对免疫治疗的响应率。TLS密集的患者,其对免疫治疗的响应率达到70%,而TLS较少的患者仅为30%(p<0.01)。
在小鼠模型中,消除肿瘤内的FRC细胞显著降低了CD8+ T细胞的抗肿瘤活性,导致肿瘤体积增大(p<0.05)。相反,使用冠状病毒载体激活抗肿瘤免疫反应,可显著增加肿瘤内CD8+ T细胞的数量和活性,并促进TLS的形成(肿瘤内TLS增加约40%,p<0.01)。这些数据表明,通过靶向调节FRC及其生成的趋化因子,可能为增强肿瘤免疫治疗提供新的策略。
研究者还尝试了在临床前模型中结合使用ICIs与FRC靶向疗法,结果显示这种组合治疗显著提高了免疫反应的强度和持久性,相较于单独使用ICIs的治疗效果更好。在接受组合治疗的小鼠中,肿瘤体积减少了约55%,而单用ICIs的治疗组仅减少约30%(p<0.01)。此外,这种联合疗法还显示出延长无进展生存期(Progression-Free Survival, PFS)的潜力,这对于提高患者的长期预后意义重大。
成纤维网状细胞(FRCs)在肿瘤微环境中发挥着至关重要的作用。它们通过生成特定的免疫微环境,吸引并激活T细胞,从而增强宿主对肿瘤的免疫反应。通过调控FRC及其分泌的趋化因子CCL19和CCL21,可能为包括肺癌在内的多种实体瘤的治疗带来新的突破。
这种基于调控微环境的治疗策略可与现有的免疫检查点抑制剂联合应用,显著提高患者的生存率和生活质量。未来的研究可进一步着眼于如何通过精确调控肿瘤内FRC及其生成的T细胞轨迹来增强抗肿瘤免疫反应,尤其是在对现有疗法不响应的患者中,这可能会成为一种极具前景的治疗途径。
此外,还可以进一步探索FRC与其他免疫细胞之间的相互作用,以及通过基因编辑和药物干预精确调控FRC功能的手段。例如,利用CRISPR-Cas9技术靶向调节FRC中特定趋化因子的表达,可能有助于进一步增强其在抗肿瘤反应中的功能。这些创新干预策略有望突破当前免疫治疗的瓶颈,为更多癌症患者带来福音。
癌症的免疫微环境是一个复杂且动态的生态系统,而FRC在这一生态系统中起到了“导航者”和“支持者”的作用。随着我们对肿瘤微环境理解的不断深入,基于FRC的靶向治疗策略有望进入临床实践,帮助患者赢得与癌症抗争的胜利。随着多学科交叉研究的推进,我们有理由相信,对FRC及其免疫调控网络的深入解析,将为癌症免疫治疗带来新的希望和突破。
参考文献
https://www.cell.com/cell/fulltext/S0092-8674(24)01259-5


