JCO:T急淋白血病诱导化疗失败儿童/年轻患者的基因组特征
时间:2023-07-01 07:13:46 热度:37.1℃ 作者:网络
急性T淋巴细胞母细胞白血病(T-ALL)是一种恶性血液病,占儿童期ALL的10~15%。对于ALL患者来说,诱导化疗失败(IF)与心血管不良有关。而这在T- ALL中比B-ALL中更常见,约10%的T-ALL患者生存经历IF。MRD比骨髓形态学能更好地反映IF。在早期临床试验中,经历IF的T-ALL患者的10年比率仅为19%,近年来提升至50%,但仍反映巨大的未满足临床需求。
尽管在 T-ALL 中比 B-ALL 中高发,但对于 T-ALL IF 的预测结果却截然不同,因为在既往临床试验中,出现 IF 的患者便被从治疗组中移除,他们另外,尽管已有一些研究揭示了B-ALL的IF的因果驱动因素,但T-ALL研究相对较少,无论是IF还是不良心血管,这也限制了精细化的治疗分层。
近日,David O'Connor 等人在 JCO 发表题为《 儿童期和青年T细胞急性淋巴细胞白血病诱导失败的临床基因组景观》的 论文,分析了两项横跨15年的ALL大型多国随机试验UKALL2003和UKALL2011的数据,结合临床特征和基因组学特征分析T-ALL IF的影响因素。

UKALL2003和UKALL2011试验共纳入了5876名患者,年龄范围为1~24岁。近六千名患者中711名(12.1%)为T-ALL,其中71名(10.3%)经历了IF。最终纳入生存分析的70名患者,分别有35名来自2003和2011试验(图1)。用于比较的未经历IF的患者来自COGAALL0434试验,因为该试验有丰富、成型的临床表型和基因组学数据。IF定义为感应缓解化疗后的微小残留病灶(MRD)大于等于5%,或者形态学上骨髓象M2或者M3级(若MRD结果不可及)。
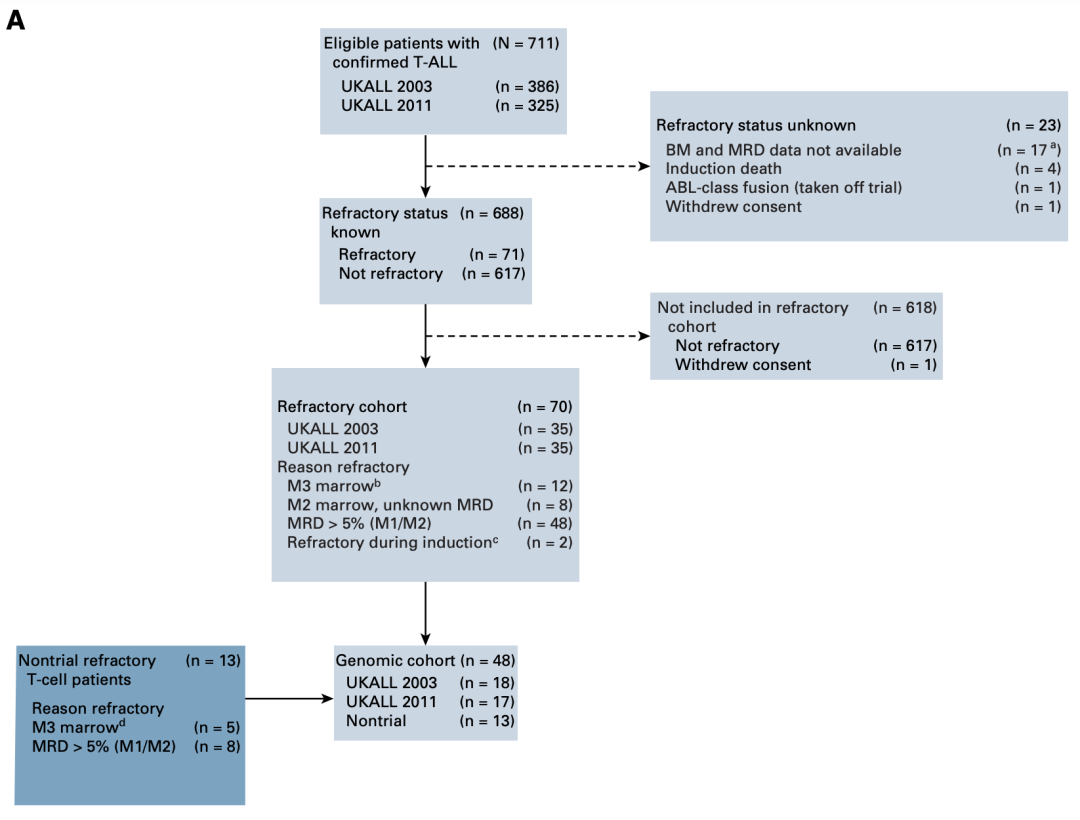
图1. 软骨细胞
值得注意的是2,相比于对初次诱导动作所示的致命性,经历IF的加权的梯度下降,具有4倍的镰刀进展风险和6倍的死亡风险[5年无事件生存率(5y) EFS),84.0% v 47.9%,HR, 4.14;5年总生存率(5y OS),90.2% v 52.1%,HR 6.38,差异均值具有统计学意义]。多参数分析显示,发病年龄与IF发生率成正相关,小于10岁、10-16岁和大于16岁的患者中,IF发生率分别为5.6%、12.9%和20%。
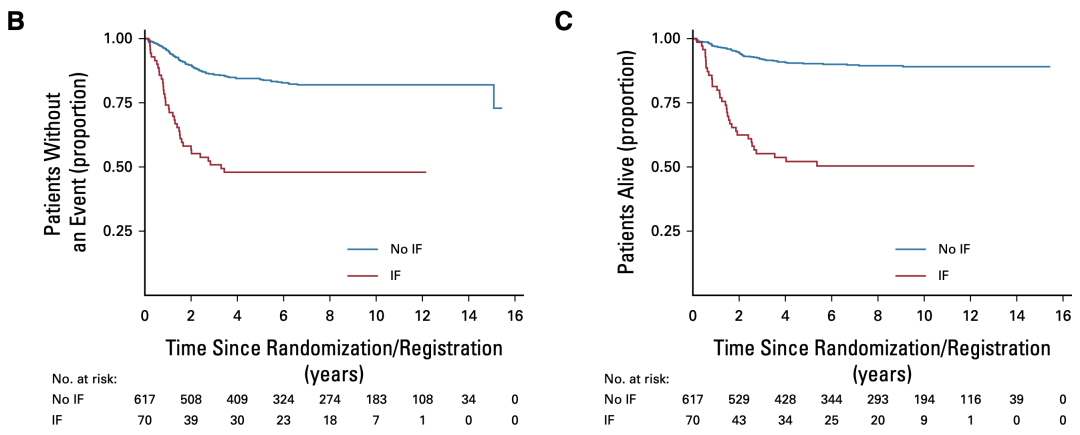
图2. 生存曲线,诱导化疗失败患者分布更差
发生IF后,患者从临床试验中出组随后,后续治疗的选择根据主治医生的选择进行。值得注意的是,71名最初感应缓解失败的患者中,只有1名从未达到缓解,其他患者对后续治疗有一定反应。后续治疗的方案方面,早年主要是继续打标准化疗方案(26/35),近年来以含奈拉滨的方案(24/35)为主;诱导后,一些患者进行造血干细胞移植(HSCT)巩固。初次引导失败后的治疗和生存情况如图3所示。
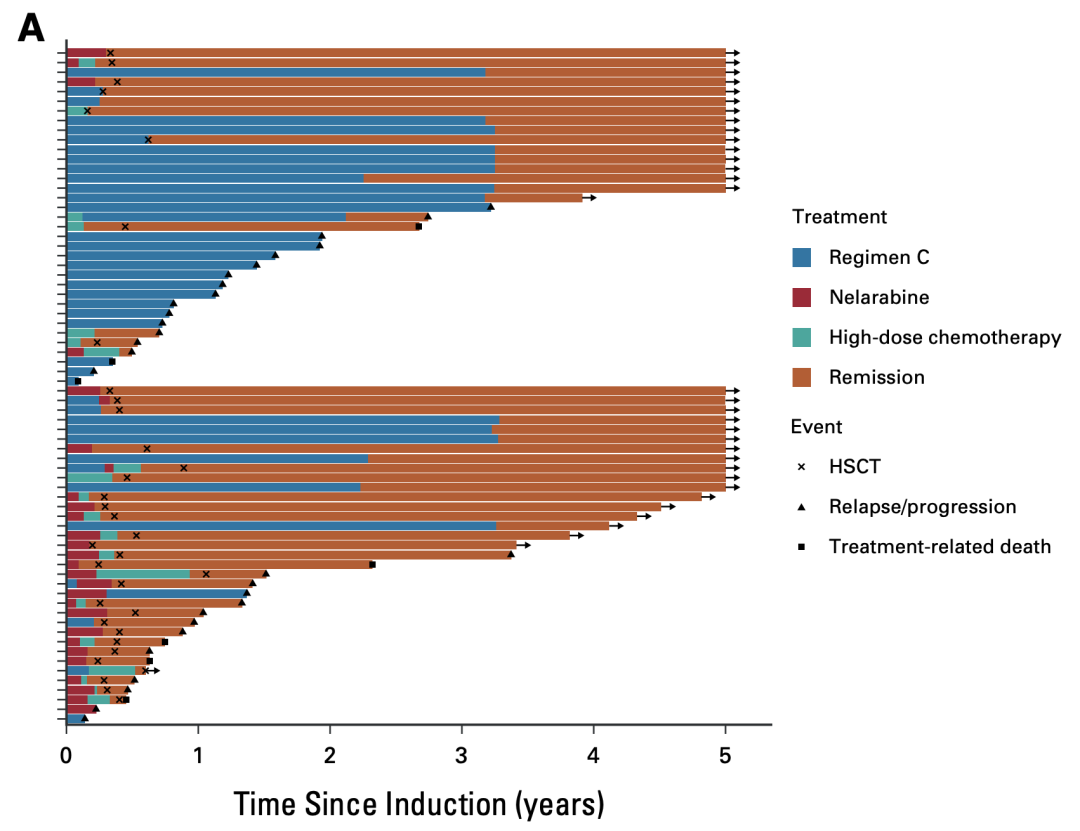
图3. 泳道图,展示IF后的治疗和生存情况
令人惊讶的是,生存分析显示加入奈拉滨的化疗方案和增加的 HSCT 并没有带来生存困难(图4);对于 HSCT 未能改善的情况,作者分析可能与接受 HSCT 患者 MRD 更高另外,值得注意的是,如果患者病情极差,中位总生存期仅3.9个月。
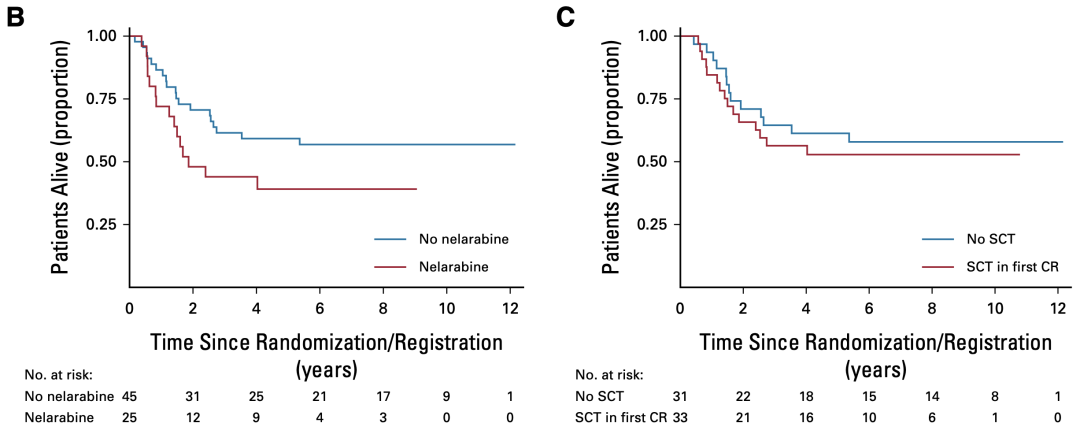
图4. 生存分析,对于 IF 患者,奈拉滨治疗与 HSCT 无力重组
对其他可能影响基底的临床指标进行分析,发现最后影响患者基底的因素是巩固治疗结束(EOC)时的MRD水平。如图5所示,EOC时MRD水平≥1%的患者,相比于MRD水平风险低于1%的患者,死亡高4倍(5y OS,14.3% v 68.5%;HR,4.10;P<.0071)。年龄、白细胞计数、诱导化疗结束时(EOI)的骨髓相或者MRD情况,或者纳入的试验(2003 v 2011)都不影响患者基线。
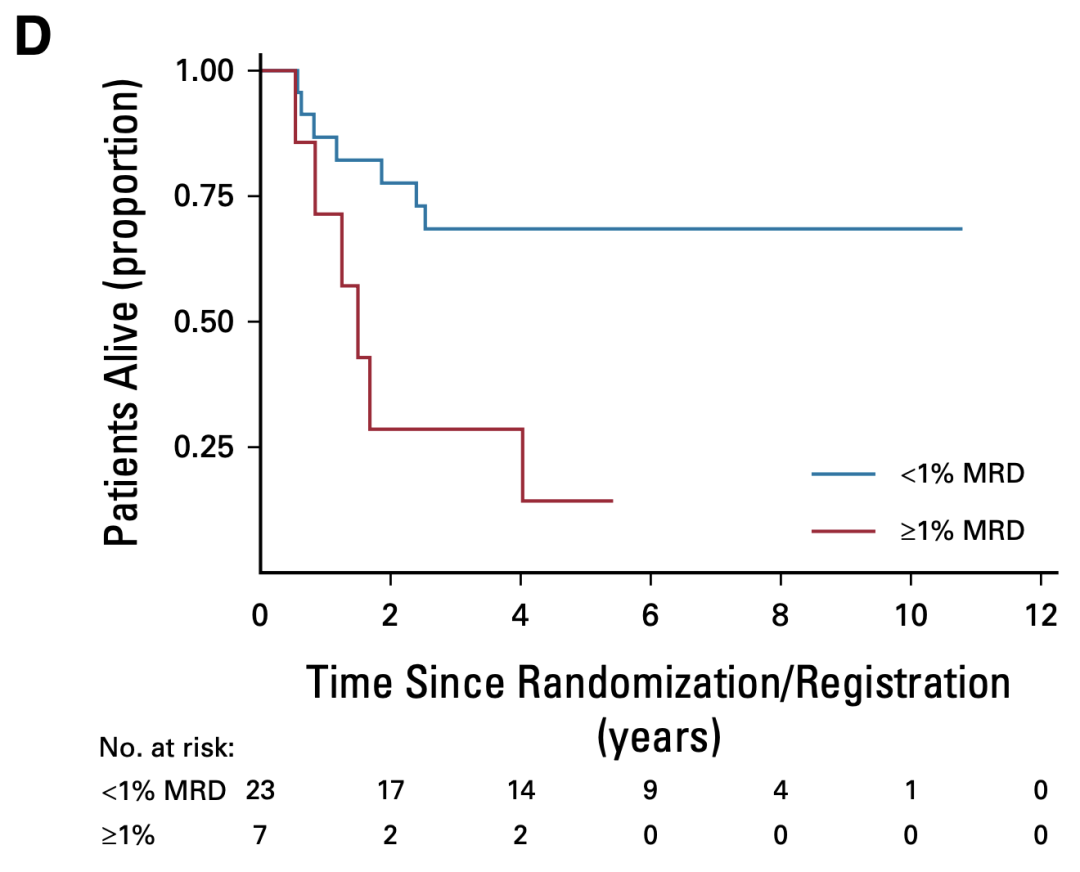
图5. 生存曲线,IF患者中,EOC的高MRD水平与较差读数有关
对影响膀胱的分子和关联表型进行分析。首先,通过流式细胞术将病灶分为ETP(早期胸腺前体)型和非ETP型。ETP型是一种泌尿性、干性更强的符合既往认知,ETP表型位于IF患者群中富集(图6)。
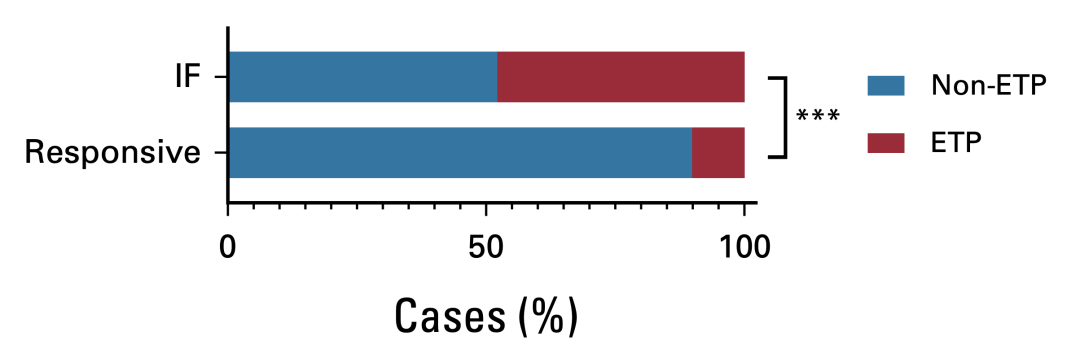
图6. ETP表型在IF人群中富集
其次,通过全基因组追溯和测序组测序分析线索,发现了一些驱动基因,如TLX3、TAL1、LMO1和HOXA等(图7),并根据这些驱动基因将T-ALL分为不同的亚型。
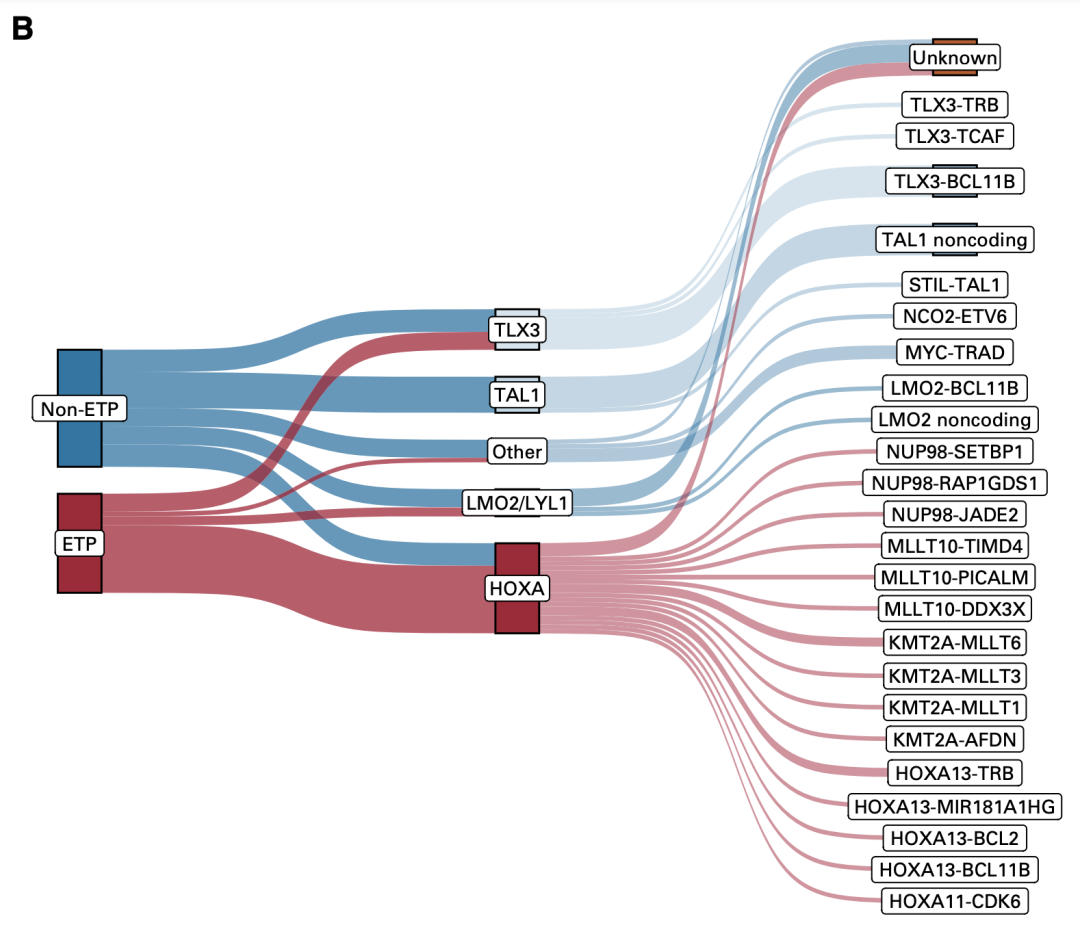
图7. 根据驱动基因将T-ALL分为不同亚型
其中,HOXA亚型在IF患者中高度富集,并且75%的HOXA亚型归入ETP表型;而TAL1亚型中,虽然总体上对呼吸道反应的患者有IF的患者,但若根据不同类型分析,发现发生于非编码区的突变与IF有关,高达87.5%的病灶的突变位于非编码区(图8)。
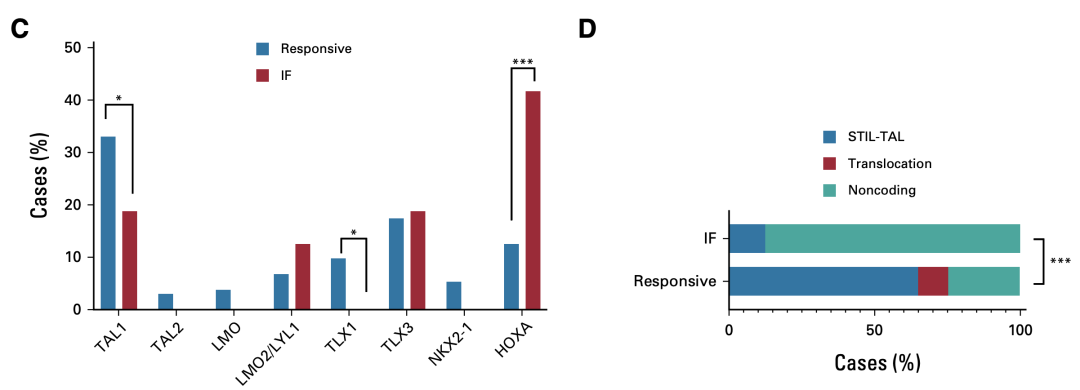
图8. HOXA突变和TAL1的非编码区突变在IF病灶中富集
分析基因亚型和淋巴结的发现,TAL1亚型的患者的不良肺癌,不到六分之一的患者关系能长期生存。再加上既往已知的不良淋巴结因素——MYC和RAS的免疫的突变,对于IF的T-ALL,病灶若携带TAL1/MYC/RAS任何一种特征(TMR 病灶),则患者颈部差,低于四分之一的患者有长期生存(图9)。
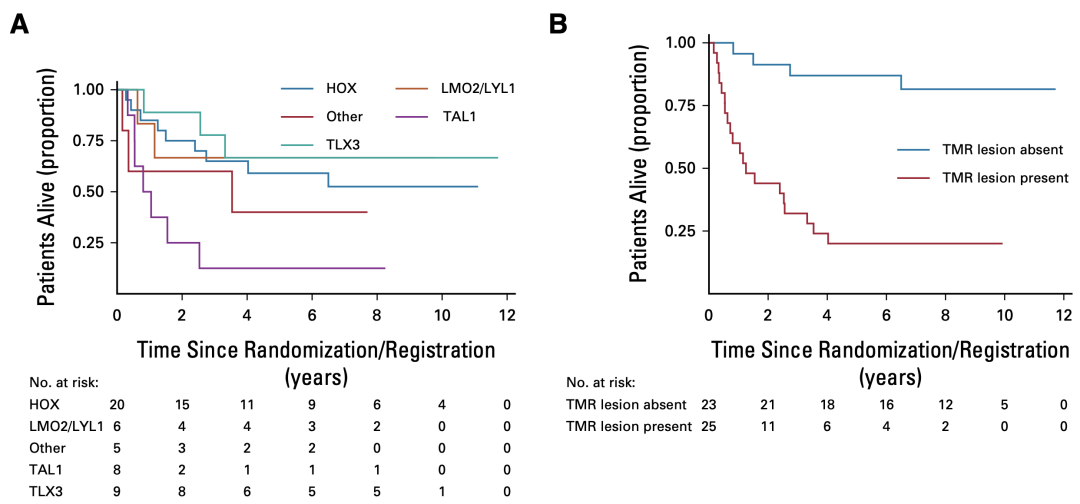
图 9. TAL1亚型和TMR病灶的漂移
本研究较重要的发现是:对于诱导诱导失败的儿童和青年成人T-ALL患者,1)奈拉滨和HSCT似乎没有改善布局;2)TMR病灶(TAL1非编码区突变、MYC和RAS指纹)突变)提示着间歇性的突变,应考虑将这些患者纳入临床试验,但由于T-ALL基因改变的巨大异质性,抑制驱动基因的突变疗法可能难以实施,因此本研究的结果也支持将研发重点放在抑制T细胞表面标记的CAR-T治疗的开发,如CD7等;3)TAL1的非编码区突变发现与不良相关的肝脏,这是首次发现增强子区的改变能力影响位置,具体机制尚待瞄准。
相比近10年来B-ALL治疗手段的极其丰富,T-ALL的治疗研发进展甚少,我们也期待新的疗法早日上市造福患者。
DOI:10.1200/JCO.22.02734


