【论著】| 非肌层浸润性膀胱癌行初次经尿道膀胱肿瘤电切术的术后复发危险因素分析
时间:2023-07-10 15:20:49 热度:37.1℃ 作者:网络
[摘要] 背景与目的:非肌层浸润性膀胱癌(non-muscle invasive bladder cancer,NMIBC)患者行经尿道膀胱肿瘤电切术(transurethral rep of bladder cancer,TURBT)的术后复发率较高,分析NMIBC患者行初次TURBT术后复发危险因素的相关研究较少。本研究旨在分析NMIBC患者行初次TURBT的术后复发危险因素,有助于筛选复发高危人群,预防性采取相应的干预措施。方法:选取2015年12月—2020年5月在电子科技大学附属肿瘤医院行初次TURBT治疗的NMIBC患者197例,随访24~77个月,根据是否复发分为复发组(48例)和非复发组(149例)。对两组临床资料进行单因素分析,将单因素分析差异有统计学意义的指标纳入多因素logistic回归分析,筛选TURBT术后复发的可能危险因素。结果:单因素分析显示,未复发组初治时有肉眼血尿、二次电切、肿瘤T分期为T1期、肿瘤分级为高级别、肿瘤多发及未行即刻膀胱内灌注化疗的占比低于复发组,差异有统计学意义(P<0.05)。两组的性别、年龄、肿瘤家族史、吸烟史、肿瘤大小及后续膀胱内灌注化疗对比差异无统计学意义(P>0.05)。两组中性粒细胞/淋巴细胞、中性粒细胞×血红蛋白/淋巴细胞的受试者工作特征(receiver operating characteristic,ROC)曲线显示差异无统计学意义(P>0.05)。多因素logistic回归分析显示,肿瘤T分期为T1期、肿瘤分级为高级别、肿瘤多发及未行即刻膀胱内灌注化疗为NMIBC患者初次TURBT术后复发的独立危险因素(P<0.05,OR>1)。结论:NMIBC患者行初次TURBT术后复发与肿瘤分期、肿瘤分级、肿瘤数目、是否行即刻膀胱内灌注化疗密切相关,临床上可以采取对应的干预措施,降低患者术后的复发率。
2022年膀胱癌预计占新发肿瘤的4%,占癌症死亡的3%[1]。膀胱癌以非肌层浸润性膀胱癌(non-muscle invasive bladder cancer,NMIBC)为主,约占75%[2]。NMIBC患者手术治疗以经尿道膀胱肿瘤电切术(transurethral rep of bladder tumor,TURBT)为主,低危者复发概率低,行即刻膀胱内灌注化疗即可,而中高危者推荐行后续膀胱内灌注化疗[3]。欧洲泌尿外科学会指南[4]指出,中危者推荐行1年全剂量膀胱内卡介苗灌注治疗或不超过1年的膀胱灌注化疗,高危者推荐行1~3年全剂量膀胱内卡介苗灌注治疗。相关研究[5]显示,NMIBC患者TURBT术后复发率较高,5年内约有60%的患者复发。本研究旨在分析NMIBC患者行初次TURBT治疗后复发的危险因素,有助于筛选复发高危人群,预防性采取相应的干预措施。
1 资料和方法
1.1 临床资料
选择2015年12月—2020年5月在电子科技大学附属肿瘤医院行初次TURBT治疗并经病理学检查证实为NMIBC的197例患者,其中男性148例,女性49例,年龄63(54~71)岁。纳入标准:① 病理学检查证实为NMIBC且无远处转移;② 初次行TURBT治疗;③ 随访时间≥2年。排除标准:① 复发前行根治性膀胱切除术;② 合并其他肿瘤病史;③ 临床资料不完整;④ 一般情况差,合并严重心肺及肝肾疾病者。
1.2 方法
所有患者行初次TURBT治疗,术后14例因膀胱穿孔或膀胱出血量大未行即刻膀胱内灌注化疗,其余183例术后均行即刻膀胱灌注化疗,所用药物包括表柔比星、吡柔比星、吉西他滨。对于中高危患者推荐行后续膀胱灌注治疗,所用药物包括表柔比星、吡柔比星、吉西他滨或卡介苗等。所有患者至少随访2年,定期复查,术后第1年每3个月复查1次,术后第2年每6个月复查1次,术后第3年起每12个月复查1次,出现血尿等症状时及时复查。膀胱镜发现膀胱内可疑病灶且经病理学检查证实为尿路上皮癌,即定义为复发,并收集相关临床资料。
1.3 观察指标
根据是否复发分为复发组和未复发组,比较两组的性别、年龄、肿瘤家族史、吸烟史、初治肉眼血尿、中性粒细胞/淋巴细胞、二次电切、病理学分期、病理学分级、肿瘤数目及即刻膀胱内灌注化疗等指标,分析NMIBC患者行初次TURBT治疗后复发的危险因素。
1.4 统计学处理
采用SPSS 26.0统计软件处理数据,计数资料用n(%)表示,行χ2检验,当理论频数小于5时,选择连续校正χ2检验或Fisher精确检验;计量资料满足正态分布用x±s表示,行t检验,计量资料不满足正态分布用M(P25~P75)表示。P<0.05为差异有统计学意义。将单因素分析差异有统计学意义的指标纳入多因素logistic回归分析。
2 结 果
2.1 复发情况
随访24~77个月,197例行初次TURBT治疗的NMIBC患者中,48例复发,占比24.37%。
2.2 单因素分析
未复发组患者初治时有肉眼血尿、二次电切、肿瘤T分期为T1期、肿瘤分级为高级别、肿瘤多发及未行即刻膀胱内灌注化疗的占比低于复发组,差异有统计学意义(P<0.05);两组的性别、年龄、肿瘤家族史、吸烟史、肿瘤大小及后续膀胱内灌注化疗对比差异无统计学意义(P>0.05)。两组中性粒细胞/淋巴细胞、中性粒细胞×血红蛋白/淋巴细胞的受试者工作特征(receiver operating characteristic,ROC)曲线显示差异无统计学意义(P>0.05,表1)。
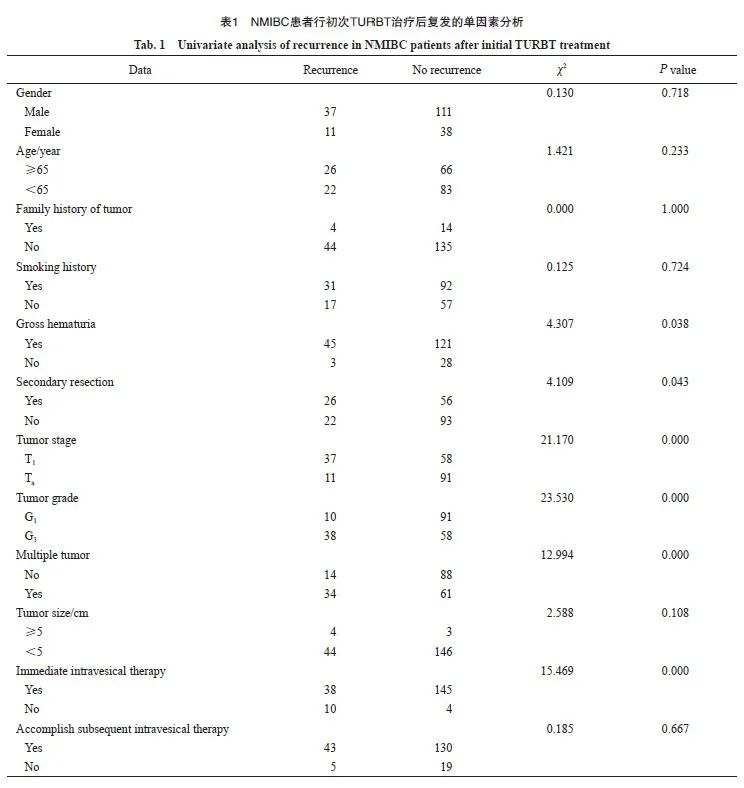
2.3 多因素logistic回归分析
多因素logistic回归分析显示,肿瘤T分期为T1期、肿瘤级别为高级别、肿瘤多发及未行即刻膀胱内灌注化疗为NMIBC患者行初次TURBT术后复发的独立危险因素(表2)。
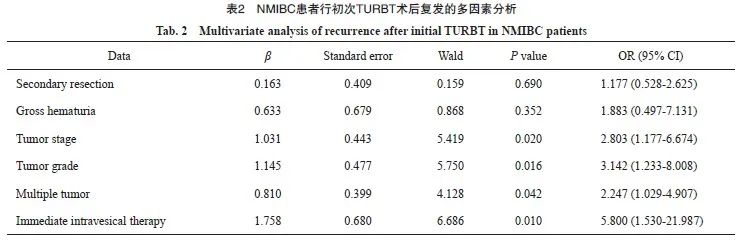
3 讨 论
2022年国家癌症中心发布的全国癌症报告[6]显示,2000—2016年中国膀胱癌的发病率有上升趋势,2016年有33 700人死于膀胱癌,世界标准人口年龄标准化死亡率为1.31/100 000。膀胱癌主要为NMIBC,临床上NMIBC主要的治疗手段为TURBT,但术后复发率较高,并且NMIBC进展成肌层浸润性膀胱癌(muscle invasive bladder cancer,MIBC)的风险高,1%~45%的NMIBC在5年内会进展成MIBC[7],治疗难度增大,患者预后差。NMIBC患者术后复发不仅会增加家庭经济负担,加重患者的心理压力,还严重影响生活质量。因此,分析NMIBC患者术后复发的危险因素很有必要。国内外关于NMIBC患者术后复发的研究较多,但这些研究[8-10]大多纳入了有膀胱肿瘤病史的患者或未区分患者是否为初次行TURBT,关于NMIBC患者初次行TURBT术后复发危险因素的研究很少见。本研究探讨NMIBC患者初次行TURBT术后复发的危险因素,对于数量庞大的新发膀胱癌患者术后控制复发及术后治疗有积极的指导意义。
本研究纳入了197例在电子科技大学附属肿瘤医院初次行TURBT治疗的NMIBC患者,术后随访24~77个月,发现有48例复发,占比24.37%,logistic回归分析显示,肿瘤T分期为T1期、肿瘤分级为高级别、肿瘤多发及未行即刻膀胱内灌注化疗是NMIBC患者术后复发的独立危险因素,与既往文献报道[11]一致。T1期浸润深度较Ta期更深,TURBT切除时更难以彻底切除病灶组织,残留肿瘤细胞可成为复发的基础,并且T1期浸润更深,术后行膀胱内灌注化疗时深层组织难以达到有效药物浓度,增加复发风险[12]。肿瘤分级为高级别提示恶性程度较高,肿瘤细胞较多,会极大增加手术彻底清除的难度,不利于降低术后复发率[11]。肿瘤数量越多,TURBT越难以彻底切除肿瘤,且肿瘤数量增加会导致肿瘤负荷增加,进而导致复发率升高[13]。血管内皮生长因子(vascular endothelial growth factor,VEGF)-α是实体肿瘤中主要的血管生成因子,可通过促进血管免疫屏障间接干扰免疫细胞的运输[14],术后即刻膀胱内灌注化疗能通过降低NMIBC患者VEGF水平从而降低术后复发率。术后即刻膀胱内灌注化疗还可以直接作用于膀胱肿瘤组织,杀伤手术后残余、脱落的肿瘤细胞,降低肿瘤细胞增殖复发和血行转移的风险[15]。
有研究[16]显示,对于T1期肿瘤二次电切阳性率为51%,并有8%的患者分期偏低,大部分残留肿瘤位于原肿瘤部位。一项包含2 451例高级别T1期肿瘤患者的多机构队列研究[17]显示,对于高级别T1期的患者行二次电切能提高无复发生存率。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[18]推荐首次电切未完全切除、病理学级别为高级别而未切至肌层、肿瘤分期为T1期、肿瘤直径大于3 cm及肿瘤数目多发者行二次电切。本研究二次电切行单因素分析差异有统计学意义,而多因素分析差异无统计学意义,可能与本研究对象并非均为高级别T1期肿瘤患者,还包括低级别及Ta期肿瘤患者相关。Mano等[19]的研究显示, NMIBC患者高中性粒细胞/淋巴细胞组术后复发风险高于低中性粒细胞/淋巴细胞组,高中性粒细胞/淋巴细胞比值是NMIBC患者术后复发的独立危险因素。中性粒细胞是炎症反应中的重要免疫成分,可通过多种旁分泌信号途径直接支持肿瘤细胞增殖[20]。淋巴细胞具有抗肿瘤作用,发挥作用的主要是细胞毒性T淋巴细胞[21]。更多的证据[22]显示,缺氧与肿瘤的发展密切相关,影响肿瘤的侵袭、转移及能量代谢等病理学过程,不利于肿瘤的治疗和预后,而贫血是导致缺氧的原因之一。一项纳入血红蛋白、中性粒细胞、淋巴细胞的研究[23]显示,高中性粒细胞×血红蛋白/淋巴细胞组术后复发率明显低于低中性粒细胞×血红蛋白/淋巴细胞组。本研究中性粒细胞/淋巴细胞、中性粒细胞×血红蛋白/淋巴细胞的ROC曲线显示差异无统计学意义,可能与这些因素主要是全身性指标,受患者一般情况影响因素较多有关,可能与TURBT术后复发的相关性不明显。有研究显示,谷草转氨酶/谷丙转氨酶[24]、控制营养状态评分[25]等血液学指标可以预测NMIBC患者的术后复发。还有研究[26]显示,尿液中核基质蛋白22、癌胚抗原、膀胱肿瘤抗原、膀胱肿瘤特异性核基质蛋白4的浓度等尿液中的肿瘤标志物也能预测NMIBC患者的术后复发。一项meta分析[27]显示,IFT140、UBE21、FAHD1和NME3 4个基因与NMIBC患者的复发显著相关,并有研究[28]显示,NMIBC复发者的HS6ST1、ARL14、RFX8基因中至少有一个基因表达上调。这些研究极大地丰富了预测NMIBC患者术后复发的危险因素,血液学指标、尿液肿瘤标志物及基因对预测NMIBC患者的术后复发有一定的临床意义。期待更多可预测NMIBC患者初次手术后复发危险因素的指标出现,从而辅助判断新发NMIBC患者的预后。
综上所述,对于数量庞大的新发NMIBC患者,肿瘤T分期为T1期、肿瘤级别为高级别、肿瘤多发及未行即刻膀胱内灌注化疗是其术后复发的独立危险因素,应及早进行临床干预,以改善患者预后。
[参考文献]
[1]SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA A Cancer J Clin, 2016, 66(1): 7-30.
[2]ZHANG J, WANG Y Y, WENG H, et al. Management of non-muscle-invasive bladder cancer: quality of clinical practice guidelines and variations in recommendations[J]. BMC Cancer, 2019, 19(1): 1054.
[3]POWLES T, BELLMUNT J, COMPERAT E, et al. Bladder cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up[J]. Ann Oncol, 2022, 33(3): 244-258.
[4]BABJUK M, BURGER M, CAPOUN O, et al. European association of urology guidelines on non-muscle invasive bladder cancer (Ta, T1, and carcinoma in situ)[J]. Eur Urol, 2022, 81(1): 75-94.
[5]WANG T W, YUAN H, DIAO W L, et al. Comparison of gemcitabine and anthracycline antibiotics in prevention of superficial bladder cancer recurrence[J]. BMC Urol, 2019, 19(1): 90.
[6]ZHENG R S, ZHANG S W, ZENG H M, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9.
[7]LU J L, XIA Q D, LU Y H, et al. Efficacy of intravesical therapies on the prevention of recurrence and progression of non-muscle invasive bladder cancer: a systematic review and network meta-analysis[J]. Cancer Med, 2020, 9(21): 7800-7809.
[8]SIKIC D, ECKSTEIN M, WEYERER V, et al. High expression of ERBB2 is an independent risk factor for reduced recurrence-free survival in patients with stage T1 non-muscle invasive bladder cancer[J]. Urol Oncol, 2022, 40(2): 63.e9-63.63.e18.
[9]SYLVESTER R J, VAN DER MEIJDEN A P, OOSTERLINCK W, et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2 596 patients from seven EORTC trials[J]. Eur Urol, 2006, 49(3): 466-465; discussion 475-477.
[10]杨庆良, 陈志峰, 王 军, 等. 非肌层浸润性膀胱癌患者经尿道膀胱肿瘤电切术后复发的影响因素[J]. 实用癌症杂志, 2022, 37(2): 309-311.
YANG Q L, CHEN Z F, WANG J, et al. Factors affecting recurrence of non-myometrial invasive bladder cancer after transurethral rep of bladder tumor[J]. Pract J Cancer, 2022, 37(2): 309-311.
[11]董建庭. 非肌层浸润性膀胱癌患者经尿道膀胱肿瘤电切术治疗后复发的现状及其危险因素分析[J]. 中国药物与临床, 2022, 22(3): 223-226.
DONG J T. Recurrence of non-muscle invasive bladder cancer and risk factors in patients after transurethral rep of bladder tumor[J]. Chin Remedies & Clin, 2022, 22(3): 223-226.
[12] 薛 炜, 邱建新, 桑 楠, 等. 影响非肌层浸润性膀胱癌患者经尿道膀胱肿瘤电切术后复发的相关因素分析[J]. 实用医院临床杂志, 2019, 16(5): 30-33.
XUE W, QIU J X, SANG N, et al. Analysis of related factors influencing recurrence of patients with non-muscle invasive bladder cancer after transurethral rep of bladder tumor[J]. Pract J Clin Med, 2019, 16(5): 30-33.
[13] 白恒舟, 乔保平. 200例非肌层浸润性膀胱癌复发及进展的危险因素分析[J]. 河南外科学杂志, 2017, 23(6): 39-41.
BAI H Z, QIAO B P. Analysis of risk factors for recurrence and progression of non-muscular invasive bladder cancer in 200 cases[J]. Henan J Surg, 2017, 23(6): 39-41.
[14] ZHANG Y Q, BREKKEN R A. Direct and indirect regulation of the tumor immune microenvironment by VEGF[J]. J Leukoc Biol, 2022, 111(6): 1269-1286.
[15] 苟泓燊, 郑红岗, 段中琪. 经尿道膀胱肿瘤电切术术后即刻表柔比星灌注化疗在非肌层浸润性膀胱癌患者中的应用效果[J]. 癌症进展, 2021, 19(22): 2343-2346.
GOU H S, ZHENG H G, DUAN Z Q. Effect of immediate epirubicin infusion chemotherapy after transurethral rep of bladder tumor in patients with non-muscular invasive bladder cancer[J]. Oncol Prog, 2021, 19(22): 2343-2346.
[16] CUMBERBATCH M G K, FOERSTER B, CATTO J W F, et al. Repeat transurethral rep in non-muscle invasive bladder cancer: a systematic review[J]. Eur Urol, 2018, 73(6): 925-933.
[17] GONTERO P, SYLVESTER R, PISANO F, et al. The impact of re-transurethral rep on clinical outcomes in a large multicentre cohort of patients with T1 high-grade/grade 3 bladder cancer treated with bacille Calmette-Guérin[J]. BJU Int, 2016, 118(1): 44-52.
[18] FLAIG T W, SPIESS P E, AGARWAL N, et al. Bladder cancer, version 3. 2020, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2020, 18(3): 329-354.
[19] MANO R, BANIEL J, SHOSHANY O, et al. Neutrophil-tolymphocyte ratio predicts progression and recurrence of nonmuscle invasive bladder cancer[J]. Urol Oncol, 2015, 33(2): 67.e1-67.e7.
[20] HEDRICK C C, MALANCHI I. Neutrophils in cancer: Heterogeneous and multifaceted[J]. Nat Rev Immunol, 2022, 22(3): 173-187.
[21] BULUT G, OZDEMIR Z N. Prognostic significance of neutrophil-lymphocyte ratio and platelet-lymphocyte ratio in metastatic colorectal cancer[J]. J Gastrointest Canc, 2022, 53(1): 1-6.
[22] ZHENG X Q, FAN H, LIU Y, et al. Hypoxia boosts aerobic glycolysis in carcinoma: a complex process for tumour development[J]. Curr Mol Pharmacol, 2022, 15(3): 487-501.
[23] ZHAO R N, SHAN J H, NIE L H, et al. The predictive value of the ratio of the product of neutrophils and hemoglobin to lymphocytes in non-muscular invasive bladder cancer patients with postoperative recurrence[J]. J Clin Lab Anal, 2021, 35(8): e23883.
[24] CHENG X F, ZHOU X C, YI M, et al. Preoperative aspartate transaminase/alanine transaminase ratio as a prognostic biomarker in primary non-muscle invasive bladder cancer: a propensity score-matched study[J]. BMC Urol, 2021, 21(1): 136.
[25] HUANG J G, ZHAO L W, WANG K, et al. Controlling nutritional status score evaluates prognosis in patients with nonmuscle invasive bladder cancer[J]. Cancer Control, 2021, 28: 10732748211021078.
[26] WANG Z Y, GAO W S, LI J, et al. Development and validation of a novel recurrence risk stratification for initial non-muscle invasive bladder cancer in the Han Chinese population[J]. J Cancer, 2020, 11(7): 1668-1678.
[27] GALESLOOT T E, GROTENHUIS A J, KOLEV D, et al. Genome-wide meta-analysis identifies novel genes associated with recurrence and progression in non-muscle invasive bladder cancer[J]. Eur Urol Oncol, 2022, 5(1): 70-83.
[28] DALLA E, PICCO R, NOVARA G, et al. Identification of a gene signature for the prediction of recurrence and progression in non-muscle invasive bladder cancer[J]. Mol Biomed, 2022, 3(1): 9.


