温州医科大学王佰亮团队《AFM》:新型光合生物杂化系统,通过连续供氧和纳米酶级联反应调控糖尿病视网膜病变!
时间:2023-07-11 17:49:34 热度:37.1℃ 作者:网络
根据国际糖尿病联合会糖尿病地图集的统计,糖尿病视网膜病变(DR)是致盲性疾病中视力丧失的主要原因。糖尿病患者视网膜血管病变进展的根本原因是微血管区域高血糖和缺氧特征。因此,温州医科大学王佰亮团队将蓝藻被用作载体,分别加载具有葡萄糖氧化酶样活性的金纳米颗粒(Au NPs)和具有过氧化氢酶样活性的铱纳米颗粒(Ir NPs)(Cyano@Au@Ir)。Au NPs纳米酶首先将葡萄糖降解为过氧化氢,过氧化氢再通过Ir NPs分解成H2O和O2,完成级联降血糖反应。基于眼球独特的透光率和视网膜区域光线的积累,Cyano持续的产氧量大大缓解了微环境的缺氧,导致血管生成生长因子和缺氧诱导因子表达的减少。同时,DR微环境中高表达的过氧化物也可以被Ir NPs消除,以实现抗炎特性。此外,DR动物模型证明Cyano@Au@Ir显着减少新生血管进展和血管渗漏。这种新颖的治疗模式从根本上降低了血糖,持续供应氧气,并清除自由基进行全面的微环境调控,为解决DR的眼底并发症提供启示。该研究以题为“A Novel Photosynthetic Biohybrid System for Microenvironment Regulation of Diabetes Retinopathy through Continuous Oxygen Supply and Nanozyme Cascade Reaction”的论文发表在《Advanced Functional Materials》上。

【Cyano@Au@Ir的制备和表征】
Cyano菌株Synechococcus elongates (S. elongates,细长聚球藻)是一种具有有趣结构和功能特征的微生物。Au NPs和Ir NPs分别通过HAuCl4和IrCl3原位还原反应生成的。通过TEM和相应的统计分析观察到分布均匀的球形Au NPs约为15 nm。PEI修饰后,Au NPs的大小没有显著变化,而zeta电位从−32.26 mV变为+26.88 mV。同样,通过TEM观察在约1.5 nm处也观察到超小的Ir NPs,其远小于Au NPs。通过原位还原反应,Au NPs和Ir NPs逐渐形成到Cyano上,制备了最终的复合纳米平台Cyano@Au@Ir。与Au NPs和Ir NPs整合后,Cyano的独特结构保存完好,没有明显的变形。
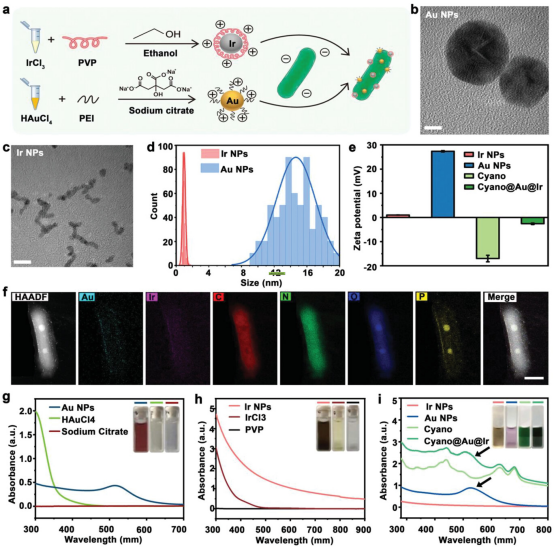
图1. Cyano@Au@Ir的制备
【GOD和CAT活性的体外研究】
在Cyano@Au@Ir双纳米酶级联系统中,Au NPs发挥类似葡萄糖氧化酶(GOD)活性的作用,产生葡萄糖酸和H2O2 。比较了几种不同大小和形状的常见Au NPs的GOD样活性。10 μg mL−1的不同类型的Au NPs选择与10 mm葡萄糖反应4小时以生成H2O2。结果表明,15 nm Au NPs具有最佳的催化效果,因此被选择用于后续实验。Au NPs和Ir NPs的共载量导致两种纳米酶之间的空间距离很近,H2O2可以立即转换为H2O和O2通过级联反应。Ir NPs有效催化了H2O2生成O2在各种条件下具有合格的催化稳定性。在DR包括高氧化应激、缺氧和炎症反应等复杂微环境中,过表达H2O2对有益的O2将大大改善病理微环境。
除了上述两种纳米酶的类酶活性外,Cyano作为载体可以连续产生O2在可见光照射下,在改善缺氧疾病的微环境中也起着至关重要的作用。视网膜区域的Cyano能连续产生O2在光通过眼路聚集的条件下,缓解DR区域的缺氧。
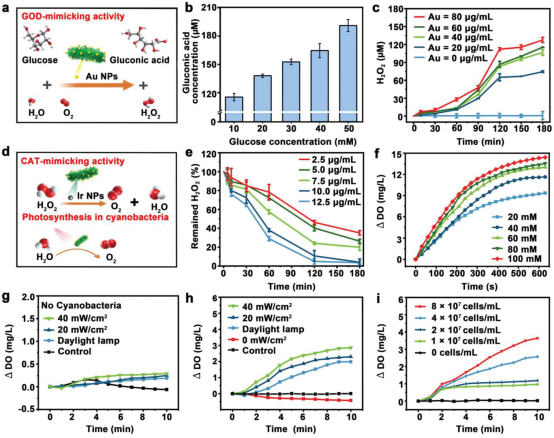
图2. Cyano@Au@Ir在体外的催化性能和O2释放的表征
【体外级联反应】
糖代谢紊乱被认为是DR的罪魁祸首,初期导致微血管瘤,后期出现硬渗出、软渗出、新生血管、玻璃体出血。降低微环境中的葡萄糖含量和氧化应激状态以阻断疾病进展被认为是应对DR的新策略。负载在Cyano表面的Au NPs催化葡萄糖降解为H2O2和葡萄糖酸。然后,H2O2进一步在Ir NPs的催化下分解为O2和H2O,完成整个级联反应。在整个级联反应过程中,两个葡萄糖分子的分解消耗了一个O2分子,导致微环境中进一步缺氧。幸运的是,在这个处理系统中,有两种方法可以生成O2,包括基于Ir NPs的类似CAT的活性,将微环境中的过氧化氢内源催化生成O2。另一种更重要的产氧方式是Cyano在可见光下通过光合作用连续产氧。
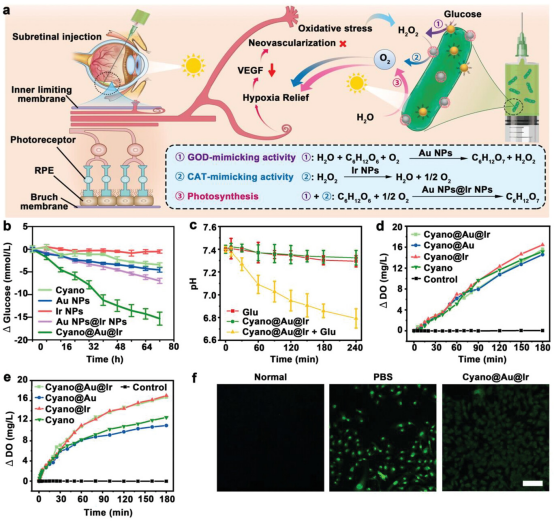
图3. 体外Cyano@Au@Ir级联反应的表征
【体外初步毒性研究】
通过标准细胞计数试剂盒8(CCK-8)方法在视网膜色素上皮(RPE)细胞上测试Cyano@Au@Ir的细胞毒性。结果表明,不同浓度的Cyano@Au@Ir对RPE细胞的存活,数量和扩散没有观察到的不利影响。将细胞群孵育24小时,并用FITC标记的膜联蛋白V和碘化丙啶(PI)染色。然后,采用经典的流式细胞术检测法,结果表明,Cyano@Au@Ir处理组94.8%的细胞处于正常状态,该材料不影响正常的细胞周期或引起显着的细胞凋亡。因此,由Cyano和纳米酶组成的光合生物杂化体系具有优异的生物相容性,无明显毒性。
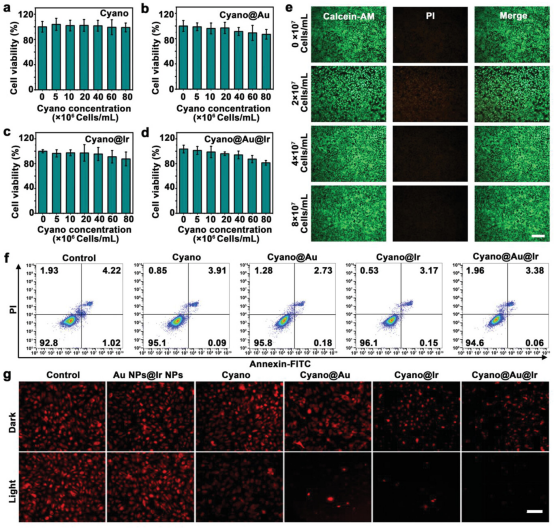
图4. Cyano@Au@Ir的体外生物相容性评估
【Cyano@Au@Ir体内治疗疗效】
如图5a所示,动物实验的整个过程可分为四个步骤:糖尿病的形成,DR的发展,治疗干预和后期的生理分析。首先,静脉注射STZ药物建立糖尿病小鼠模型(注射剂量为60mg kg−1每天连续注射7天)。正常组注射相同量的生理盐水。未注射STZ的正常组视网膜眼底血管呈现清晰的线条,且无荧光素渗漏。与没有糖尿病的正常组小鼠相比,糖尿病小鼠在玻璃体腔中表现出更多的荧光素染料泄漏,导致模糊和反射增加。视网膜下注射Cyano@Au@Ir后,DR新生血管渗漏被完全抑制并有效消退。形态几乎恢复到正常血管的水平。
为了通过Cyano@Au@Ir测量缺氧缓解,将哌莫硝唑溶解在盐水中(60 mg kg−1)腹腔注射,立即获得眼球以制作冷冻切片。切片与一抗和二抗孵育一起孵育。在荧光显微镜下检查切片,结果表明,Cyano@Au@Ir处理组的荧光强度明显低于PBS组。此外,Cyano@Au@Ir处理组与正常组之间无显著差异,表明光合生物杂化系统有效的视网膜缺氧缓解。此外,Cyano@Au@Ir光合生物杂交系统保持良好的O2-Cyano在生理环境中的生产能力。
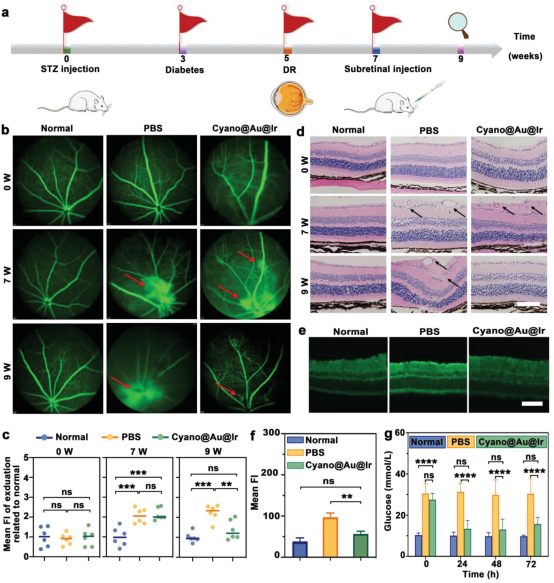
图5. DR模型的建立和Cyano@Au@Ir干预后视网膜的变化
【体内评估Cyano@Au@Ir的缺氧缓解、抗血管生成和抗炎作用】
视网膜微环境中的高葡萄糖和缺氧是糖尿病患者DR的根本原因。在病理改变过程中,缺氧诱导氧化应激和炎症反应,最终刺激血管生长因子的过表达和不良新生血管的产生。因此,在光合生物杂化系统的设计中,可以通过视觉途径为Cyano提供光,以实现连续的O2生成以缓解缺氧。此外,表面负载的纳米酶可以通过级联反应有效降低微环境中的葡萄糖浓度。此外,Ir NPs可以催化过氧化物分解成H2O和O2,从而减少炎症反应,增加局部O2含量。
众所周知,VEGF和HIF-1α被认为是两种关键的促血管生成细胞因子,在STZ诱导的DR中高表达。采用免疫荧光染色技术定性和定量分析两种细胞因子的表达。可以清楚地观察到,Cyano@Au@Ir治疗组视网膜区域的绿色荧光强度接近正常视网膜。进一步的统计分析表明,治疗组和正常组Cyano@Au@Ir HIF-1α表达量无显著差异。因此,可以认为视网膜区域在Cyano@Au@Ir治疗后未处于缺氧状态。统计分析显示,Cyano@Au@Ir和PBS治疗后视网膜VEGF表达均高于正常组。此外,Cyano@Au@Ir治疗组VEGF表达显著低于PBS治疗组,表明通过改善微环境可以有效减少继发性新生血管的生长。即Cyano@Au@Ir可以成功缓解炎症。
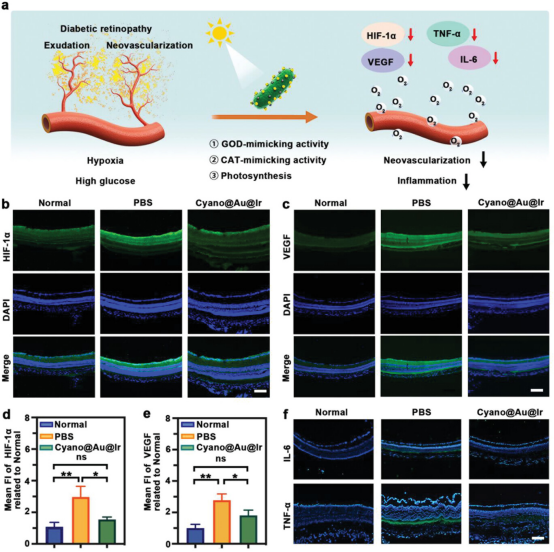
图6. Cyano@Au@Ir的微环境适应
【小结】
高血糖、缺氧和慢性炎症是DR的主要特征,导致视网膜形态、结构和功能发生严重变化。该研究开发了一种双纳米酶系统,包括具有GOD样活性的Au NPs和Cyano表面上具有CAT样活性的Ir NPs,通过级联反应具有降血糖作用。在可见光下,Cyano连续产生O2,有效地缓解了视网膜的缺氧状态。此外,微环境中的过氧化物可以被Ir NPs快速清除,从而显着降低氧化应激和炎症的水平。在STZ诱导的DR小鼠模型中,DR微环境得到显着改善,包括葡萄糖浓度恢复到正常范围,缓解缺氧,以及VEGF和炎症因子水平显着降低。即使形成的新生血管在治疗2周后也明显消退。因此,这种通过持续供氧、双纳米酶降血糖、消除氧化应激来改善疾病微环境的综合治疗模式在治疗糖尿病并发症方面具有巨大优势。
原文链接:
https://doi.org/10.1002/adfm.202302493


