百济神州PARP抑制剂获批,一季度终于扭亏为盈
时间:2021-05-07 15:05:26 热度:37.1℃ 作者:网络
5月7日,百济神州官网发布公告消息称,中国国家药品监督管理局批准PARP抑制剂百汇泽®(帕米帕利)用于治疗既往接受过治疗的晚期卵巢癌患者。
公告新闻稿称,其PARP抑制剂“百汇泽”已获得中国国家药品监督管理局附条件批准,公司正在筹备商业化相关工作,预计将在本月内完成商业发布。据公告,“百汇泽”用于治疗既往接受过至少两线化疗、伴有胚系BRCA (gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。
百汇泽®(帕米帕利)是一款 PARP1和PARP2抑制剂,临床前模型显示其具有穿透血脑屏障和 PARPDNA 复合物捕捉等药理学特性。由百济神州的科学家在北京研发中心自主研发,百汇泽®目前正作为单一 疗法或与其他药物联用治疗多种恶性实体瘤进行全球临床开发。迄今为止,已有 1200 多例患者入组百汇 泽®临床试验。 2021 年 5 月,中国国家药品监督管理局(NMPA)附条件批准百汇泽®用于治疗既往接受过至少两线化 疗、携有胚系 BRCA (gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。针对该适应症的完全批准将取决于正在开展中的确证性临床试验结果。
百济神州总裁吴晓滨称,这是公司第三款获得上市许可的自主研发创新药物,这是公司发展进程中的一项重要里程碑事件。目前百济神州广泛的商业化产品组合现包含7款药物,在恶性血液瘤和实体瘤中覆盖15 项适应症。
百济神州肿瘤免疫学首席医学官贲勇医学博士表示:“百汇泽®是中国首款获批用于治疗涵盖铂敏感以及铂耐药的复发性卵巢癌患者的 PARP 抑制剂,我们为此十分激动。百汇泽®的设计独特,旨在降低耐药性且提供持续抗肿瘤缓解,正如去年我们在欧洲肿瘤内科学会(ESMO)年会上公布的数据显示,这款高选择 性 PARP 抑制剂在患者中产生了颇高的客观缓解率,且总体耐受性良好。我们十分感激参与临床试验的患 者和研究者,并期待百汇泽®成为中国复发性卵巢癌患者的一款重要治疗选择。此外,我们正在其他多项试 验和适应症中评估百汇泽®,包括正在开展的百汇泽®作为维持疗法用于治疗铂敏感复发性卵巢癌患者的 3 期临床试验。”
复旦大学附属肿瘤医院肿瘤妇科主任吴小华博士兼该试验主要研究者称:“疾病复发在晚期卵巢癌患者中 十分常见,由于化疗疗效有限且毒副作用大,PARP 抑制剂在后线治疗中已成为一项常用疗法。这项关键 2 期临床试验数据令人欣喜,展现了帕米帕利能为铂敏感或铂耐药患者带来具有临床意义且持久的缓解。 我们相信帕米帕利获批能为这些患者和家属带来新的治疗希望。” NMPA 附条件批准百汇泽®用于治疗晚期卵巢癌、输卵管癌或原发性腹膜癌患者是基于一项 1/2 期临床试验 (NCT03333915)的关键性 2 期部分临床结果。共有 113 例既往接受过至少两项标准化疗、伴有 gBRCA 突变的高级别上皮性卵巢癌(包括输卵管癌或原发性腹膜癌)患者在中国入组该项试验的关键性 2 期部分,包括 90 例晚期铂敏感卵巢癌(PSOC)患者和 23 例晚期铂耐药卵巢癌(PROC)患者。 百汇泽®有效性数据是基于 101 例疗效可评估患者经独立审查委员会(IRC)根据 RECIST v1.1 进行评估, 其中包括 82 例 PSOC 患者和 19 例 PROC 患者。PSOC 患者中的中位随访时间为 17.0 个月,客观缓解率 (ORR)为 68.3%(95%CI:57.1,78.1),中位缓解持续时间(DoR)为 13.8 个月(95% CI:10.97,20.73);PROC 患者中的中位随访时间为 11.6 个月,ORR 为 31.6%(95%CI:12.6,56.6),中位 DoR 为 11.1 个月(95%CI:4.21,16.59)。
百汇泽®总体安全性概况是基于在 3 项临床试验中接受百汇泽®单药治疗的 317 例患者所得。最常见的不良 反应(≥10%)为贫血、恶心、白细胞减少症、中性粒细胞减少症、呕吐、疲乏、血小板减少症、食欲减 退、腹泻、腹痛、天门冬氨酸氨基转氨酶(AST)升高、丙氨酸氨基转氨酶(ALT)升高、血胆红素升高 和淋巴细胞减少症。 55.8%的患者经历了 3 级及以上的不良反应,最常见(≥1%)为贫血、中性粒细胞减 少症、白细胞减少症、血小板减少症、淋巴细胞减少症、呕吐、疲乏、腹泻、恶心和 AST 升高。 21.5%的 患者经历了严重不良反应,最常见(≥1%)为贫血和白细胞减少症。 该项关键二期临床试验在中国报告的最常见不良反应(≥10%)为贫血、白细胞减少、恶心、中性粒细胞减 少症、呕吐、血小板减少症、食欲减退、疲乏、腹痛、ALT 升高、腹泻、AST 升高、淋巴细胞减少症、γ谷氨酰转移酶增加、上呼吸道感染、血胆红素增加、不适、体重下降和头晕。71.7%的患者经历了三级及 以上不良反应,最常见(≥1%)为贫血、中性粒细胞减少症、白细胞减少症、血小板减少症、淋巴细胞减 少症、呕吐、腹泻、γ-谷氨酰转移酶升高、低血钾、腹痛、疲乏、上呼吸道感染、全血细胞减少症和高血 压。 百汇泽推荐剂量为每次 60 毫克、每日两次口服治疗。
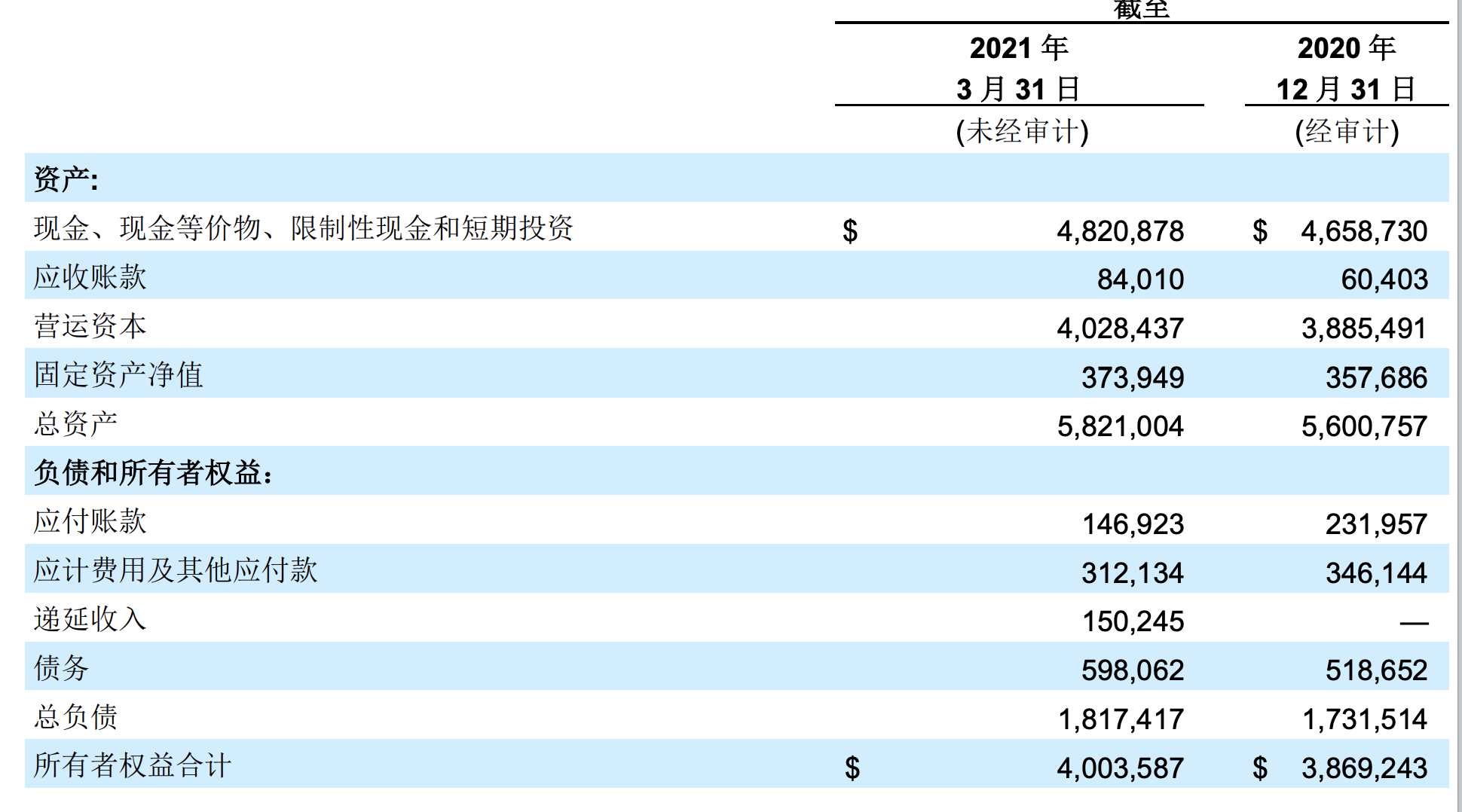
而发布此消息同一天,百济神州同步发布了第一季度业绩报,业绩报显示,2021年一季度,公司实现收入6.06亿美元,净收入为0.67亿美元。值得一提的是,这也是公司自2018年8月8日起在港股上市以来,首度在报表中实现盈利。去年同期,公司仍净收入亏损3.6亿美元。
截至2021年3月 31日的三个月现金、现金等价物、受限资金和短期投资为48亿美元;相比较,截至2020年12月31日的持有额为47亿美元,实现了 1.621 亿美元的增长
业绩报中同时指出,帕米帕利预计里程碑事件:
于 2021 年上半年在中国获批用于治疗既往接受过至少两线化疗、伴有胚系 BRCA 突变的 复发晚期卵巢癌、输卵管癌或原发性腹膜癌患者 将于 2021 年或 2022 年上半年公布帕米帕利作为针对铂敏感复发性卵巢癌(OC)患者维 持治疗的 3 期临床试验(NCT03519230)主要结果 将在 ASCO 2021 年线上年会上公布临床数据,包括以下海报展示: – 帕米帕利在中国用于治疗胚系 BRCA 突变的局部晚期或转移性 HER2 阴性乳腺癌患者 的 2 期临床试验(NCT03575065) – 帕米帕利对比安慰剂作为对铂类一线化疗响应的无法手术的局部晚期或转移性胃癌患 者维持治疗的 2 期临床试验(NCT03427814)公司业绩报中指出,预计新冠肺炎病毒(COVID-19)引起的世界卫生危机将继续对其业务造成一定的负面影响,包括商业销售、药政沟通、检查及申报、临床试验的患者、参与以及数据公布。该全球大流行对全球的影响仍存在不确定性。公司正在努力减少疫情导致的工作延迟和中 断,并继续按照在全球范围内制定的商业化、药政事物以及临床开发目标开展工作。
参考资料:
https://ir.beigene.com/news-releases/news-release-details/baijishenzhougongbu2021niandiyijiducaiwuyeji
https://ir.beigene.com/static-files/0283ea10-ce41-4c5e-8ddd-5bc55838b9d4


