肝细胞癌的分子靶向药物与免疫抑制剂联合治疗及其他联合治疗
时间:2021-05-13 19:01:42 热度:37.1℃ 作者:网络
肝细胞癌(HCC)发病率在我国恶性肿瘤中居第4位,死亡率第3位[1],70%~80%的患者确诊时已失去手术机会,而且术后5年复发率高达70%[2]。分子靶向药物开启了中晚期HCC全身治疗的新篇章,如索拉非尼、乐伐替尼、瑞戈非尼、贝伐单抗、雷莫芦单抗等[3]。最近免疫治疗被应用于晚期HCC患者,Checkmate-040、KEYNOTE-224等临床试验[4-5]证明了免疫治疗在晚期HCC患者中的安全性和有效性。本文就分子靶向药物与免疫抑制剂联合治疗HCC的最新研究进展、其他联合治疗在HCC中的应用,以及HCC联合治疗未来的发展方向及面临的挑战进行综述。
1免疫治疗联合靶向治疗
血管异常是包括HCC在内的实体肿瘤的重要特征,这种异常源于血管内皮生长因子(VEGF)等因子水平的升高。肿瘤血管异常导致肿瘤微环境(TME) 处于缺氧和酸中毒的状态,通过增加免疫抑制调节性T淋巴细胞(Treg)的聚集、激活和扩张,抑制树突状细胞成熟等途径,导致肿瘤特异性细胞毒性T淋巴细胞(CTL)的抗原递呈和激活受损,具有免疫抑制表型的异常内皮细胞(EC)扩张,同时,在TME的状态下,程序性细胞死亡蛋白1(PD-1)/程序性细胞死亡蛋白1配体1(PD-L1)途径被激活,PD-L1在CTL、EC以及肿瘤细胞上表达上调。综上,使用抗VEGF分子靶向药物改善肿瘤血管状态和抗PD-1/PD-L1免疫抑制剂抑制肿瘤免疫逃逸反应在理论上具有协同抗癌作用[6]。
1.1 “A+T”组合[贝伐单抗(Bevacizumab)+阿替利珠单抗(Atezolizumab)]
基于Ⅰb期临床试验GO30140[7]的初期有效结果,Ⅲ期、开放标签、随机研究IMbrave150试验[8]对501例未接受过系统性治疗的HCC患者进行研究。研究结果表明,两组患者(“A+T” vs索拉非尼)的中位生存期(mOS)为未达到vs 13.2个月,12个月OS率为67.2% vs 57.6%,中位无进展生存期(mPFS)“A+T”组延长2.5个月(HR=0.59,95%CI:0.47~0.76,P<0.001),客观缓解率(ORR)为27.3% vs 11.9%(RECIST 1.1标准,P<0.001),疾病控制率(DCR)为73.6% vs 55.3%,缓解持续时间(DOR)≥6个月的患者比例为87.6% vs 59.1%。在治疗过程中,“A+T”组和索拉非尼组最常见的3或4级不良事件均为高血压且安全可控,“A+T”组相较于索拉非尼组有更低的5级不良事件发生率(4.6% vs 5.8%)。该项研究同时公布了中国亚组数据,在患者整体有着多种预后不良因素的状态下,中国亚组“A+T”组患者的OS未达到,索拉非尼组mOS为11.4个月。在PFS方面,“A+T”组较索拉非尼也有显著延长(5.7个月vs 3.2个月),中国亚组降低死亡风险56%(OS分层HR=0.44, 95%CI: 0.25~0.76),而全球研究仅降低42%,该联合治疗似乎可以给中国患者带来更大获益。研究引入了患者的生活质量,中国患者大部分伴乙型肝炎、肝硬化,本身的生活质量较差,索拉非尼单药治疗的患者生活质量改变的中位时间是3.6个月,而“A+T”联合治疗为11.2个月,“A+T”组生活质量恶化的时间明显长于mPFS,在治疗过程中患者能有更好的生活质量。
1.2 “可乐”组合[仑伐替尼(Lenvatinib)+帕博利珠单抗(Pembrolizumab)]
2020年ASCO会议上,Ⅰb期开放性、单臂、多中心研究KEYNOTE-524[9]更新了对100例巴塞罗那B期或C期HCC患者的最新研究数据。该100例患者的mOS为22.0个月,mPFS为8.6个月(95%CI:7.1~9.7,RECIST v 1.1 per IIR评估),DCR为88%。依据RECIST 1.1标准, ORR为36.0%,其中完全缓解(CR) 11例、部分缓解(PR) 35例,mDOR为8.6个月。研究显示,95%的患者发生治疗相关的不良事件,最常见的3级治疗相关的不良事件是高血压(17%),白细胞减少是唯一与治疗相关的4级不良事件,3例与治疗相关的5级不良反应分别为急性呼吸衰竭、肝功能异常和肠穿孔。仑伐替尼联合帕博利珠单抗的Ⅲ期临床试验——LEAP-002(NCT03713593)正在进行中,预计纳入750例患者,首要终点为PFS和OS,次要终点包括ORR、DOR、DCR,目前该项目在全球172个研究中心已完成入组,正在观察随访。
比较“可乐”组合与“A+T”组合公布的数据,虽然“可乐”组合目前仅处于Ⅰ期临床试验,但mPFS、ORR、DCR等均表现出一定优势,而且“可乐”组合的mOS高达22个月,如果LEAP-002获得可喜的成果,“可乐”组合可能会成为继“A+T”组合后又一中晚期HCC一线治疗策略中的一级专家推荐。
1.3 阿帕替尼(Apatinib)+卡瑞利珠单抗(Camrelizumab)
一项开放标签、剂量递增(Ⅰa期)和扩展(Ⅰb期)、多中心应用阿帕替尼联合卡瑞利珠单抗治疗晚期HCC、胃或食管胃交界癌的安全性和有效性的临床研究[10]共纳入18例HCC患者,其中17例患者为巴塞罗那C期。研究结果显示,在16例可评估疗效患者中,8例患者获得PR,ORR达到50%,DCR为93.8%,mOS为3.4个月,平均7.8个月的随访期间中,mPFS为5.8个月。43例患者中,33例接受250 mg阿帕替尼治疗的患者显示出了良好的耐受性,发生率≥10%的3级及以上不良反应有高血压和AST升高。阿帕替尼联合卡瑞利珠单抗治疗显示了可控的不良反应,在晚期HCC患者中展现了显著的疗效。阿帕替尼联合卡瑞利珠单抗治疗晚期HCC的Ⅱ期临床试验已经完成(NCT03463876),数据尚未公布。关于阿帕替尼联合卡瑞利珠单抗与索拉非尼作为一线治疗在晚期HCC患者中应用的Ⅲ期临床试验SHR-1210-Ⅲ-310(NCT03764293)也处于招募中。另外多项免疫联合靶向治疗相关临床试验均在招募或实验当中,详见表 1。
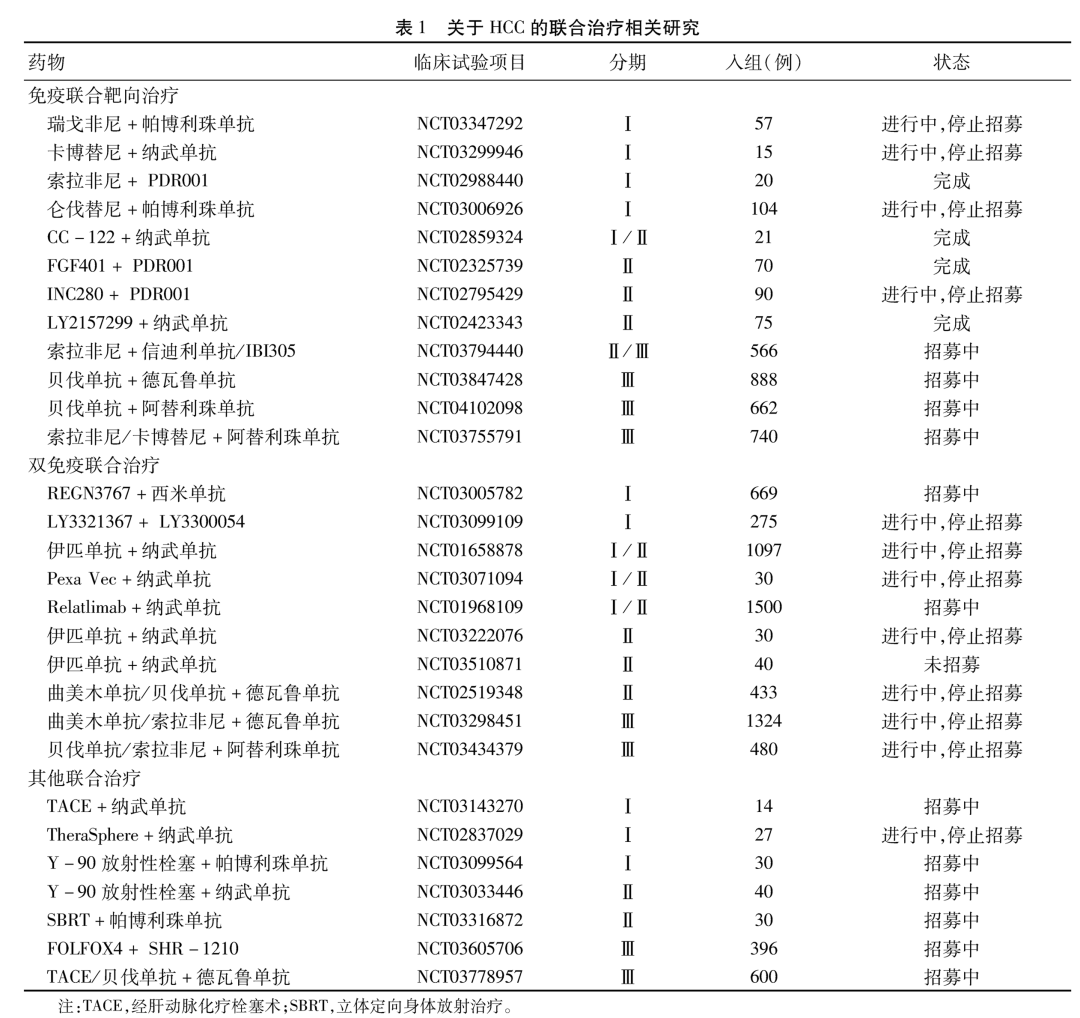
2 双免疫联合治疗
在生理条件下,肝脏中由抗原递呈细胞(APC)、Treg和抑制性细胞因子组成的免疫耐受系统来维持免疫平衡。然而在TME中,APC、Treg等细胞上的PD-1/PD-L1、细胞毒性T淋巴细胞相关蛋白4(CTLA-4)-CD80/86等免疫检查点分子有不同程度的过度表达[11]。有研究[12]发现,高水平免疫检查点分子的肿瘤组织中T淋巴细胞被耗竭,形成肿瘤组织的免疫抑制性微环境。CTLA-4主要表达在活化的T淋巴细胞和Treg上,在T淋巴细胞抗原受体的刺激下,CTLA-4在质膜上通过与CD28竞争B7配体从而抑制T淋巴细胞活化。PD-1主要表达在CD8+T淋巴细胞上,与CLTA-4受体相似,PD-1/PD-L1也是CD28超家族成员,可作为T淋巴细胞抗原受体(TCR)的共抑制信号。CTLA-4和PD-1/PD-L1在形成肿瘤免疫耐受上有相似的机制,同时抑制CTLA-4和PD-1/PD-L1可在效应性T淋巴细胞不同的生命周期中起到调节免疫抑制的作用[13]。一系列实体肿瘤的临床前研究数据[14-15]也表明,与单一治疗相比,双免疫联合治疗具有协同作用。双免疫联合治疗逐渐成为HCC系统治疗热点,多项联合治疗正在进行中(表 1)。
2.1 伊匹单抗(Ipilimumab)+纳武单抗(Nivolumab)
CheckMate-040研究的队列4研究[16]结果表明,该联合治疗的ORR为31%,达到纳武单抗单药治疗的2倍(14%),其中有7例CR,mDOR为17.5个月,DCR为49%,24个月的OS率为40%。亚组分析发现,无论PD-L1表达水平如何,所有治疗组患者均观察到临床获益。A组(纳武利尤单抗1 mg/kg,伊匹木单抗3 mg/kg,3周1次)、B组(纳武利尤单抗3 mg/kg,伊匹木单抗1 mg/kg,3周1次)和C组(纳武利尤单抗3 mg/kg,2周1次;伊匹木单抗1 mg/kg,6周1次)的mOS分别为22.8、12.5和12.7个月。37%的患者出现3~4级治疗相关不良反应,且可逆可控。
2.2 “D+T”组合[德瓦鲁单抗(Durvalumab)+曲美木单抗(Tremelimumab)]
随机、开放、多中心Ⅲ期临床研究HIMALAYA[17]德瓦鲁单抗联合曲美木单抗一线治疗晚期HCC的疗效,截至2019年9月2日,各组患者(T300+D vs T75+D vs单药D vs单药T)的中位随访时间为11.7 vs 14.6 vs 8.9 vs 15.8个月,mOS分别为18.7 vs 11.3 vs 11.7 vs 17.1个月,mORR分别为22.7% vs 9.5% vs 9.6% vs 7.2%,3~4级不良反应占比分别为35.1% vs 24.4% vs 17.8% vs 42.0%。而且在T300+D组中,发现该组合具有特殊的增殖T淋巴细胞图谱,客观缓解的患者表现出了高CTL计数。该试验目前正在比较T300+D和D与索拉非尼一线治疗晚期HCC的疗效差异(NCT03298451)。
3 化疗相关联合治疗
化疗药物因其对免疫细胞的毒性作用常被认为是免疫抑制剂,然而有实验[18]发现,化疗会诱导免疫原性细胞死亡,释放肿瘤相关抗原和危险相关分子模式,两者能在TME中招募免疫细胞,同时化疗药物还能耗尽骨髓源性抑制性细胞和Treg[15],减轻肿瘤浸润的T淋巴细胞的活性抑制,所以化疗在与免疫抑制剂联合使用时,不仅可以主动解除TME中的免疫抑制,同时也能为免疫抑制剂的作用募集更多的免疫细胞。
一项前瞻性、单臂、双组、多中心的Ⅱ期临床试验[19],卡瑞利珠单抗(3 mg/kg,每2周1次)联合FOLFOX4方案或GEMOX方案治疗晚期HCC和胆管细胞癌患者,主要终点ORR,次要终点包括DCR、PFS、OS等。结果显示,在HCC队列34例可评估的患者中,ORR为26.5%,DCR为79.4%,mPFS为5.5个月,mDOR未达到。最常见的不良反应为中性粒细胞减少、白细胞减少、血小板减少和过敏,多为1~2级,耐受性良好且安全可控。评估卡瑞利珠单抗联合FOLFOX4与索拉非尼或FOLFOX4在晚期HCC一线治疗中作用的Ⅲ期临床研究(NCT03605706)正在招募中。2020年ASCO大会上,一项仑伐替尼联合肝动脉灌注化疗(HAIC)一线治疗晚期HCC的回顾性研究[20]共入组24例晚期HCC患者,ORR为66.7%,DCR达到79.2%,mPFS为8.1个月,6、9、12个月的OS率分别为91.7%、83.3%和75%;另一项HAIC联合阿帕替尼和特瑞普利单抗一线治疗晚期HCC的回顾性研究[21]中,共纳入6例初治的晚期HCC患者,最终患者的DCR达到了100%,按照RECIST评估6例患者均达到PR。
4 嵌合抗原受体T淋巴细胞免疫疗法(CAR-T)相关联合治疗
CAR-T是一种改良T淋巴细胞的免疫疗法,对于CAR-T,TME缺氧、高酸、低营养、易氧化应激的条件并不利于生存和增殖,体外实验表明,在改善肿瘤氧化应激等条件的情况下,CAR-T的增殖能力得以提高,能减少TME中免疫抑制细胞导致的CAR-T的衰竭[22],目前改善TME中CAR-T的衰竭最流行的策略之一就是使用免疫检查点抑制剂,联合靶向PD-L1、PD-1和CTLA-4的药物也已被发现是有效的[23-24]。
Wu等[25]通过分析GPC3-CAR-T和索拉非尼在免疫活性小鼠HCC模型和免疫缺陷小鼠HCC模型中的联合作用发现,索拉非尼可诱导TME中的巨噬细胞分泌IL-12,进而提高CAR-T活性,而且在对免疫缺陷小鼠的研究中发现,索拉非尼与CAR-T协同促进了肝癌细胞的凋亡,增强了CAR-T的抗肿瘤效果。索拉非尼与CAR-T的协同治疗涉及多个机制,该实验为多激酶抑制剂联合CAR-T在实体肿瘤的临床试验提供了基础。在与免疫检查点抑制剂联合治疗的相关研究中,Guo等[26]证实阻断PD-1不仅增强CAR-T对HCC的抗肿瘤活性,而且可以改善CAR-T在肿瘤中的存活和浸润,这也是目前CAR-T在血液系统恶性肿瘤有良好的治疗效果而在实体肿瘤中尚未得出良好效果的重要原因之一。
虽然CAR-T技术有很多优点,但其在实体肿瘤中的应用还处于探索阶段,实体中路靶点的特异性和多靶点问题仍是治疗的瓶颈,漏靶现象、细胞因子大量释放、溶解综合征等一系列问题亟待解决[27]
5 放疗相关联合治疗
HCC的放射治疗起始于全肝宽野低剂量放射治疗,在20世纪90年代之前,经常导致放射性肝病、肝衰竭,随着三维适形放射治疗、调强放射治疗和SBRT的应用,靶向病灶的准确性显著提高[28]。Que等[29]对2009年1月—2016年6月54例伴有门静脉癌栓的晚期HCC患者进行回顾性分析,结果显示,SBRT联合索拉非尼组和单独SBRT的ORR分别为77.77%和75.00%(P=0.43),mPFS为6个月vs 3个月(P=0.24),1年和2年无进展生存率分别为25.7%和15.2%vs 11.1%和8.3% (P=0.122 5),mOS分别为12.5个月vs 7个月(P=0.28),SBRT联合索拉非尼组有更高的疗效,但各项指标的趋势并没有达到统计学意义,而且试验证明联合索拉非尼组同样增加3级以上的毒副反应。
PD-1/PD-L1和CTLA-4是近年来免疫检查点疗法的重要靶点。有临床前研究[30]证实,经过放射治疗后,CD8+T淋巴细胞产生的γ-干扰素所介导的肿瘤细胞的PD-L1上调,并诱导局部抗肿瘤反应。单纯放疗不能产生长期的抗肿瘤免疫,但阻断PD-1/PD-L1轴可以缓解放疗对免疫的限制,而且放疗联合抗PD-1/PD-L1治疗时,可以激活全身免疫以发挥远端抗肿瘤能力,出现照射区肿瘤和野外肿瘤共同消退的罕见现象。CTLA-4和CD28是CD4+和CD8+ T淋巴细胞表面共表达的同源受体,均可与APC表面CD80和CD86结合,但CTLA-4调节T淋巴细胞失活且对配体的亲和力高于CD28[30]。放疗联合免疫检查点抑制剂具有同时清除原发病灶和远处转移的独特疗效,但相关研究大多处于临床前阶段,仅少量临床研究回顾性分析放疗联合免疫治疗在黑色素瘤、非小细胞肺癌等恶性肿瘤中的远期疗效,放疗的最佳剂量、2种治疗方法的最佳给药点以及肿瘤预测的相关生物标志物等可变因素均需要大量临床试验的探索,与此同时,新的免疫靶点开发以及为放疗匹配不同的免疫抑制因子以适用不同类型癌症也是未来需要考虑的问题。
5 局部治疗相关联合治疗
研究[31]表明,经TACE或消融治疗后的残留肝癌组织中,不仅局部的外周免疫应答会被诱导,导致抗肿瘤免疫反应受到抑制,而且局部残存组织中VEGF阳性细胞数也会明显增加,VEGF-A水平明显升高,促进局部新生血管形成,成为引起治疗后局部复发的重要因素。局部治疗后利用免疫抑制药物抑制局部的免疫逃逸或靶向药物抑制局部新生血管的形成,理论上在控制局部复发上具有协同作用。
随机、双盲Ⅱ期临床试验SPACE[32]以疾病进展时间(TTP)为主要终点对307例中期多结节HCC患者进行分析,结果显示,虽然索拉非尼联合TACE是安全有效的,但与对照组相比较,临床意义上并未延长TTP(mTTP:169 d vs 166 d,单侧P=0.072),在另外3项临床试验POST-TACE、trialTACE2、BREISK-TA中也得出了类似的结果。然而,Ⅱ期临床试验TACTICS显示,索拉非尼+TACE组的mPFS明显长于单纯TACE组(25.2个月vs 13.5个月,P=0.006),索拉非尼+TACE组的中位终止治疗时间也明显延长(26.7个月vs 20.6个月,P=0.02)[33]。分析发现,SPACE等试验不论治疗过程中肿瘤的控制情况和肝功能损伤状况,均在固定时间节点接受或终止TACE治疗,导致肝功能一过性损伤,而肝功能Child-Pugh B级为终止TACE治疗的进展标准使得一过性肝损伤的患者被过早的终止试验,在后期的随访中以上导致试验结果差异的原因也得到了进一步证实。
抗CTLA-4抗体曲美木单抗联合消融术治疗中晚期HCC的临床试验中,32例符合巴塞罗那分期C期的HCC患者的mOS为12.3个月,mTTP为7.4个月,6个月和12个月无进展生存率分别为57.1%和33.1%[34]。与曲美木单抗单药治疗HCC的Ⅱ期临床试验相比较,在单药治疗选择了预后更好的患者的情况下(43%巴塞罗那分期B期),联合治疗依旧达到了更长的mTTP (7.4个月vs 6.48个月)以及更长的mOS (10.1个月vs 8.2个月)[35]。
7 手术联合治疗
转化治疗是指不可手术但具有潜在手术可能的患者经综合手段,控制肿瘤进展甚至降低临床分期,改善肝功能,从而转化为可手术的治疗模式[36]。2020年ASCO会议上报告了两项关于转化治疗的临床研究,分别为“仑伐替尼联合PD-1单抗一线/二线治疗不可切除/晚期HCC的真实世界研究”[37]和“TKIs联合PD-1单抗转化治疗初始不可切除HCC的临床研究”[38]。前者纳入了77例晚期HCC患者,仑伐替尼联合PD-1抗体用于一线和二线治疗,分别取得了60.5%和43.8%的ORR(mRECIST标准),其中6例患者因治疗后肿瘤缩小而进行了手术;后者共纳入60例患者,经仑伐替尼联合PD-1单抗治疗后,11例患者转化为可切除,其中9例完成手术,截止到最后一次随访,7例仍维持无瘤状态。
2020年ASCO会议上报道的一项针对可切除的Ⅲa期HCC患者术后应用阿帕替尼的Ⅱ期临床研究[39],研究纳入30例伴门静脉癌栓的HCC患者,根据日本肝癌研究组分类其中Vp1 1例,Vp2 11例,Vp3 12例,中位治疗时间为4.8个月,中位随访时间为14.3个月。试验结果显示,中位无复发生存时间为7.6个月,1年无复发生存率为36.1%,mOS未达到,1年OS率为93.3%。所有患者均发生了与治疗相关的不良事件,3级或4级不良事件共14例,最常见的不良事件为血小板减少与中性粒细胞减少。该试验证实阿帕替尼对伴门静脉癌栓的HCC切除后的大多数患者均耐受, 至于术后应用阿帕替尼对肿瘤复发的疗效还需要进行对照研究进一步证明。另一项评估单独使用纳武单抗或纳武单抗联合伊匹单抗在可切除的HCC患者围手术期疗效的Ⅱ期临床试验[40]显示,21例按计划进行手术的患者CR率达24%,3级与治疗相关的不良事件6例,无4级及以上不良事件发生,达到了安全性的主要研究终点。
8 结语
联合治疗在中晚期HCC展现出良好的治疗效果和可控的安全性,但联合治疗的发展使临床医师必须考虑一些问题:
(1)联合治疗组合多样,哪种组合的疗效更好,或者不同分期的患者是否有对应疗效最好的组合;
(2)全身治疗的副作用较大,如白细胞或粒细胞减少、高血压、腹泻、皮疹等,联合治疗是否会使毒副反应增加,如何减少毒副作用的发生,发生后如何给予恰当的处理;
(3)免疫靶向联合方案存在优势人群[41],探索联合治疗的生物标志物,筛选出免疫联合靶向治疗的优势人群是亟待解决的问题;
(4)HCC患者多伴HBV或HCV感染,使用免疫抑制剂会引起与病毒重新激活相关的肝功能暴发性损伤[38],基于免疫检查点抑制剂的联合治疗是否会增加病毒重新激活的概率,以及激活时相应的治疗措施依旧有待探索;
(5)早诊早治和预防转移复发在HCC的治疗中十分关键,多学科诊疗将是必经之路[42],今后的诊治过程中,针对联合治疗生物标志物的精准治疗,多学科综合诊治贯穿始终将是中晚期HCC治疗最新、最高的要求。
参考文献:
[1] FENG RM, ZONG YN, CAO SM, et al. Current cancer situation in China: Good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI: 10.1186/s40880-019-0368-6.
[2] European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908-943. DOI: 10.1016/j.jhep.2011.12.001.
[3] HUANG A, YANG XR, CHUNG WY, et al. Targeted therapy for hepatocellular carcinoma[J]. Signal Transduct Target Ther, 2020, 5(1): 146. DOI: 10.1038/s41392-020-00264-x.
[4] EL-KHOUEIRY AB, SANGRO B, YAU T, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): An open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389(10088): 2492-2502. DOI: 10.1016/S0140-6736(17)31046-2.
[5] ZHU AX, FINN RS, EDELINE J, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): A non-randomised, open-label phase 2 trial[J]. Lancet Oncol, 2018, 19(7): 940-952. DOI: 10.1016/S1470-2045(18)30351-6.
[6] FUKUMURA D, KLOEPPER J, AMOOZGAR Z, et al. Enhancing cancer immunotherapy using antiangiogenics: Opportunities and challenges[J]. Nat Rev Clin Oncol, 2018, 15(5): 325-340. DOI: 10.1038/nrclinonc.2018.29.
[7] LEE MS, RYOO BY, HSU CH, et al. Atezolizumab with or without bevacizumab in unresectable hepatocellular carcinoma (GO30140): An open-label, multicentre, phase 1b study[J]. Lancet Oncol, 2020, 21(6): 808-820. DOI: 10.1016/S1470-2045(20)30156-X.
[8] FINN RS, QIN S, IKEDA M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma[J]. N Engl J Med, 2020, 382(20): 1894-1905. DOI: 10.1056/NEJMoa1915745.
[9] FINN RS, IKEDA M, ZHU AX, et al. Phase Ib study of lenvatinib plus pembrolizumab in patients with unresectable hepatocellular carcinoma[J]. J Clin Oncol, 2020, 38(26): 2960-2970. DOI: 10.1200/JCO.20.00808.
[10] XU J, ZHANG Y, JIA R, et al. Anti-PD-1 antibody SHR-1210 combined with apatinib for advanced hepatocellular carcinoma, gastric, or esophagogastric junction cancer: An open-label, dose escalation and expansion study[J]. Clin Cancer Res, 2019, 25(2): 515-523. DOI: 10.1158/1078-0432.CCR-18-2484.
[11] PARDOLL DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012, 12(4): 252-264. DOI: 10.1038/nrc3239.
[12] JIANG Y, LI Y, ZHU B. T-cell exhaustion in the tumor microenvironment[J]. Cell Death Dis, 2015, 6: e1792. DOI: 10.1038/cddis.2015.162.
[13] CHENG H, SUN G, CHEN H, et al. Trends in the treatment of advanced hepatocellular carcinoma: Immune checkpoint blockade immunotherapy and related combination therapies[J]. Am J Cancer Res, 2019, 9(8): 1536-1545. http://www.ncbi.nlm.nih.gov/pubmed/31497341
[14] POL J, VACCHELLI E, ARANDA F, et al. Trial watch: Immunogenic cell death inducers for anticancer chemotherapy[J]. Oncoimmunology, 2015, 4(4): e1008866. DOI: 10.1080/2162402X.2015.1008866.
[15] McDONNELL AM, LESTERHUIS WJ, KHONG A, et al. Tumor-infiltrating dendritic cells exhibit defective cross-presentation of tumor antigens, but is reversed by chemotherapy[J]. Eur J Immunol, 2015, 45(1): 49-59. DOI: 10.1002/eji.201444722.
[16] YAU T, KANG YK, KIM TY, et al. Nivolumab (NIVO) + ipilimumab (IPI) combination therapy in patients (pts) with advanced hepatocellular carcinoma (aHCC): Results from CheckMate 040[J]. J Clin Oncol, 2019, 37(Suppl): 4012.
[17] KELLEY R, SANGRO B, HARRIS W, et al. Efficacy, tolerability, and biologic activity of a novel regimen of tremelimumab (T) in combination with durvalumab (D) for patients (pts) with advanced hepatocellular carcinoma (aHCC)[J]. J Clin Oncol, 2020, 38(Suppl): 4508. http://www.researchgate.net/publication/341629249_Efficacy_tolerability_and_biologic_activity_of_a_novel_regimen_of_tremelimumab_T_in_combination_with_durvalumab_D_for_patients_pts_with_advanced_hepatocellular_carcinoma_aHCC
[18] POL J, VACCHELLI E, ARANDA F, et al. Trial watch: Immunogenic cell death inducers for anticancer chemotherapy[J]. Oncoimmunology, 2015, 4(4): e1008866. DOI: 10.1080/2162402X.2015.1008866.
[19] QIN SK, CHEN ZD, LIU Y, et al. A phase Ⅱ study of anti-PD-1 antibody camrelizumab plus FOLFOX4 or GEMOX systemic chemotherapy as first-line therapy for advanced hepatocellular carcinoma or biliary tract cancer[J]. J Clin Oncol, 2019, 37(Suppl): 4074. http://www.researchgate.net/publication/333406920_A_phase_II_study_of_anti-PD-1_antibody_camrelizumab_plus_FOLFOX4_or_GEMOX_systemic_chemotherapy_as_first-line_therapy_for_advanced_hepatocellular_carcinoma_or_biliary_tract_cancer
[20] MAI QC, MO ZQ, SHI F, et al. Lenvatinib plus hepatic arterial infusion of modified FOLFOX regime in patients with advanced hepatocellular carcinoma[J]. J Clin Oncol, 2020, 38(Suppl. e1): 16603. http://www.researchgate.net/publication/341628918_Lenvatinib_plus_hepatic_arterial_infusion_of_modified_FOLFOX_regime_in_patients_with_advanced_hepatocellular_carcinoma
[21] GU YK, ZHANG TQ, HUANG ZL, et al. Hepatic artery infusion chemotherapy combined with apatinib and toripalimab in advanced hepatocellular carcinoma: Real-world data from a single center[J] J Clin Oncol, 2020, 38(Suppl. e1): 6602. http://www.researchgate.net/publication/341637077_Hepatic_artery_infusion_chemotherapy_combined_with_apatinib_and_toripalimab_in_advanced_hepatocellular_carcinoma_Real-world_data_from_a_single_center
[22] HANAHAN D, WEINBERG RA. Hallmarks of cancer: The next generation[J]. Cell, 2011, 144(5): 646-674. DOI: 10.1016/j.cell.2011.02.013.
[23] CHONG EA, MELENHORST JJ, LACEY SF, et al. PD-1 blockade modulates chimeric antigen receptor (CAR)-modified T cells: Refueling the CAR[J]. Blood, 2017, 129(8): 1039-1041. DOI: 10.1182/blood-2016-09-738245.
[24] HECZEY A, LOUIS CU, SAVOLDO B, et al. CAR T cells administered in combination with lymphodepletion and PD-1 inhibition to patients with neuroblastoma[J]. Mol Ther, 2017, 25(9): 2214-2224. DOI: 10.1016/j.ymthe.2017.05.012.
[25] WU X, LUO H, SHI B, et al. Combined antitumor effects of sorafenib and GPC3-CAR T cells in mouse models of hepatocellular carcinoma[J]. Mol Ther, 2019, 27(8): 1483-1494. DOI: 10.1016/j.ymthe.2019.04.020.
[26] GUO X, JIANG H, SHI B, et al. Disruption of PD-1 enhanced the anti-tumor activity of chimeric antigen receptor T cells against hepatocellular carcinoma[J]. Front Pharmacol, 2018, 9: 1118. DOI: 10.3389/fphar.2018.01118.
[27] dal BO M, de MATTIA E, BABOCI L, et al. New insights into the pharmacological, immunological, and CAR-T-cell approaches in the treatment of hepatocellular carcinoma[J]. Drug Resist Updat, 2020, 51: 100702. DOI: 10.1016/j.drup.2020.100702.
[28] CHEN W, CHIANG CL, DAWSON LA. Efficacy and safety of radiotherapy for primary liver cancer[J]. Chin Clin Oncol, 2021, 10(1): 9. DOI: 10.21037/cco-20-89.
[29] QUE J, WU HC, LIN CH, et al. Comparison of stereotactic body radiation therapy with and without sorafenib as treatment for hepatocellular carcinoma with portal vein tumor thrombosis[J]. Medicine (Baltimore), 2020, 99(13): e19660. DOI: 10.1097/MD.0000000000019660.
[30] ZHAO X, SHAO C. Radiotherapy-mediated immunomodulation and anti-tumor abscopal effect combining immune checkpoint blockade[J]. Cancers (Basel), 2020, 12(10): 2762. DOI: 10.3390/cancers12102762.
[31] ZERBINI A, PILLI M, LACCABUE D, et al. Radiofrequency thermal ablation for hepatocellular carcinoma stimulates autologous NK-cell response[J]. Gastroenterology, 2010, 138(5): 1931-1942. DOI: 10.1053/j.gastro.2009.12.051.
[32] LENCIONI R, LLOVET JM, HAN GH, et al. Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate-stage HCC: The SPACE trial[J]. J Hepatol, 2016, 64(5): 1090-1098. DOI: 10.1016/j.jhep.2016.01.012.
[33] KUDO M, UESHIMA K, IKEDA M, et al. Randomised, multicentre prospective trial of transarterial chemoembolisation (TACE) plus sorafenib as compared with TACE alone in patients with hepatocellular carcinoma: TACTICS trial[J]. Gut, 2020, 69(8): 1492-1501. DOI: 10.1136/gutjnl-2019-318934.
[34] DUFFY AG, ULAHANNAN SV, MAKOROVA-RUSHER O, et al. Tremelimumab in combination with ablation in patients with advanced hepatocellular carcinoma[J]. J Hepatol, 2017, 66(3): 545-551. DOI: 10.1016/j.jhep.2016.10.029.
[35] SANGRO B, GOMEZ-MARTIN C, de la MATA M, et al. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C[J]. J Hepatol, 2013, 59(1): 81-88. DOI: 10.1016/j.jhep.2013.02.022.
[36] PARIKH ND, WALJEE AK, SINGAL AG. Downstaging hepatocellular carcinoma: A systematic review and pooled analysis[J]. Liver Transpl, 2015, 21(9): 1142-1152. DOI: 10.1002/lt.24169.
[37] SUN HC, ZHU XD, HUANG C, et al. Combination therapy with lenvatinib and anti-PD-1 antibodies for unresectable or advanced hepatocellular carcinoma: A real-world study[J]. J Clin Oncol, 2020, 38(Suppl. e1): 6610. http://www.researchgate.net/publication/341632504_Combination_therapy_with_lenvatinib_and_anti-PD-1_antibodies_for_unresectable_or_advanced_hepatocellular_carcinoma_A_real-world_study
[38] CHAN SL, ZHU AX, FINN RS, et al. Effect of pembrolizumab (pembro) on hepatitis B viral (HBV) load and aminotransferase (ALT) levels in patients (pts) with advanced hepatocellular carcinoma (aHCC) in KEYNOTE-224 (KN224) and KEYNOTE-240 (KN240)[J]. J Clin Oncol, 2020, 38(Suppl): 4587.
[39] SUN HC, ZHU XD, ZHOU J, et al. Effect of postoperative apatinib treatment after rep of hepatocellular carcinoma with portal vein invasion: A phase Ⅱ study[J]. J Clin Oncol, 2020, 38: 514. http://www.researchgate.net/publication/339038102_Effect_of_postoperative_apatinib_treatment_after_rep_of_hepatocellular_carcinoma_with_portal_vein_invasion_A_phase_II_study
[40] KASEB A, DUDA D, CAO H, et al. Randomized, open-label, perioperative phase Ⅱ study evaluating nivolumab alone or nivolumab plus ipilimumab in patients with resectable HCC[J]. J Clin Oncol, 2020, 38: 486.
[41] PINTER M, SCHEINER B, PECK-RADOSAVLJEVIC M. Immunotherapy for advanced hepatocellular carcinoma: A focus on special subgroups[J]. Gut, 2021, 70(1): 204-214. DOI: 10.1136/gutjnl-2020-321702.
[42] SINN DH, CHOI GS, PARK HC, et al. Multidisciplinary approach is associated with improved survival of hepatocellular carcinoma patients[J]. PLoS One, 2019, 14(1): e0210730. DOI: 10.1371/journal.pone.0210730.
引证本文
欧阳敬中, 周艳召, 朱瑞利, 等. 分子靶向药物与免疫抑制剂联合治疗及其他联合治疗在肝细胞癌中的应用[J]. 临床肝胆病杂志, 2021, 37(4): 925-930.


