Cell Metabolism:不是肥胖本身促进了高血压,而是它!肥胖相关的高瘦素血症会改变下丘脑的胶质血管界面来促进高血压
时间:2021-05-20 14:02:02 热度:37.1℃ 作者:网络
在过去的三十年里,中国的肥胖率急剧上升,已经成为全球第二大肥胖人口大国。肥胖不仅影响美观,肥胖者还容易患高血压、糖尿病、冠心病、高脂血症等疾病。
肥胖相关高血压的发病有多种可能机制,包括瘦素通路改变,胰岛素抵抗,微血管功能紊乱,肾素-血管紧张素-醛固酮系统和交感神经系统激活, 中枢神经系统功能失调,肾脏损伤等,然而,其潜在的病理机制仍需澄清。
2021年5月4日,德国环境卫生研究中心Cristina García-Cáceres、Matthias H. Tsch?p等研究人员合作在《细胞—代谢》杂志上发表了篇为“Obesity-associated hyperleptinemia alters the gliovascular interface of the hypothalamus to promote hypertension”的文章,肥胖相关的高瘦素血症会改变下丘脑的胶质血管界面来促进高血压。

DOI: 10.1016/j.cmet.2021.04.007
首先,研究团队建立了高糖高脂(HFHS)饮食的小鼠模型,并诱导出了小鼠下丘脑的微血管病变。通过实验进一步证实:下丘脑微血管病发生在体重增加的开始,并与血清瘦素增加相一致,而通过饮食诱导的体重减轻和血清瘦素水平的正常化,可逆转小鼠下丘脑的高血流量状态。这都说明尽管下丘脑血管化不受血糖水平升高的调节,但它与下丘脑中促血管生成基因的表达显着增高以及高脂高糖饮食导致的体重增加和血清瘦素水平升高有关。
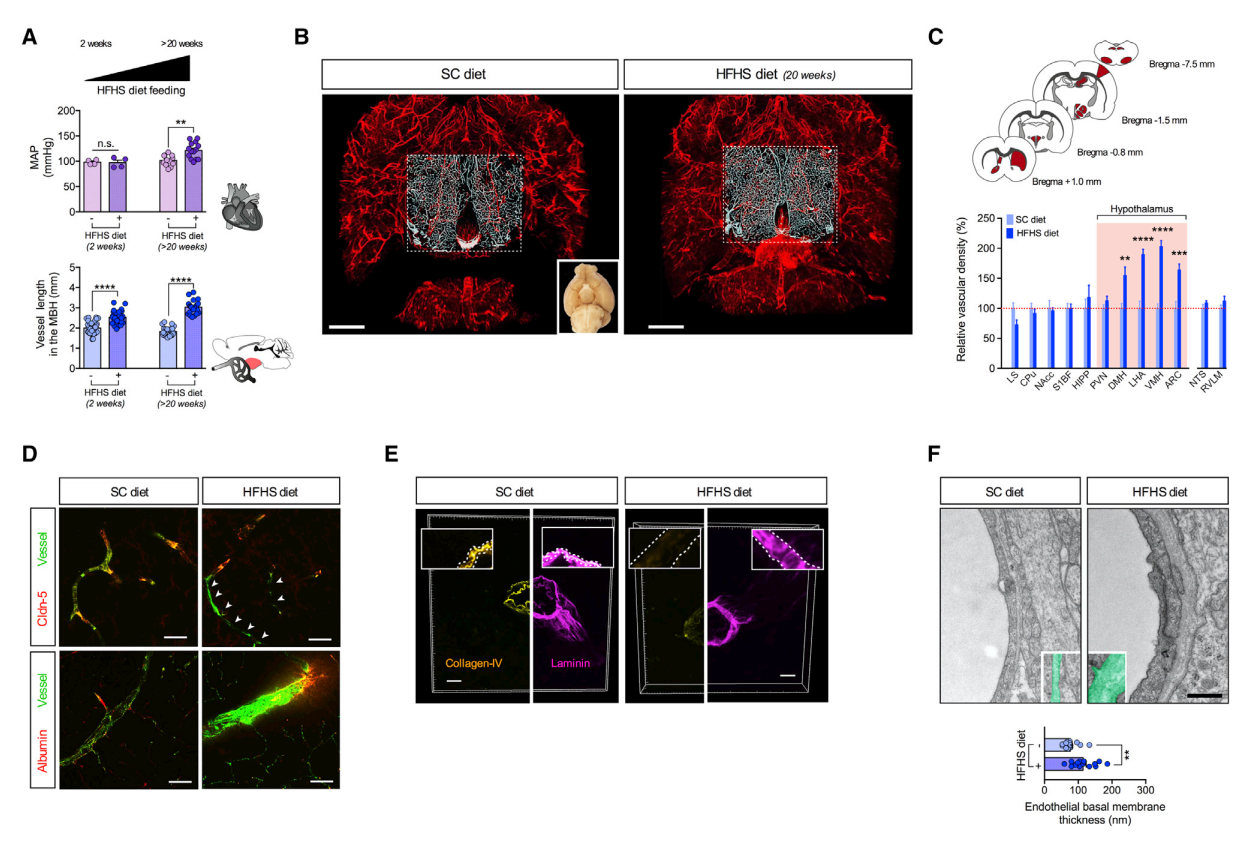
HFHS饮食喂养特别在下丘脑诱发血管性微血管病变
为了鉴别肥胖和瘦素水平之间的相互关系,在功能上弄清下丘脑微血管病是否由HFHS饮食诱导的信号(如瘦素)驱动,而不是肥胖本身,研究人员建立了肥胖饮食瘦素缺乏(Lepob/ob)小鼠和瘦的诱导高瘦素血症的转基因小鼠模型,结果表明外源性瘦素注入小鼠下丘脑血管内皮生长因子(VEGF)表达的上升超过了HFHS饮食喂养2周的效果。
相反,尽管极度肥胖,但VEGF表达水平在Lepob/ob小鼠的下丘脑内侧基底部(MBH)中没有改变。而肥胖瘦素缺乏的Lepob/ob小鼠无论在标准饮食(SC)、HFHS饮食或外源注射瘦素中都具有较低的低氧诱导因子-1(HIF1α)蛋白水平。这些都表明无论肥胖程度如何,瘦素信号是驱动HIF1α-VEGF信号上调和高血运化的决定因素,特别是在肥胖小鼠的下丘脑。
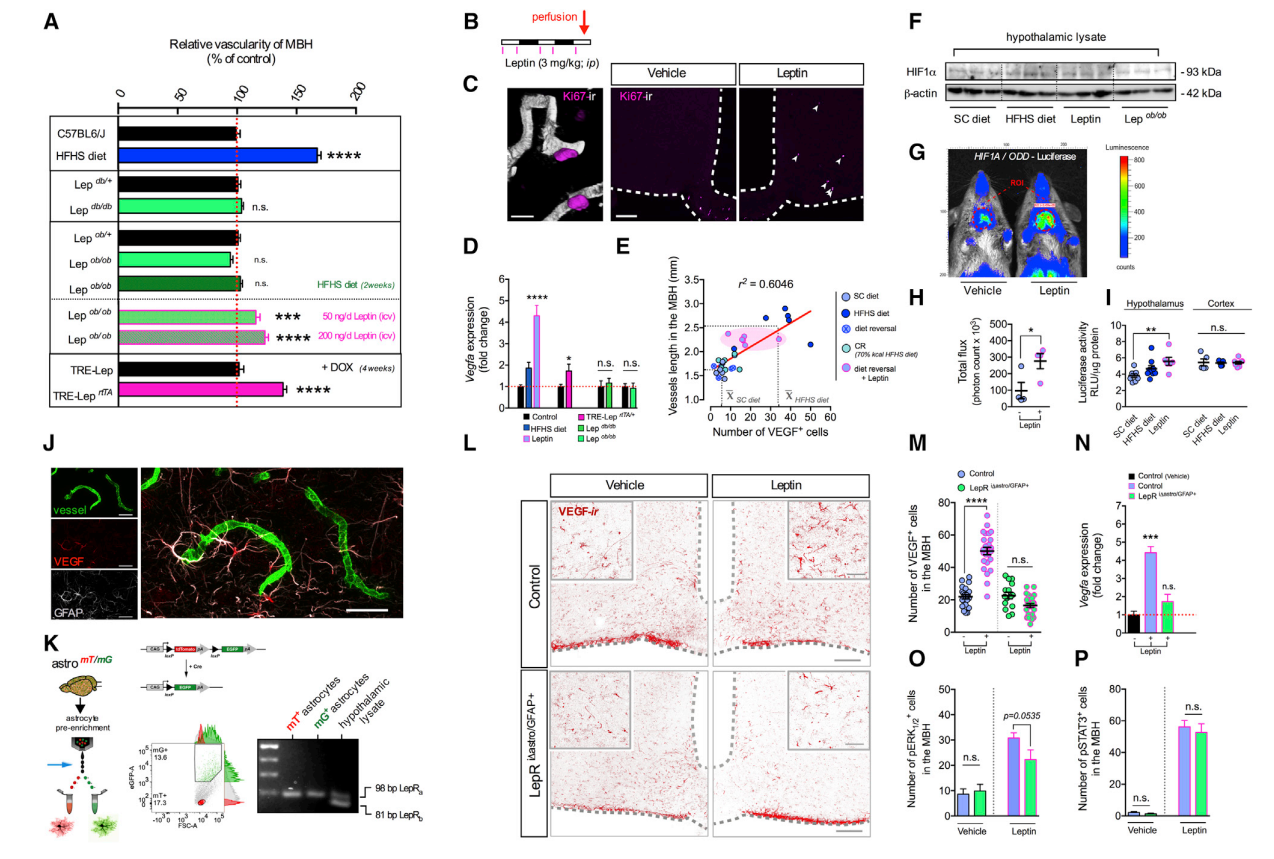
瘦素信号在下丘脑中诱导促血管生成信号
最后,研究人员通过实验证实,星形胶质细胞是HFHS饮食诱导下丘脑内VEGF的主要细胞来源,并且可以进行下丘脑微血管的动态重塑。而下丘脑星形胶质细胞中的瘦素受体可以调节VEGF的产生,星形细胞特异性的HIF1α的缺失可以阻断HFHS饮食诱导的下丘脑VEGF表达和高血管化。重要的是,星形胶质细胞中HIF1α-VEGF途径破坏的几种不同模型不仅受到肥胖引起的下丘脑血管病保护,而且还受到交感神经亢进或动脉高血压的保护。
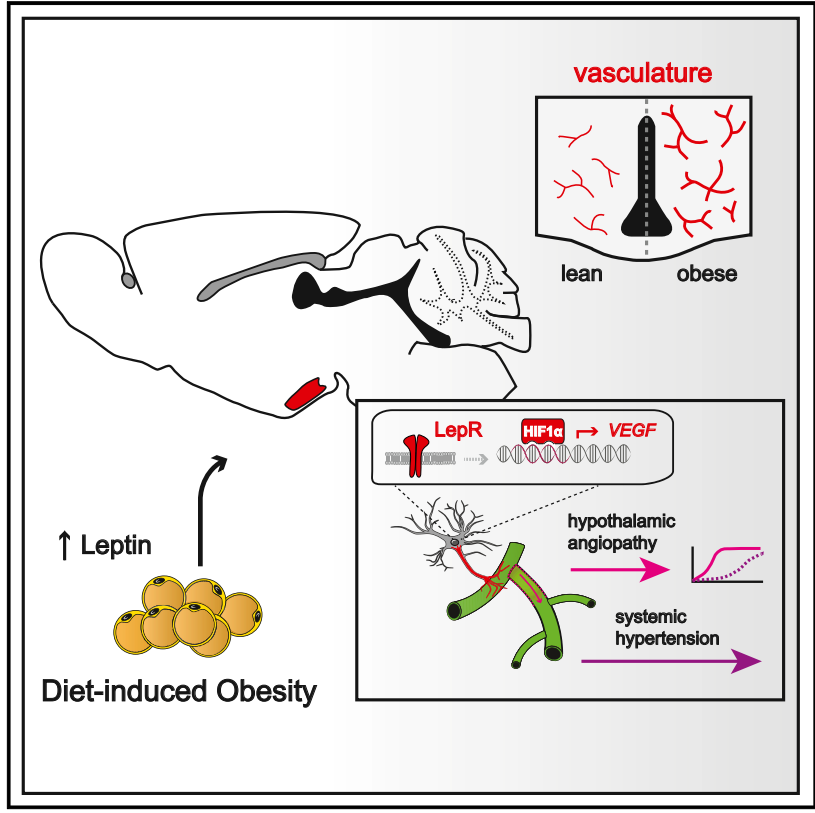
实验机制图
总之,本篇文章报道了与肥胖相关的血清瘦素的增加,触发了调节血液动力学稳态的自主神经前大脑中心微血管结构的选择性扩张。而且这一病理生理过程依赖于下丘脑星形胶质细胞缺氧诱导因子1a-血管内皮生长因子(HIF1a-VEGF),它是瘦素信号的下游。
重要的是,星形胶质细胞中几种不同的HIF1a-VEGF通路破坏模型不仅受到肥胖诱导的下丘脑血管病变的保护,而且受到交感神经过度活跃或动脉高血压的保护。这些结果表明,高瘦素血症通过下丘脑星形胶质细胞中的HIF1a-VEGF信号级联促进肥胖诱导的高血压,同时建立了下丘脑微血管结构与控制全身血压之间的新的机制联系。
原始出处:
Tim Gruber, Chenchen Pan, Raian E. Contreras, et al. Obesity-associated hyperleptinemia alters the gliovascular interface of the hypothalamus to promote hypertension. Cell Metabolism In Press, Corrected ProofPublished online: May 4, 2021.


