oncogene:“令人窒息”的癌症,为什么缺氧微环境反而让肿瘤变得穷凶极恶?
时间:2021-06-29 23:02:56 热度:37.1℃ 作者:网络
缺氧或组织氧合不足是大多数癌症难以根治的关键性因素,同时还会导致癌细胞的耐药性增强。因此,重塑肿瘤的免疫抑制微环境成为改善免疫疗效的新挑战。
近日,卢森堡卫生研究所 (LIH) 肿瘤免疫治疗和微环境 (TIME) 研究组的科研人员在《Nature》子刊《oncogene》杂志发表了一篇题为Targeting HIF-1 alpha transcriptional activity drives cytotoxic immune effector cells into melanoma and improves combination immunotherapy的文章,研究基于一种基因编辑技术,向我们展示了靶向 HIF-1α是如何抑制肿瘤生长,并将细胞毒性T淋巴细胞(CTL)驱动到肿瘤组织内的。
众所周知,肿瘤缺氧主要是由于异常血管化导致的低氧供应与肿瘤细胞的高氧消耗之间存在不均衡导致的,而快速增殖肿瘤细胞会加速氧气的消耗,从而限制了可用于进一步扩散到肿瘤组织中的氧气量。
而癌症之所以难以根治,主要原因就是肿瘤细胞会不断适应所处的不良环境,缺氧诱导因子HIF-1α(Hypoxia Inducible Factor-1 α)作为一种缺氧条件下广泛存在于哺乳动物和人体的一种转录因子,其表达与肿瘤增值、侵袭和转移、肿瘤新生血管生成等特征密切相关。
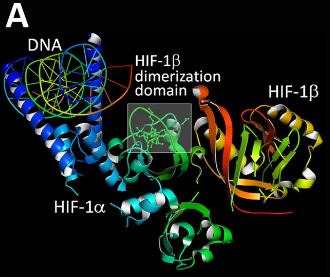
HIF-1α的晶体结构
研究发现,黑色素瘤作为一种高度恶化的皮肤肿瘤,通过激活 HIF-1α,不仅能在缺氧的环境下存活,还能通过劫持重要的免疫系统信号、破坏放化疗等常规抗癌疗法的抗性机制来发挥自身优势。
因此,为了深入了解癌细胞是如何克服缺氧环境,以便找出有效的抗癌疗法,研究人员基于CRISPR 基因编辑技术特异性切除了小鼠体内的HIF-1α/ARNT 二聚化域,并在临床前黑色素瘤小鼠模型中评估了抑制HIF-1α转录活性对肿瘤生长、免疫细胞浸润和免疫治疗的影响。
研究结果显示, HIF-1α下游靶基因如碳酸酐酶 9 ( Ca-9 )、葡萄糖转运蛋白-1 ( Slc2a1 ) 和血管内皮生长因子 ( Vegf )的表达量并未增加,这说明敲除HIF-1α可有效阻断其在黑色素瘤中的转录活性,而阻断 HIF-1α 的转录活性恰好可有效抑制黑色素瘤的生长。
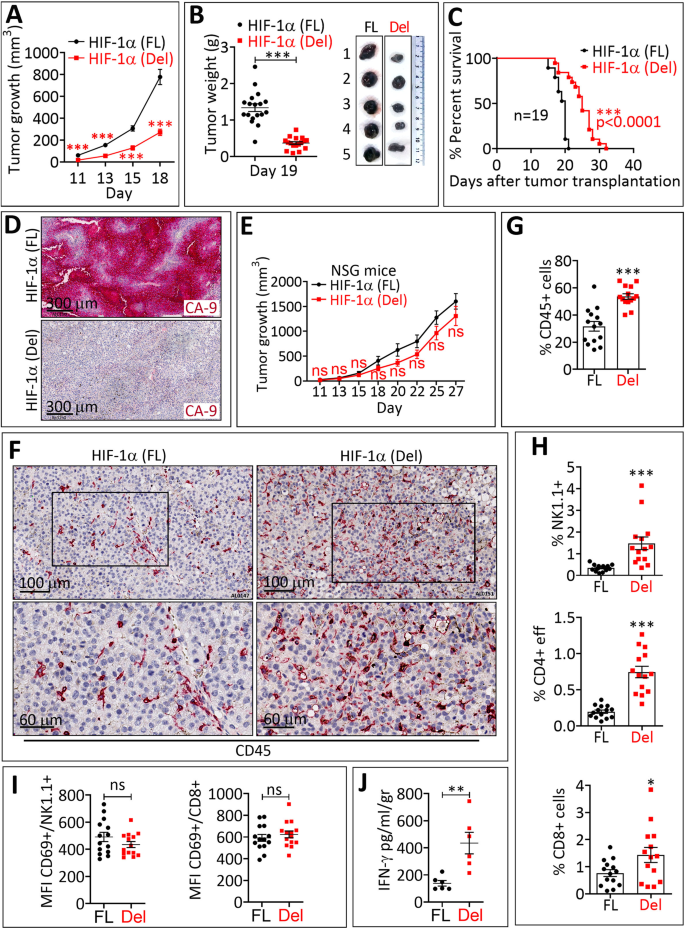
靶向 HIF-1α 的转录活性可抑制肿瘤生长
不仅如此,其肿瘤切片的免疫组织化学 (IHC) 染色结果显示,HIF-1α (Del) 小鼠中并无 CA-9 染色。 此外,研究人员还发现通过增加趋化因子“CCL5”的释放,可促进NK和CD8+T等免疫细胞向肿瘤微环境浸润,促进肿瘤消退。
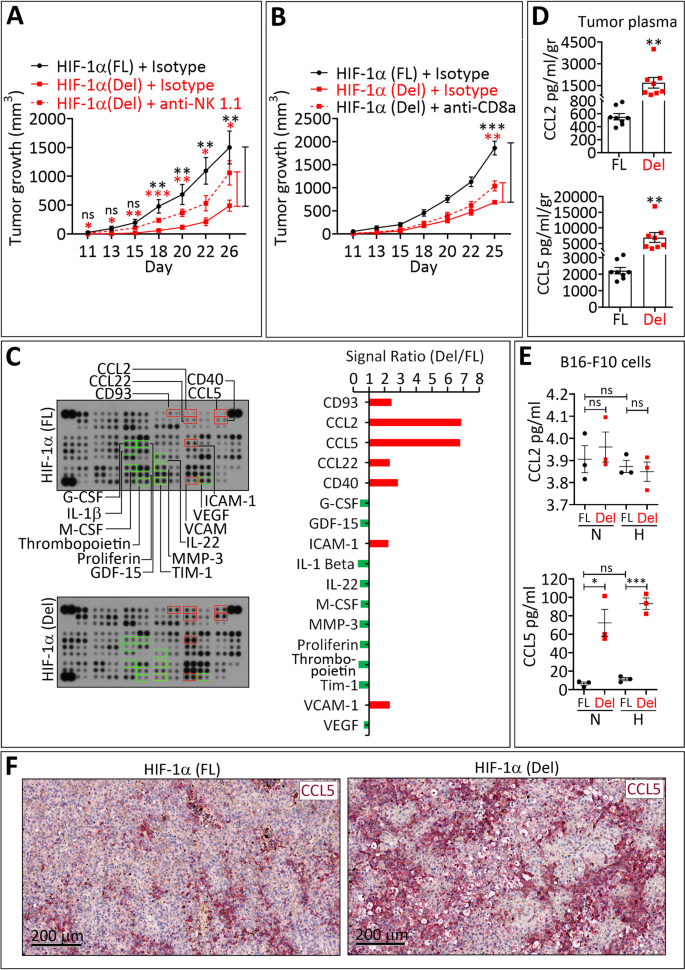
NK 和 CD8 + T 细胞向 HIF-1α Del 肿瘤的浸润与肿瘤细胞释放 CCL5 相关
更重要的是,研究人员还评估了抗肿瘤药物Acriflavine(ACF)与两种免疫疗法(抗 PD-1 免疫检查点阻断抗体与TRP肽疫苗)联合使用对黑色素瘤的治疗效果。令人惊喜的是,该三联疗法(抗 PD-1 + TRP + ACF)可有效抑制肿瘤生长,该结果更加有力的证明了靶向肿瘤微环境中的相关缺氧通路可提高免疫疗法的治疗效果。
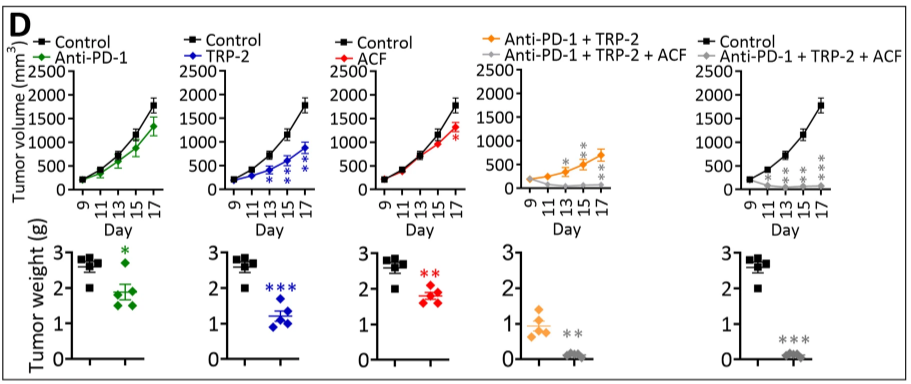
联合 ACF 提高了基于 TRP-2 的疫苗和抗 PD-1 在黑色素瘤中的治疗效果
总而言之,该研究提供了一个极具价值的抗癌新靶点,为癌症患者带来了一线生机,同时为一种新的三重治癌组合策略提供了有力的临床前证据。
原始出处:
Lequeux, A., Noman, M.Z., Xiao, M. et al. Targeting HIF-1 alpha transcriptional activity drives cytotoxic immune effector cells into melanoma and improves combination immunotherapy. Oncogene (2021). https://doi.org/10.1038/s41388-021-01846-x.


