第十届中国罕见病高峰论坛在杭举行,真实世界数据研究在罕见病应用渐入佳境
时间:2021-09-19 20:31:56 热度:37.1℃ 作者:网络

2021年9月10日-12日,第十届中国罕见病高峰论坛在杭州隆重召开。会议以“罕路同行 十载与共”为主题,由蔻德罕见病中心(CORD)、浙江大学医学院、浙江大学医学院附属第二医院联合主办。来自国内外罕见病“政、产、学、研”等不同领域的800余名参会者共聚现场紧紧围绕”以患者为中心“的理念,展开为期三天的深入交流和探讨,多维度透视罕见病行业发展与机遇。
论坛深深扎根于中国罕见病行业不断前行的发展浪潮中,不断延伸与拓展涵盖行业热点,聚集国内外行业顶尖专家,深度剖析行业发展现状,现已发展成为覆盖法规政策、产业、研发创新、遗传咨询、诊断治疗、精准医疗、卫生技术评估、基因治疗、国际交流、创新支付、真实世界数据、临床服务体系、社会支持、产前诊断筛查、辅助生殖、多学科协作、监管审批十七大细分板块。论坛设有三个分会场,其中9月11日下午,“真实世界数据研究在罕见病中的探索与应用”分论坛引发行业关注。
 在“真实世界数据研究在罕见病中的探索与应用”专题会场,梅斯医学董事长张发宝博士主持会议
在“真实世界数据研究在罕见病中的探索与应用”专题会场,梅斯医学董事长张发宝博士主持会议
海南博鳌乐城国际医疗旅游先行区管理局符祝副局长发表“真实世界研究助力罕见病患者药物可及性-乐城经验”专题分享,以海南乐城为例,介绍了真实世界数据、证据在罕见病药物中的应用与前景。
北京大学第一医院医学统计室姚晨主任为大家带来“基于真实世界数据临床研究的设计要点和质量控制”主题分享,姚晨主任提出,“生产合规的、可及的、可溯源的高质量真实世界数据是关键”。同时,向大家介绍了医院在临床科研方面的真实世界数据的探索。
 姚晨,北京大学第一医院医学统计室主任
姚晨,北京大学第一医院医学统计室主任
艾昆纬亚太区真实世界研究与卫生经济负责人谢洋博士带来“罕见病药物临床研究中的挑战和对策”分享,分别从药物临床研究、药物商业化、应用现状、市场准入等方向中真实世界研究的作用介绍了罕见病药物注册和纳入医保所面临的挑战和对策。开心生活科技(HLT)创新医学证据和真实世界研究总监彭茨克博带来“真实世界证据支持罕见病药物开发和生命周期管理”专题分享,从临床开发的角度,介绍了罕见病药物研发中的困难与应对思路。
最后,梅斯医学董事长张发宝博士以“真实世界证据用于罕见病药物领域的进展及思考”为主题进行分享,他提出,“罕见病与真实世界证据是绝配,罕见病有广而少的特点,真实世界证据的作用格外重要”。
张发宝博士指出,罕见病已备受全球关注,FDA有大量的针对罕见病和孤儿病相关政策。FDA已支持自然病程对照与回顾性的医疗记录结果,也可以用于罕见病治疗药物申报与新药开发。原则上,罕见病治疗药物的NDA的要求是提供adequate and well-controlled (A&WC) 的试验结果即可,可以是自然史研究,甚至可以是基于电子病历的研究结果。
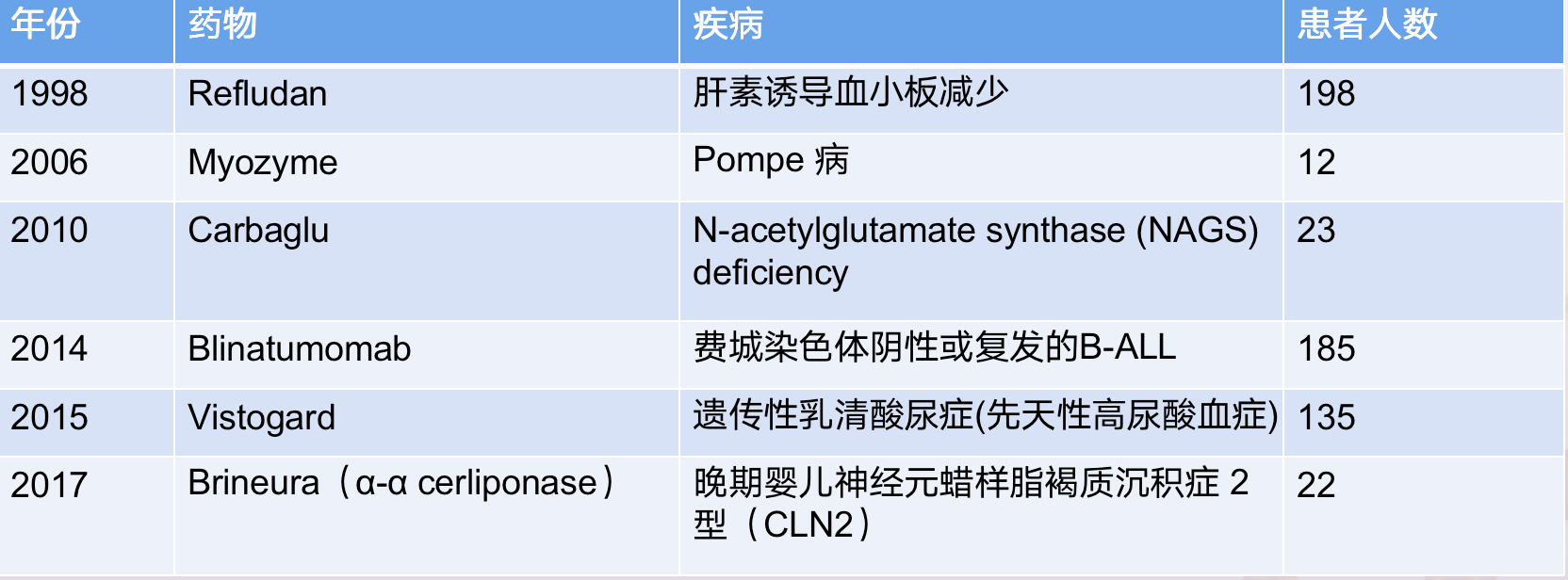
2019年FDA发布了Rare Diseases: Natural History Studies for Drug Development Guidance for Industry
到2020年前共有34个RWE提交到FDA作为适应症审批,最终有82%产品获得了孤儿药称号,在 59% 的产品,RWE 包含在产品标签中。其中肿瘤、血液、神经领域占比最高。从1983年,全美仅有38种孤儿药批准上市,再到现在美国FDA已颁发了5712个“孤儿药资格”,最终获批的药物数量为930个,而近年来,孤儿药占越来越高,2020年获批药品占比达58%,张发宝博士介绍道。
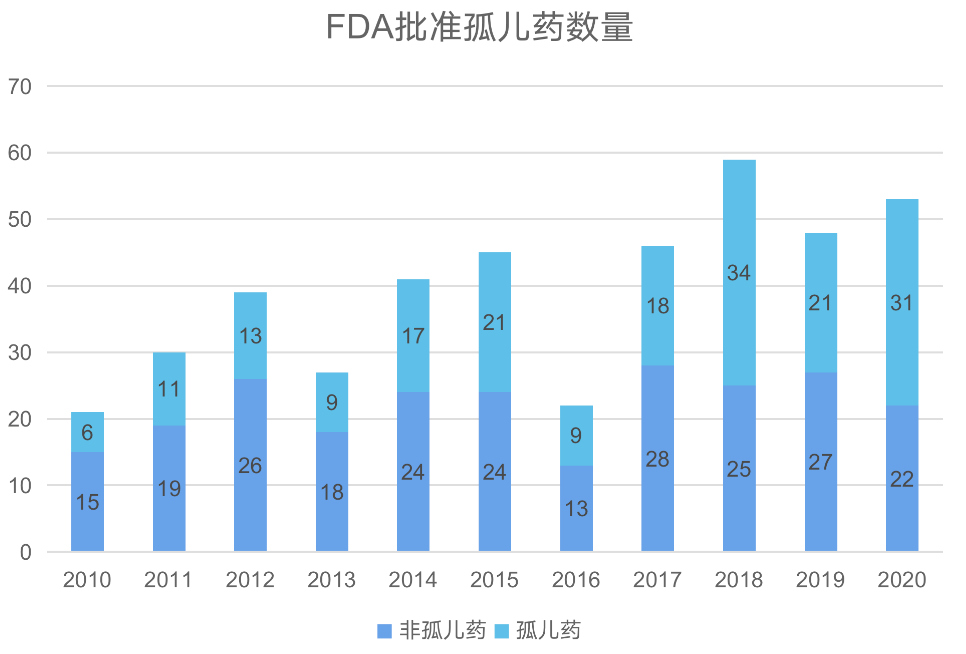
让人欣喜的是,我国在罕见病药物领域也取得重要进展。国内批准上市孤儿药,也越来越多。国内的罕见病政策也正在逐步形成,也给中国新药研发带来机遇。得益于《ICH E11 补充文件:用于儿科人群的医学产品的临床研究》 《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》的政策实施,2020年NMPA共批准了53款新药,其中进口新药32个,国产新药21 个,其中9款是罕见病药物。
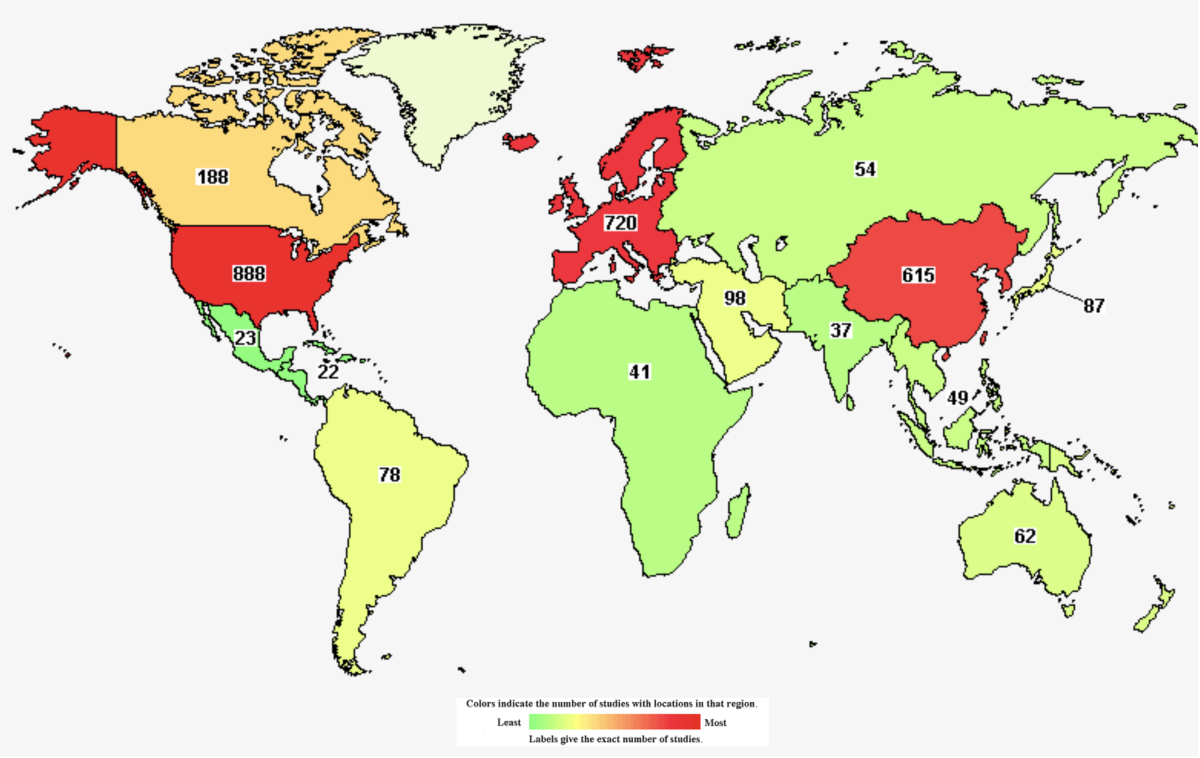 全球真实世界研究概况
全球真实世界研究概况
在全球真实世界研究方面,中国已经成为仅次于美国,欧盟的第三大真实世界研究大国。张发宝博士总结道,我们需要患者及家庭、政府、罕见病组织、药械企业和医学外包企业携手同行,共克罕见病。
值得一提的是,梅斯医学在实世界研究领域已经探索多年,作为国内最早参与罕见病真实世界研究和医学事务服务的主要公司之一。据了解,梅斯医学目前参与了多项罕见病相关工作,除肿瘤、血液系统相关孤儿药外,还参与诸如法布雷病、糖原贮积症 阵发性睡病、脊髓性肌萎缩症(SMA)、肺动脉高压、戈谢病等多种罕见病的相关工作。
就在今年在其主办的2021第五届RWE真实世界研究峰会上与浪潮健康在达成战略合作,双方将致力于真实世界研究服务、医疗数据的创新产品探索,整合医药卫生行业数据需求,共同开展药械科研、临床研究、市场洞察等业务合作,这将推动双方真实世界研究的创新变革规范。
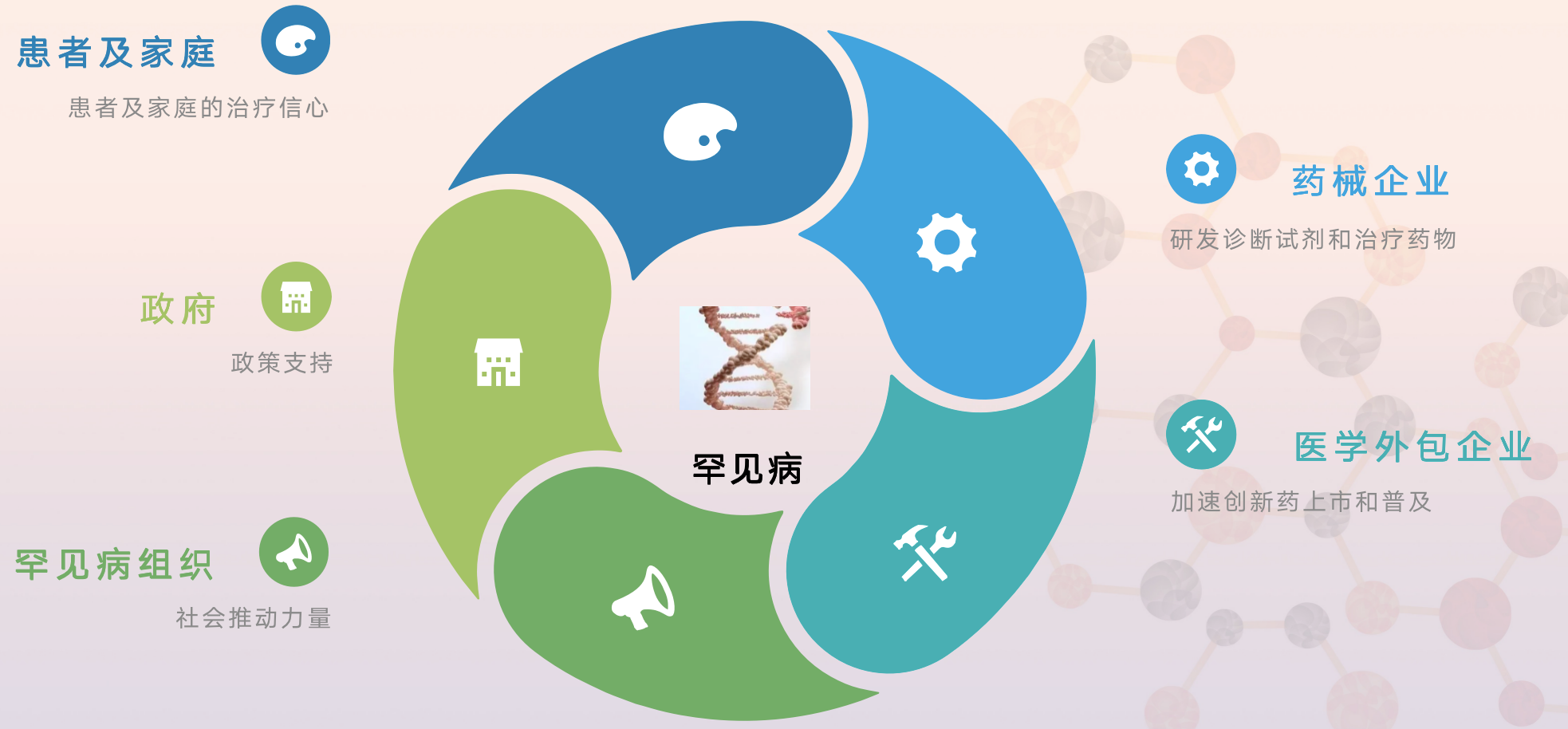 来源:携手同行,共克罕见病,张发宝博士讲义
来源:携手同行,共克罕见病,张发宝博士讲义
除了罕见病外,在新冠大流行背景下,新冠药物、疫苗等越来越多的真实世界研究结果出炉也显示出真实世界研究的积极作用。国家监管机构及相关企业正在不断落地,通过新方法、新工具的研究和应用,加速药品与器械创新研发进程和科学监管。
我们相信真实世界研究体系及监管体系都将会不断地完善,真正让真实世界研究最新成果应用于临床实践中,最终造福广大患者。也正如张发宝博士所说的那样,需要患者及家庭、政府、罕见病组织、药械企业和医学外包企业携手同行,共克罕见病!
参考资料:罕见病信息网


