慢性肺病患者的尿 Dickkopf-3 与肾损伤
时间:2021-11-09 18:01:44 热度:37.1℃ 作者:网络

全球超过 8.5 亿人患有慢性肾病 (CKD),这是工业化国家生命年损失的第 11 大最重要原因(不包括自残和道路伤害)。由于缺乏症状,疾病的早期阶段可能仍未被识别,并且识别有发生疾病和进展风险的患者通常依赖于患者病史和生物标志物。不幸的是,数据最支持的生物标志物—估计肾小球滤过率 (eGFR) 和蛋白尿—定义了已确诊的 CKD,并且在可能保留肾功能的情况下缺乏诊断、预后和预测的敏感性和特异性。
尽管如此,我们知道在根据目前的标准诊断出明显的 CKD 之前,可能会发生功能下降和潜在的不可逆结构损伤。因此,新颖和创新的生物标志物应能检测出迄今为止临床上“无声”的疾病,并为发展为明显 CKD 的风险提供预后信息。此外,它们理想地提供了对普遍病理生理学的洞察,从而支持有针对性的预防措施。
在这种情况下,Schunk 等人在本期中介绍了有关 Dickkopf 相关蛋白 3 (DKK3) 的有趣新数据。受压的肾小管上皮细胞分泌 DKK3,它参与 Wnt/β-catenin 信号通路并引发炎症,最终导致肾小管萎缩和间质纤维化,这是病因多样的肾脏疾病的共同特征。尿 DKK3 与退行性和免疫性肾病患者的肾活检中发现的肾小管间质纤维化程度密切相关。在确诊 IgA 肾病的患者中,DKK3 的尿浓度优于 eGFR 和蛋白尿,可在短期随访中识别进展性 CKD 的高风险患者。在接受择期心脏手术的患者中,围手术期 DKK3 是术后急性肾损伤及随后肾功能丧失的独立预测因子。6 DKK3 即使在表面健康的个体中也可以在血液中检测到,但尿液中的浓度非常低,甚至无法检测到大多数受试者来自一般人群。因此,尿液中 DKK3 的大量排泄很可能是肾内扰动的结果。
在 Schunk 等人的研究中,研究人员在稳定的慢性阻塞性肺疾病 (COPD) 患者的纵向观察队列中测试了尿 DKK3 浓度作为与病理生理学密切相关的预后生物标志物的潜力。患者在基线时具有保留的肾功能,平均 eGFR 为 82.0 ± 16.4 ml/min/1.73 m2,中位蛋白尿为 5.0 (6.0) mg/g 肌酐。 DKK3 浓度 > 200 pg/mg 肌酐,但不包括 eGFR 或蛋白尿,与风险显着增加相关,>10%(优势比,1.49;95% 置信区间,1.03-2.15),>15%(优势比, 1.72;95% 置信区间,1.07–2.74),以及 18 个月随访后 eGFR 下降 >20%(优势比,2.59;95% 置信区间 1.28–5.25)。在 eGFR > 90 ml/min/1.73 m2 和蛋白尿 <30 mg/g 肌酐的患者亚组中获得了相同的结果。重要的是,在 DKK3 水平高于或低于 200 pg/mg 肌酐的患者之间,高血压、心力衰竭或糖尿病等合并症的患病率没有差异。
根据这些数据,DKK3 能够识别患有 COPD 且基线肾功能正常且 eGFR 丢失风险增加的个体。值得注意的是,这些个体不会被基线 eGFR 或蛋白尿所识别。由于蛋白尿的存在与否不会改变这种关联,因此人们可能会争辩说,导致 DKK3 排泄增加(例如,肾小管压力和炎症)的病理生理学不同于导致蛋白尿或白蛋白尿的病理生理学。 Zewinger 等人得出了相同的结论,他们还表明,在 IgA 肾病患者中,DKK3 的变化与 eGFR 的短期损失显着相关,与蛋白尿无关。
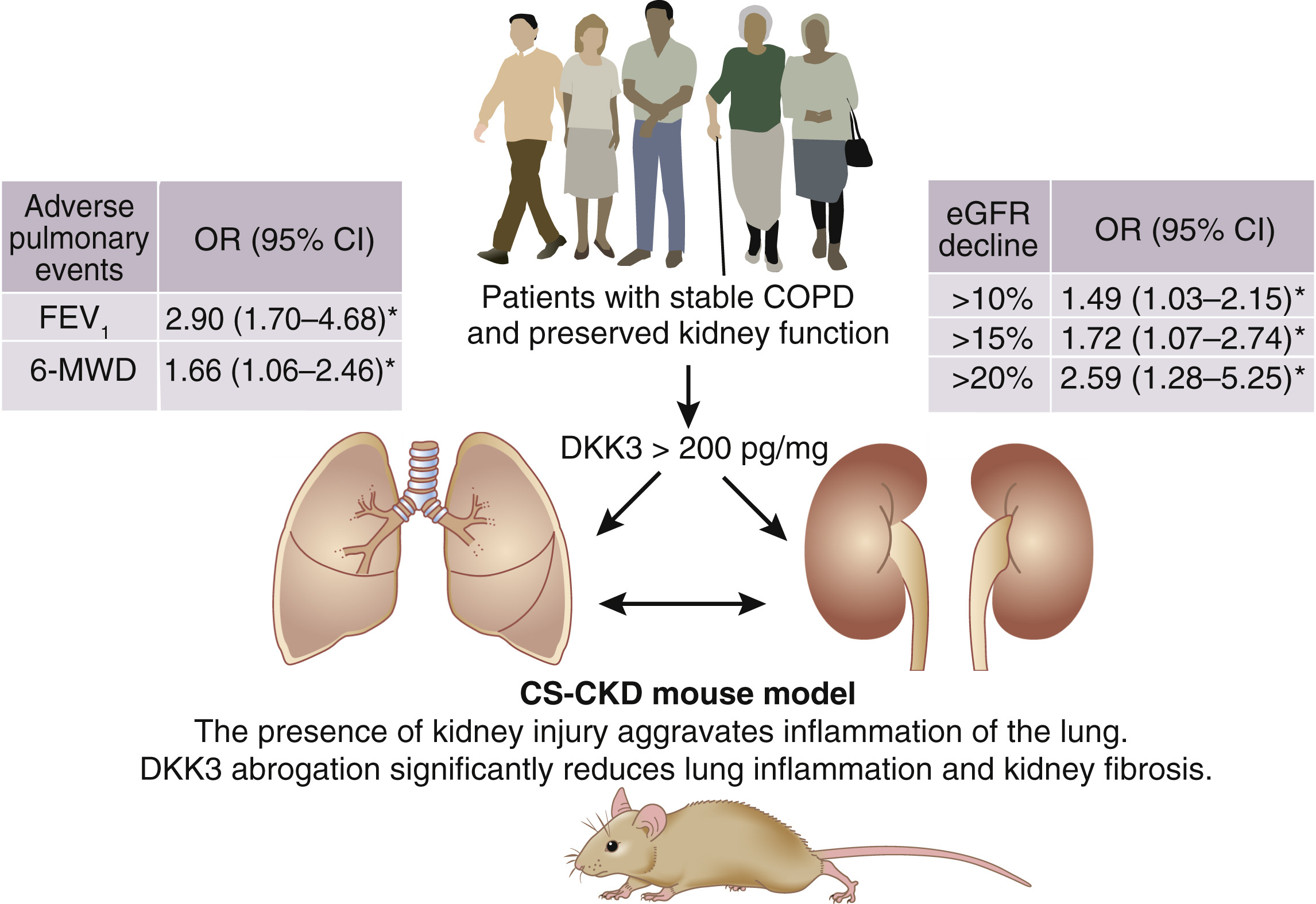
CKD 患者经常患有合并症,近年来,越来越多的证据表明这种共存以双向方式触发疾病进展。一个众所周知的有害相互作用的例子是所谓的心肾综合征。尽管肺肾综合征也有很好的描述(例如,抗中性粒细胞胞质自身抗体相关的血管炎或 Goodpasture 综合征),但 Schunk 等人的文章。现在为这两个器官之间的联系提供了新的证据。除了预测 eGFR 的逐渐减少外,尿液中的 DKK3 浓度还与 1 秒内用力呼气量的下降有关。有趣的是,白蛋白尿作为肾脏疾病的标志物,也存在于约 24% 的 COPD 患者中,与肺功能、气体交换能力和缺氧呈负相关。 2017 年,Polverino 等人描述了与香烟烟雾暴露相关的慢性肾脏和肺部病变同时发生。COPD 患者的肾小球、肾小管、间质和血管慢性损伤以及内皮损伤比对照组更严重。
此外,COPD 患者和暴露于香烟烟雾的小鼠的肾脏和肺内皮细胞中都存在氧化应激增加的迹象。舒克等人在联合损伤小鼠模型(腺嘌呤饮食和香烟烟雾吸入)患者中证实了他们的临床发现。两种干预措施都会在肾脏中诱导炎症和 DKK3 表达,并且它们的组合对损伤的影响不仅仅是相加的。相反,废除 DKK3 可减少肾纤维化和肺部炎症并改善肾功能。
尽管有这些可靠的数据,但仍然存在一些悬而未决的问题和局限性:该队列包括没有 CKD 的参与者和有限的随访期。因此,选择的终点(与基线相比 eGFR 下降高达 20%)与 CKD 研究中常规应用的终点不同。
关于肺 DKK3 作用的数据是初步的,其在调节 Wnt/β-catenin 信号通路中的作用仍存在争议。因此,有必要进一步研究所涉及的确切机制。使用的小鼠模型持续时间很短(3 周),并且对所描述的慢性人类情况的适用性仍然存在争议。DKK3 的分子量为 38 kDa,应该可以被肾脏自由过滤。因此,尚不清楚为什么尿液中 DKK3 的浓度可能比血浆中的浓度低近千倍。9 DKK3 可能与血浆蛋白高度结合,从而在很大程度上阻止了肾小球滤过。
然而,这个假设还需要验证。在 CKD 队列研究中,发现较高的尿 DKK3 浓度(例如,4000 pg/mg)与不良肾脏结局相关,但在本研究中,作者定义了 >200 pg/mg 肌酐的临界值。为 DKK3 在疾病的不同阶段作为生物标志物的应用寻找临床可靠的临界值可能具有挑战性,需要进一步研究。总之,尿 DKK3 浓度能够识别患有 COPD 且肾功能正常的个体中存在进行性 eGFR 下降风险的患者,该人群通常不被认为具有高肾风险。尿 DKK3 浓度也与 1 秒内用力呼气量恶化有关。
综上所述,Schunk 等人的数据支持 DKK3 与涉及两个器官的因果途径相关的概念(见图)。进一步的研究应该解决患者从尿 DKK3 浓度测量中实际受益的问题。
参考文献:
Thöni S, Mayer G. Urinary Dickkopf-3 and kidney injury in patients with chronic pulmonary disease. Kidney Int. 2021 Nov;100(5):983-985. doi: 10.1016/j.kint.2021.08.012. PMID: 34688388.


