Nat Med:深度基因测序识别新的血管异常基因突变,超60%患者受益于相关靶向治疗
时间:2023-07-16 23:12:39 热度:37.1℃ 作者:网络
近期,美国费城儿童医院(CHOP)的研究团队及合作者在Nature Medicine发表了题为“Genomic profiling informs diagnoses and treatment in vascular anomalies”的文章。研究团队基于FFPE分离的DNA或来源于具有潜在生命威胁的血管异常患者cfDNA进行深度测序,能够可靠地识别血管异常的基因突变,而这些基因突变是常规基因测序方法无法捕获的。研究显示,超过60%的患者在接受新发现基因突变的相关靶向治疗后,病情有所改善。因此,研究团队认为临床实验室可以考虑采用深度测序的综合方法来建立血管异常的分子诊断,尤其是原发性复杂淋巴异常(pCLA)。

血管异常是指影响静脉、动脉和淋巴系统的畸形或肿瘤。血管异常是由调节细胞生长和血管发育基因中的致病性变异引起的。虽然有硬化疗法、栓塞术或手术等干预措施,但是复杂或广泛的血管异常往往难以治疗。
此前,费城儿童医院(CHOP)的研究人员发现了第一个影响淋巴系统的血管异常基因变异,使临床医生能够改变现有药物的用途来治疗患者。研究团队认为,其他受血管异常影响的患者可能也携带导致疾病的突变,这些突变有可能帮助患者从靶向治疗中受益。但缺乏获得受影响组织样本或基因组测序信息不足意味着这些基因变异可能无法通过常规基因检测捕获。
文章共同通讯作者、CHOP综合血管异常前沿项目的联合首席研究员Hakon Hakonarson博士表示:“虽然一些患者的基因突变可以在血液样本中找到,但大约90%的血管异常患者携带的是体细胞突变,或非遗传突变,这些突变出现的频率非常低,仅在某些细胞或组织类型中存在。在许多情况下,目标基因的致病变异出现频率不到1%,这使得它们很难用传统的测序方法检测到。”
研究人员对356名血管异常患者组成的队列进行了深度基因测序,包括104名pCLA患者。根据国际血管异常研究学会(ISSVA)对血管异常的分类,该队列包括三个主要疾病类别:血管畸形、血管肿瘤和未分类的血管异常,血管畸形病例的进一步划分详见图1c。
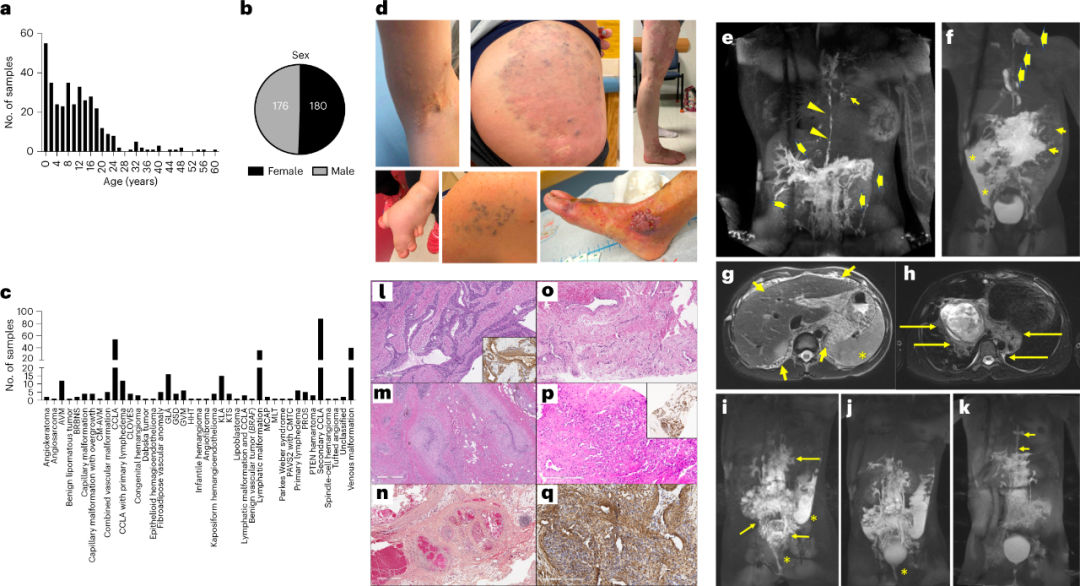
图1. 研究队列临床概况。
研究人员依据多种样本类型实施了分层测试策略,以检测具有不同变异等位基因频率的体细胞变异(VAF)。当由于患者不建议对受影响的病变进行活检时,则收集用于cfDNA分离和内皮细胞富集的乳糜液和血液,作为替代的样本类型(图2a,c)。
对由多学科团队诊断为pCLA的参与者(n = 104),研究人员对其血液或唾液的gDNA进行了常规外显子组测序(平均76×;图2b,e),深度外显子组测序主要与组织活检相结合(平均470×;图2b,f)。结果显示,15名pCLA参与者中有4名,60名血管畸形参与者中有46名(图3b),11名血管肿瘤参与者中有5名检测到P/LP变体,即诊断率为64.0%(55/86),VAF范围为2.3%至32%。
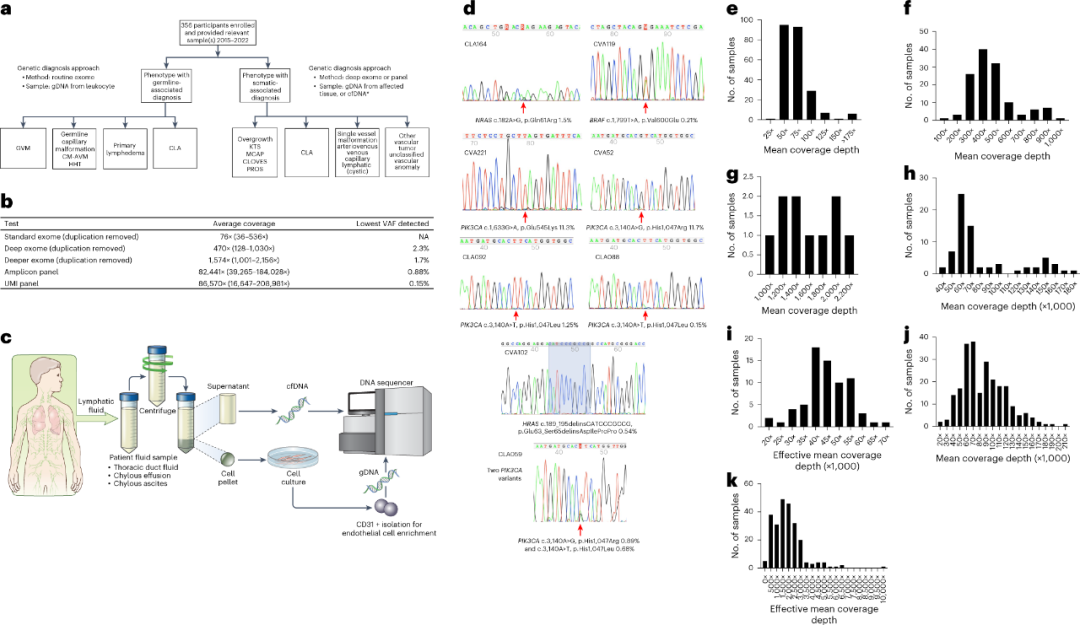
图2. 研究方法和技术。
在104名pCLA患者中,外显子组测序分析诊断出17名(16.3%)致病/可能致病(P/LP)变异,6名(图3b)意义未明(VUS)变异。对通常由胚系变异引起的表型(包括球静脉畸(GVM)、原发性淋巴水肿、毛细血管畸形-动静脉畸形(CM-AVM)、遗传性出血性毛细血管扩张症(HHT)和Parkes Weber综合征)进行了常规外显子组测序(n = 13;图3b),并确定13名患者中有10名存在P/LP变异,有1名存在VUS变异。在仅有FFPE样本的43名患者中,22名患者实现了分子诊断(图3c),VAF范围为0.52%至31.5%,表明FFPE可用于解析遗传性病因。
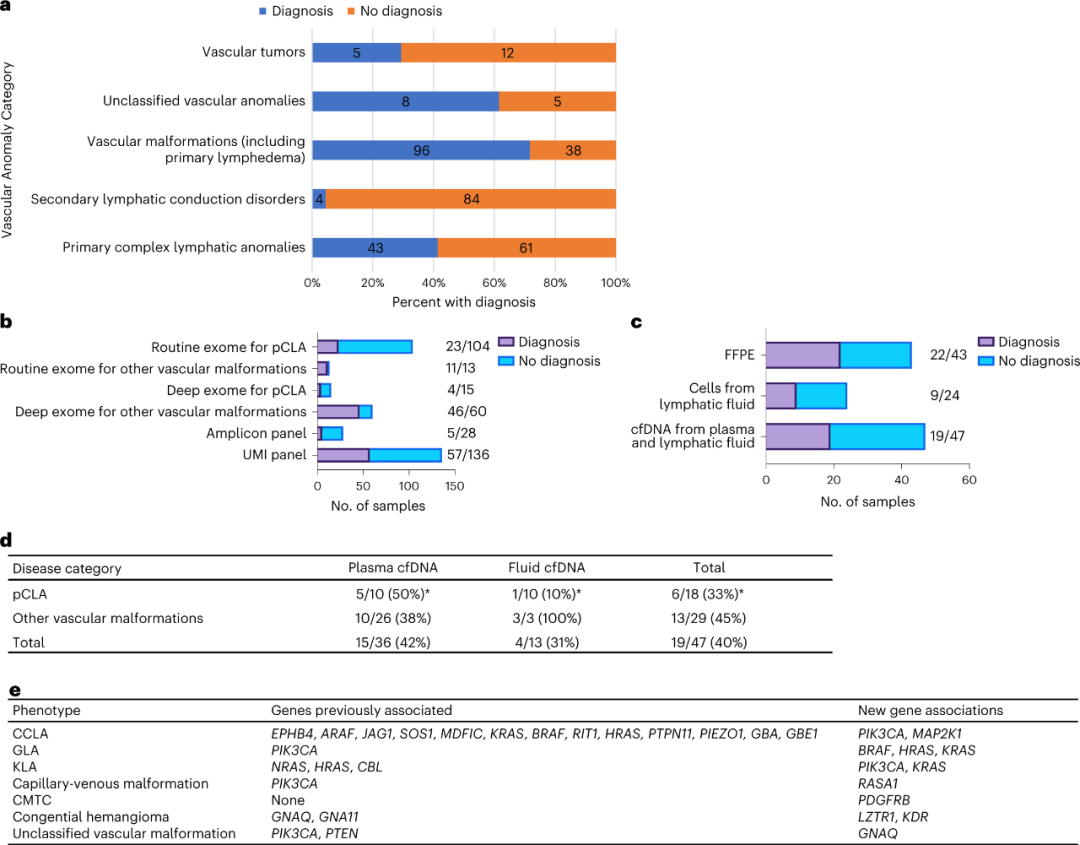
图3. 分子产率和发现。
基因层面的发现可以提供更新的诊断或双分子诊断,指导药物管理,以此来影响医疗保健决策。在这项研究中,超过40%(69/156)接受基因诊断的参与者正在接受药物治疗或计划开始药物治疗(图4a)。基因检测结果支持了36%(25/69)已接受药物治疗的参与者的药物选择,使得25%(17/69)的参与者改变或计划改变治疗,38%(26/69)的参与者开始或计划开始治疗(图4b)。
41%的pCLA参与者和72%的其他血管畸形参与者获得了分子诊断,获得了以前未描述的遗传性病因,帮助63%(43/69)的参与者接受了新的药物治疗,并使63%(35/55)的参与者在治疗中得到了改善。最后,为了确认已识别变异的致病作用并为治疗选择提供支持信息,研究人员在斑马鱼模型中对一些变异进行了功能性表征。
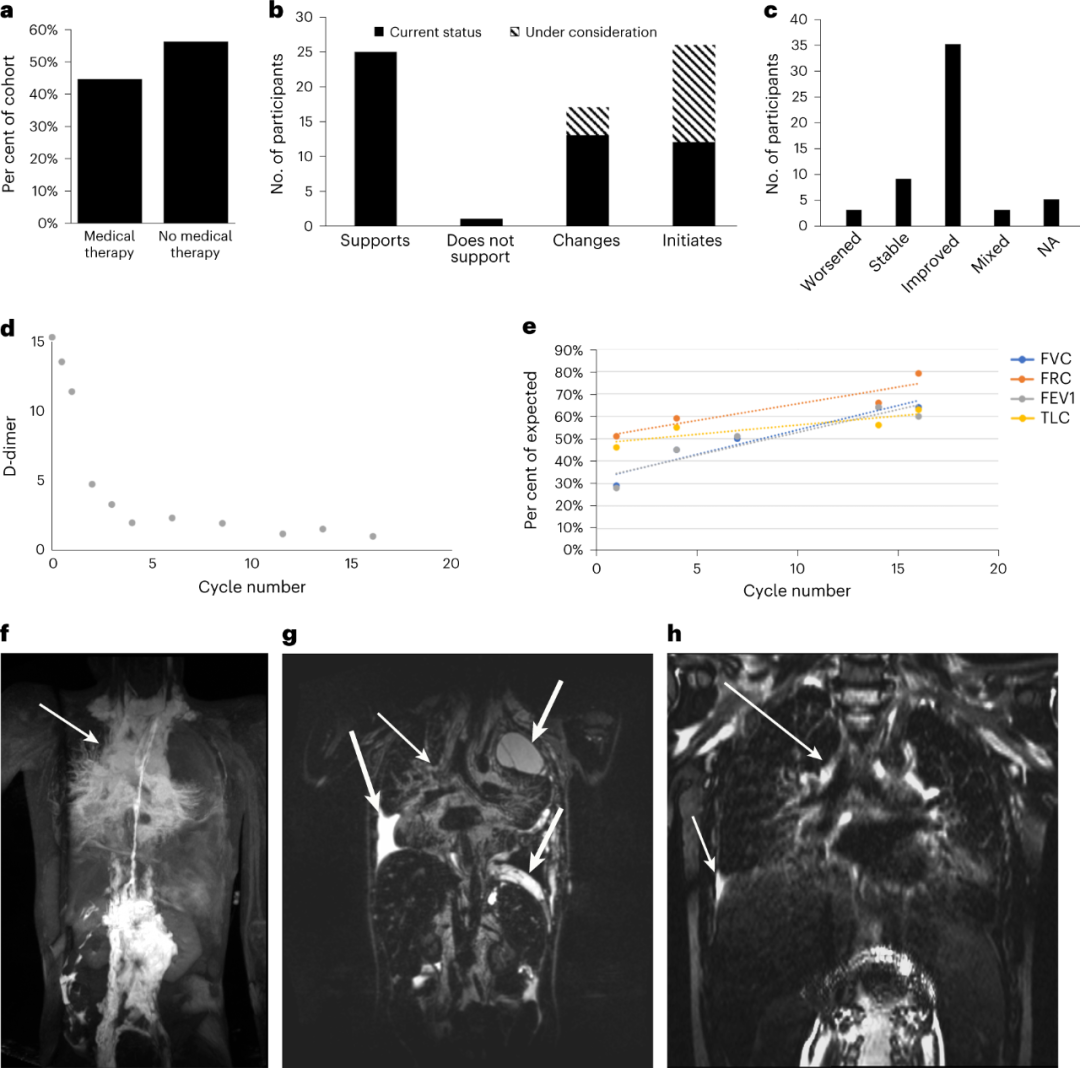
图4. 分子检测的医学影响。
该研究对参与者分离的DNA进行了深度测序,包括对基因组中部分区域进行多次重复测序,并首次发现了一些体细胞变异,解决了356名血管异常患者中156名(43.8%)的分子诊断问题。当可以获得高质量的组织样本时,深度外显子组测序是一种有效的策略,特别是对于双诊断。基于UMI的较小基因panel能够提供足够的测序深度,以及一种稳健的方法来从FFPE分离的DNA或血浆和乳糜液来源的cfDNA中识别血管异常的基因变异。使用的cfDNA是一种有潜力的替代性、侵入性较小的采样策略,临床实验室可以考虑采用这种综合方法来建立血管异常(尤其是 pCLA)的分子诊断。
文章共同通讯作者、CHOP应用基因组学中心助理教授Dong Li博士表示:“该研究发现为cfDNA技术的未来应用铺平了道路,使其成为一种创新的、非侵入性的分子诊断方法,适用于所有血管异常患者。我们认为,现在是时候改变对这些复杂疾病的理解,开发针对这些潜在危及生命疾病的新疗法了。”
参考资料:
1.Li, D., Sheppard, S.E., March, M.E. et al. Genomic profiling informs diagnoses and treatment in vascular anomalies. Nat Med (2023). https://doi.org/10.1038/s41591-023-02364-x
2.https://medicalxpress.com/news/2023-06-deep-sequencing-previously-undescribed-genetic.html


