一作兼通讯!Nature系列综述:抗体偶联药物最新进展与挑战
时间:2023-07-18 23:13:34 热度:37.1℃ 作者:网络
抗体-药物偶联物(ADCs)结合了单克隆抗体的特异性和高细胞毒性药物的效力,通过优先靶向其有效载荷到肿瘤部位,潜在地降低了副作用的严重程度。ADCs正越来越多地与其他药物联合使用,包括作为一线癌症治疗。随着生产这些复杂疗法的技术日趋成熟,更多ADCs已获批或处于后期临床试验阶段。抗原靶点的多样化以及生物活性有效载荷正在迅速扩大ADCs的肿瘤适应症范围。
此外,新的载体蛋白格式以及靶向肿瘤微环境的弹头有望改善ADCs在肿瘤内的分布或激活它们对难以治疗的肿瘤类型具有抗癌活性。然而,在这些药物的开发中,毒性仍然是一个关键问题,更好地了解和管理ADCs相关的毒性将是进一步优化的关键。

基于此,法国里昂大学Charles Dumontet教授综述了ADC用于癌症治疗的最新进展和挑战。相关工作以“Antibody–drug conjugates come of age in oncology”发表在《Nature reviews drug discovery》。
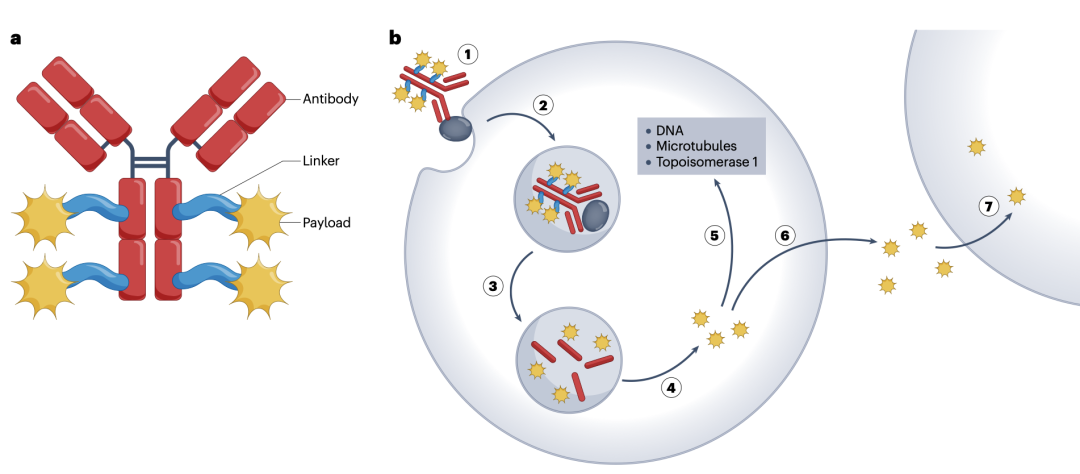
图1. 常规ADCs的结构和作用机理
抗体-药物偶联物(ADCs)被描述为癌症治疗的“灵丹妙药”,因为它们将抗体部分的肿瘤靶向特性与细胞毒性药物的效力结合起来。ADCs是一种复杂的治疗剂,由三个关键成分组成:抗体、连接体和有效载荷(图1)。
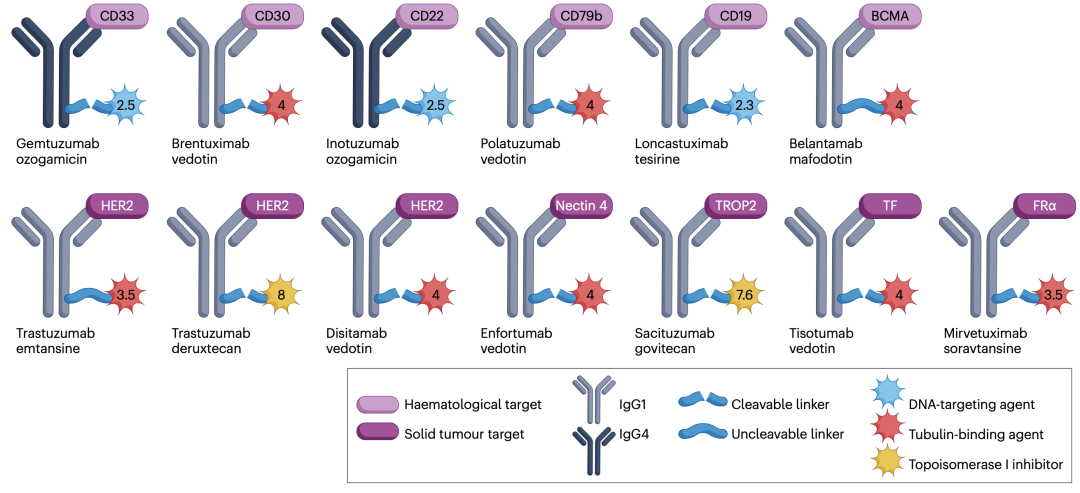
图2. 经批准的ADCs的主要特性
经批准的ADCs
目前有13种获批ADCs在全球上市(图2),其中6种靶向血液恶性肿瘤中的6种不同抗原(CD33、CD30、CD22、CD79b、B细胞成熟抗原(BCMA,也称为TNFRSF17)和CD19), 7种靶向实体肿瘤中的5种不同抗原(HER2、nectin-4、肿瘤相关钙信号传感器2 (TACSTD2,也称为TROP2)、组织因子和叶酸受体α (FRα))。一个ADC-曲妥珠单抗-duocarmazine于2022年12月在美国接受监管审查(FDA预计将于2023年5月12日采取行动),另外两种ADCs (datopotamab derux-tecan和tusamitamab ravtansine)的上市申请将于2023年提交。有趣的是,批准的ADCs是基于铰链半胱氨酸(DAR 4至8)或随机赖氨酸偶联(DAR 2/3至5)。到目前为止,它还没有在临床上取得成功。许多这样的ADCs在临床失败-卡尔审判阶段I, II。
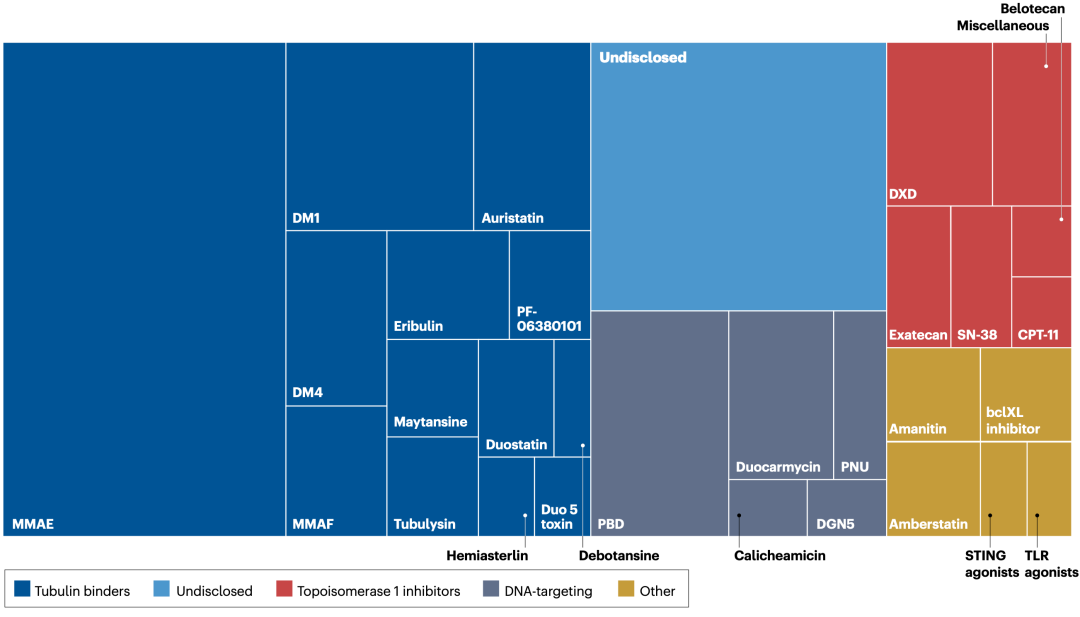
图3. ADC中的负载多样性
负载多样性
在2019年曲妥珠单抗德鲁西替康获批之前,上市ADCs的有效载荷主要分为两大类:微管蛋白结合剂和DNA靶向剂。然而,大量其他药物已被评估为潜在的有效载荷。干扰微管蛋白聚合动力学的Auristatin衍生物通过破坏有丝分裂纺锤体形成发挥强大的作用,导致有丝分裂阻滞导致细胞死亡。此外,Auristatins诱导免疫原性细胞死亡,因为它们能够在肿瘤细胞表面引起错误折叠的蛋白质。含 Auristatin的药物是目前最大的ADCs家族(图3)。
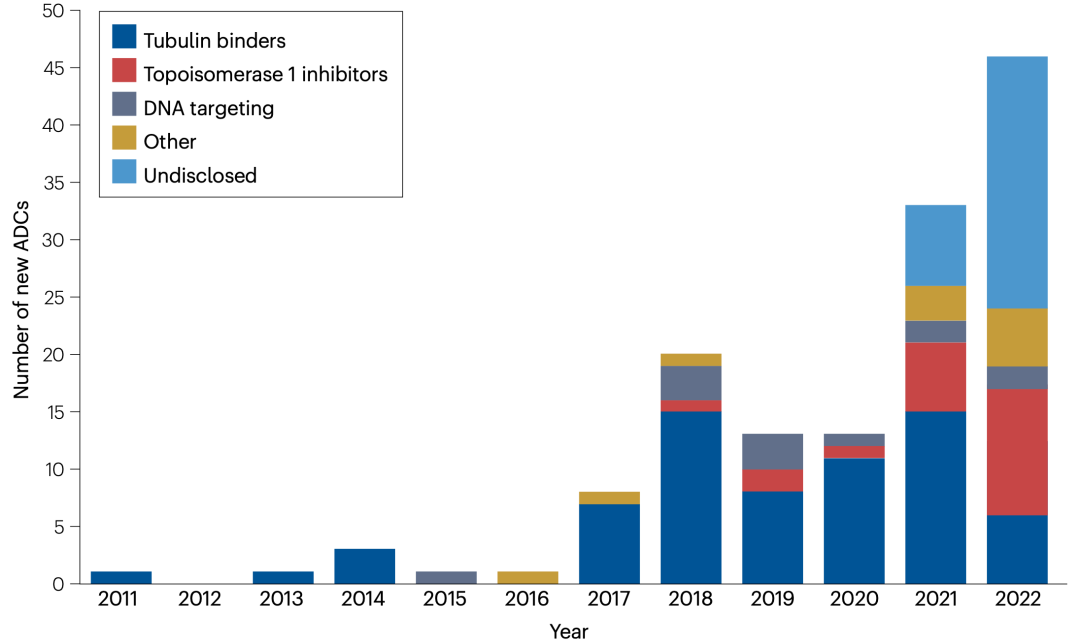
图4. 2012年至2022年间进入临床试验的新型ADCs数量
ADCs在未来将如何发展?
ADCs现已在癌症药典中得到牢固确立。随着临床试验网站上列出的ADCs临床研究超过1500项,以及越来越多的药物进入临床试验(图4),我们可以预期ADCs的上市批准将大幅多样化,其在各种疾病中的适应症也将多样化。adc的预期发展将包括新的靶抗原、具有新的作用机制的有效载荷、可以提供更好治疗指标的新连接技术以及新的抗体和载体格式。
目前批准的ADCs几乎有一半用于血液系统恶性肿瘤。在实体肿瘤中发展ADCs的困难可能是由于特定的特征,包括扩散不良、对细胞毒性药物的内在抗性和有丝分裂分数减少。由于使用更小的for- mats或使用probodies优先激活肿瘤内,更好的肿瘤穿透可能会增强ADC在实体肿瘤适应症中的活性。几个有前景的靶点目前正在实体肿瘤的临床评估中,大量肿瘤相关抗原目前正在被评估为ADCs介导的药物递送的潜在靶点。有趣的是,这些靶点中的大多数不同于那些已经使用“裸”抗体验证的靶点。
【小结】
ADCs现已成为公认的抗癌武器。即使这些药物的开发比裸抗体更复杂,研究者预计批准的ADCs的数量将在未来几年大幅增加,以满足不断增长的未满足的医疗需求清单,包括常见疾病和罕见疾病。
原文链接:
https://www.nature.com/articles/s41573-023-00709-2.


