重症医学中的个体化营养治疗:10项专家建议
时间:2023-07-20 19:18:17 热度:37.1℃ 作者:网络
摘要
个体化营养治疗是未来重症医学中的一项重要环节。根据美国/欧洲营养指南和推荐以及近期文献的建议,在入院后48小时内可以开始肠内(EN)或肠外(PN)的低热卡支持。虽然EN是首选途径,但最近研究数据表明在安全情况下实施PN并不增加风险,因此若早期无法建立EN时选择PN进行等热卡支持治疗是可行的,并且两者间具有相似的临床结局。美国/欧洲指南均建议在经过ICU治疗病情稳定后使用间接热量法(indirect calorimetry,IC)监测能量消耗(energy expenditure,EE)。早期使用低热卡治疗(EE水平的70%)并在后期逐渐加量到匹配EE水平。早期(D1-2)可给予低蛋白(<0.8g/kg/d)支持,随着病情稳定逐渐增加到1.2g/kg/d,病情不稳定或CRRT的患者应避免给予更高水平的蛋白。间隙性喂养计划可能成为接下来的研究方向。
临床医生应该清楚提供的热卡/蛋白占目标量的百分比。现在信息化的营养监测系统/平台已被广泛使用。对于微量元素/维生素缺乏的高危患者(例如行CRRT治疗)在入ICU第5-7天进行微量元素水平的监测,并在缺乏时予以及时的补充。我们希望未来可以通过监测肌肉水平,例如超声、CT和/或BIA来评价营养风险和治疗效果。使用特殊的营养物质,例如HMB、肌酸和亮氨酸等用来增加肌肉的含量及质量在其他人群中具有一定的应用价值,值得进一步研究。
在转出ICU后应该继续使用IC和肌肉监测继续指导营养治疗,需使用心肺运动测试(CPET)等康复干预措施来指导ICU后的运动/康复方案,使用睾酮/氧雄龙等合成代谢剂来促进ICU后的恢复需要更多的研究证据。
简介
开尔文和伽利略的思想在ICU中十分重要,在ICU中我们监测人体生理和病理生理变化以及干预治疗后的反应。开尔文曾说“当你能够使用数字来度量和表达正在谈论的事情时表示你对其有一定的了解,而当你无法度量它时就不能使用数字进行解释,你的知识就是贫乏而局限的。这也许是科学的开始,但你几乎没有进入科学的阶段。”目前重症患者营养个体化治疗处于“初级阶段”,只能通过客观指标对营养状态和经过干预后的临床反应进行评价。这常常使我感到我们对ICU营养治疗的了解是“匮乏且不满意”的。
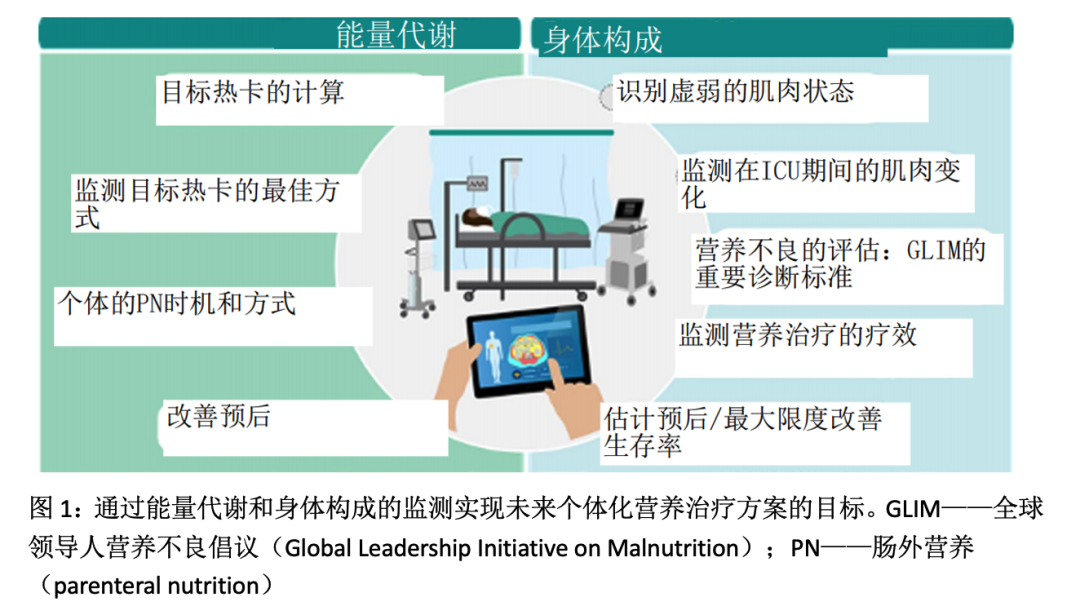
缺乏客观指标来反应营养状态、监测能量代谢以及机体和肌肉功能在经过治疗后的变化是在ICU中对营养不够重视的一项原因。就像在没有袖带或动脉导管监测血压的情况下ICU医生绝对不会给患者使用血管活性药物,因此我们认为由于缺乏的客观方法用于指导临床决策,ICU并没有将营养与其他治疗措施放在同等重要的地位。理想状态下应该有反映能量支持或蛋白质转化为瘦体质量(lean mass ,LM)的指标或生物标记物来指导“即时喂养”的个体化营养治疗。此外我们还必须确定营养支持是足够以避免过度喂养或喂养不足。因此我们必需在现在和未来发展评价营养需求及身体成分设备以满足图1的需求。此文综述了近年来营养治疗的进展并强调了10项关于个体化营养治疗的研究,综述内容均来自于ESPAN/ASPAN营养指南以及表1中文献的研究结果。
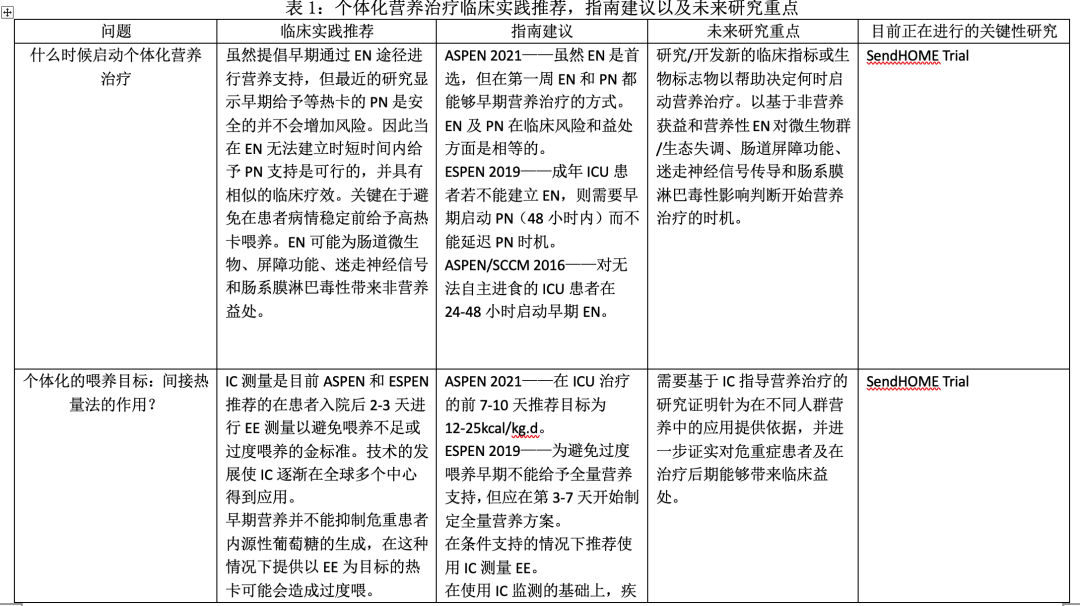

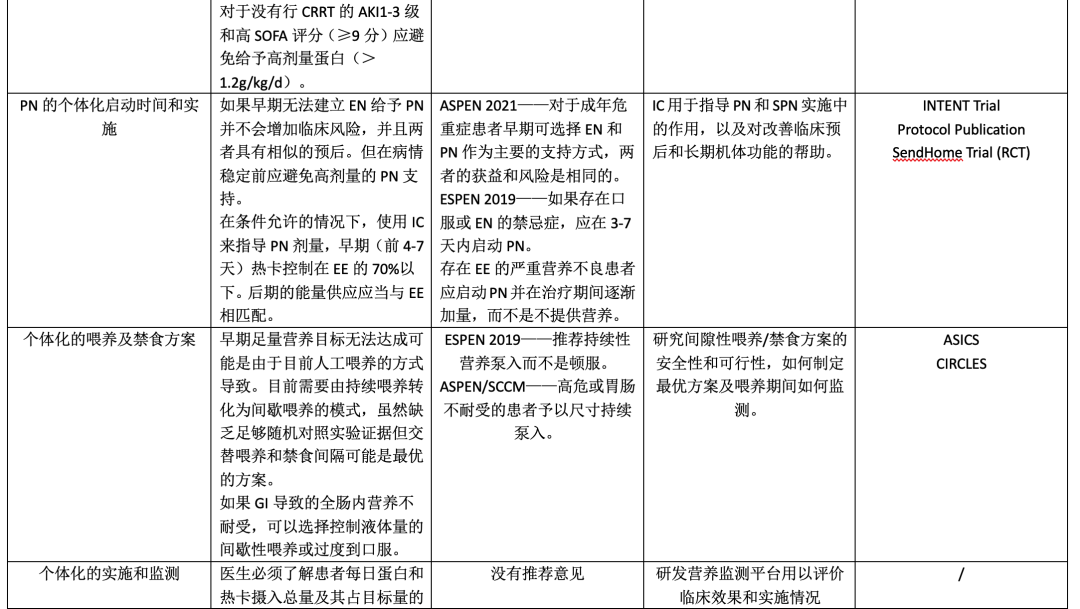
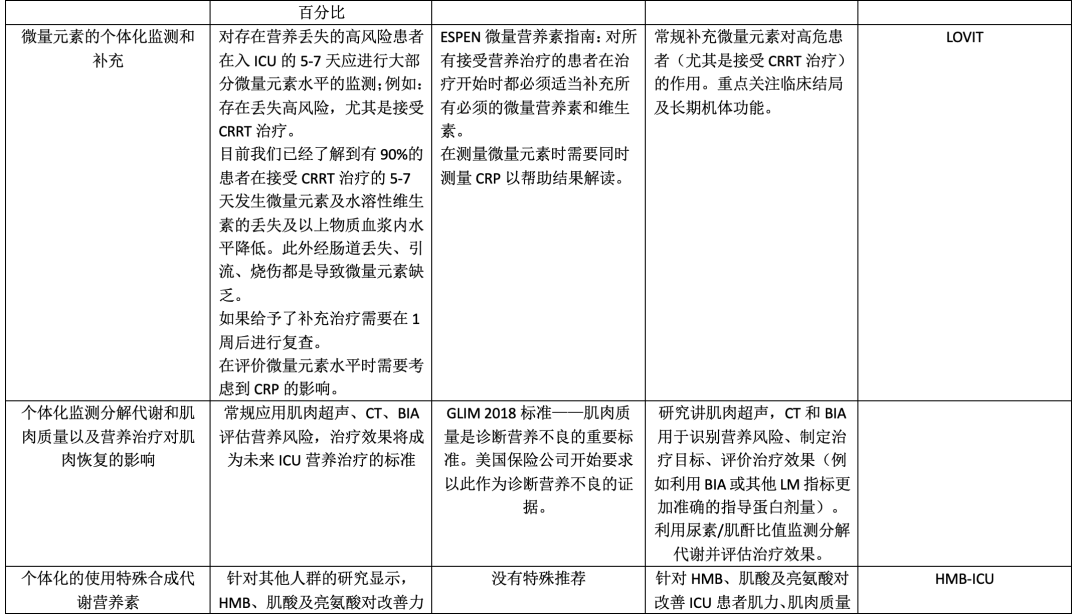
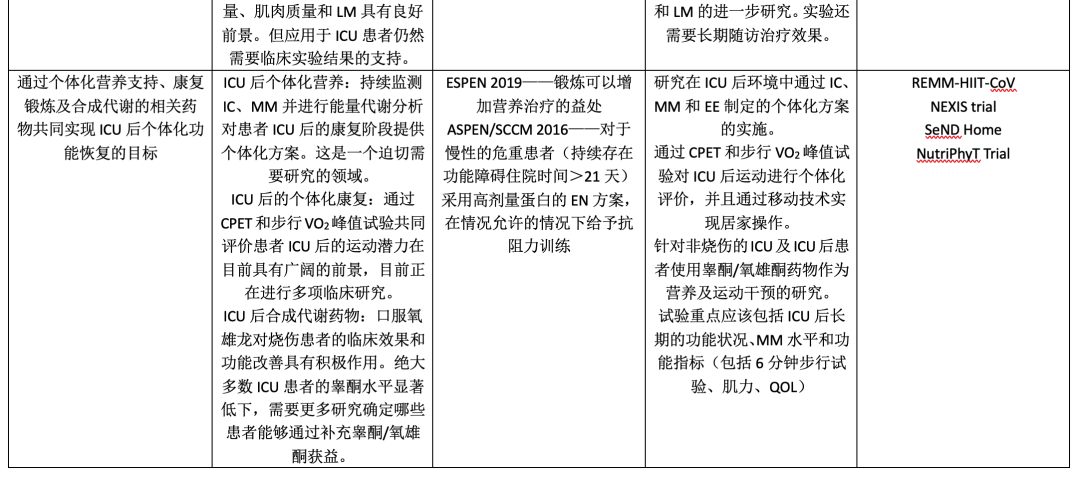
题1:我们什么时候启动个体化营养治疗?在ICU的营养治疗需要个体化评估
由于肠道缺血、通透性增加、菌群失调、微生态失调等肠道屏障变化在早期24小时内即就会发生所以指南强调早期启动肠内营养。近期文献证据表明与延迟性肠内营养(delayed EN,DEN)相比,早期肠内营养(early EN,EEN)能够通过“非营养性获益”改善预后。最近的meta分析结果显示,EEN能够减少住院期间并发症、感染风险、ICU及住院时间;两项meta分析结果显示EEN与死亡率显著降低相关,但这一结果并没有得到另外两项meta分析结果的支持。国家数据库中的数据支持对于COVID-19患者早期EEN能够获得更好的预后,在3天内启动肠内营养的ICU患者,呼吸机使用天数更少,ICU及住院时间更短。
指南推荐的EEN时间为入ICU前24或24-48小时。对于胃肠道出血、胃肠黏膜缺血、喂养不耐受(GRV>500ml)、肠梗阻、腹腔间隙综合征、存在再喂养综合征风险、使用血管活性药物未得到充分复苏循环不稳定的患者可以延迟或减缓EN的启动。对于使用血管活性药物(去甲肾上腺素<0.3ug/kg.min)但已充分复苏(乳酸水平正常)、腹腔开放、神经阻滞、ECMO、俯卧位、低温治疗的患者不需要延迟EN启动时机。
对存在EEN禁忌症患者启动PN的推荐在问题4中有详细描述。使用血管活性药物(去甲肾上腺素>0.3ug/kg.min)且机械通气的患者拔管前应避免使用更高剂量的EN和PN。这项观点也得到了Nutrirea-3试验结果的支持:在使用血管活性药物(去甲肾上腺素0.5ug/kg.min)的插管患者中,低热卡组(热卡6 kcal/kg/day;蛋白0.2-0.4 g/kg/day)比高热卡组(热卡25 kcal/kg/day;蛋白1.0–1.3 g/kg/day)的ICU住院时间缩短1天,而两者死亡和感染率没有差异。因此在早期患者病情稳定之前应该避免高剂量的营养支持。
问题2:需要提供多少能量?通过间接热量法实现个体化目标。
目前已经报道了IC能够作为反映能量消耗的客观指标、并随着技术的发展使其常规应用成为可能。此外呼吸商(respiratory quotient,RQ)的计算也提示了喂养不足(RQ<0.7)及过度喂养(RQ>1)的信息。一项针对1200患者的回顾性分析结果提示,提供70%的静息能量(resting IC-measured EE ,REE)消耗与改善ICU生存率相关,喂养不足及超过80%静息能量的过度喂养都会增加死亡率。大家所熟知的预测方程( predictive equations ,PE)并不能预测ICU患者的EE。针对COVID-19患者的研究,IC测得的代谢水平与PE的估计值有显著差异。
尽管IC指导的个体化EE测量和营养目标的制定未来在ICU中具有重要价值,但仍要谨慎的使用。在患者被充分复苏、病情稳定前(入ICU前3天)不应该过早的进行IC监测。此外,所有重症患者营养支持的指南都推荐无论是EN还是PN以10-15kcal/kg或IC的70%作为起始热卡,并随着病情的稳定逐渐加量。但如果出现额外的病情变化(例如脓毒症)那么需要更低水平的起始热卡,但此观点需要更多研究来证实。美国和欧洲指南都推荐使用IC进行EE的测量。虽然最近两项meta分析结果显示IC为导向的营养支持治疗对死亡率并没有影响并且增加患者机械通气的时间。但是随后的两项meta分析结果证实的IC为导向的营养治疗存在潜在的临床获益,能够明显降低死亡率。随着技术的发展和普及IC监测变得更加精确简单,在全球范围内将IC引入临床具有了可能性。目前新的IC能够在5-10分钟内获得精确的REE测值,也可以在CRRT上串联IC设备进行REE的显示。经过培训的相关人员(例如营养师)能够通过IC获得的EE值调节治疗方案以避免在ICU中经常发生的过度喂养或喂养不足问题。这为营养治疗提供了更多的客观数据,在ICU及ICU后保证临床及功能恢复具有重要价值。由于这是一项新的技术,所以需要更大规模的研究数据来证实IC能够满足不同人群的需求,并证明个体化营养方案的益处(见图2)。

问题3:需要提供多少蛋白质?制定个体化的蛋白剂量和启动时机
在ICU住院期间可以观察到明显的肌肉质量(muscle massMM)降低。理想状态下补充氨基酸(amino acids,AA)在健康受试者中维持蛋白稳态、抑制分解代谢具有重要意义;在ICU中较高的蛋白质补充对与改善预后和减少MM消耗有关。国际指南建议每日蛋白摄入提高到1.3-2.0g/kg/d。但最近的meta分析结果显示补充高水平的蛋白质并不能改善临床结局,最近的EFFORT-Protein试验表明高剂量(> 2.2 g/kg/d)的补充没有益处。更重要的是急性期增加AA的补充并不能增加肌肉蛋白合成(muscle protein synthesis,MPS),近期研究发现尽管肠道吸收正常,但ICU患者的MPS仍然较正常人减少60%。在ICU中可能因合成代谢抵抗(蛋白和运动对MPS的影响降低)、固化、胰岛素抵抗、炎症、卫星细胞减少和肌肉ATP含量减少而导致蛋白合成代谢降低。不少研究发现增加蛋白补充可能会导致消耗增加、自噬抑制、尿素氮生成增加、器官功能衰竭持续时间和住院时间延长。
最近的研究发现开始提供蛋白质的时间与临床结局相关,早期提供蛋白(>0.8g/kg/d)与较高的死亡率相关,但在第4-7天开始给予较高蛋白质(>1.2g/kg/d)能够提高生存率。尽管蛋白质能够维持MM水平但并不能改善肌肉力量和功能。在EFFORT-Protein的亚组分析和REDOX试验均显示了没有接受CRRT治疗的AKI(1-3级)和入院高SOFA评分(>9分)患者蛋白剂量与不良预后相关。因此在ICU中为患者适宜的蛋白剂量和时机很重要。但这应该怎样做到呢?
- 首先,我们经常使用总体体重(total body weight,TBW)来计算蛋白量,但最好通过LM来计算蛋白剂量。对于肌少型肥胖患者来说,使用TBW计算蛋白量可能会导致蛋白过量,而对于非肌少型肥胖的患者又会导致摄入不足。生物电阻抗分析(Bioimpedance Assessment,BIA)可以作为一项床旁用于评价LM的工具,超声和CT也可以作为替代检查。此外还可以应用Gallagher方程来计算LM,但此方程是基于人口统计学平均水平的计算因此有可能存在误差。由于目前大部分关于蛋白质的研究并没有包含身体组成,所以目前每LM需提供的蛋白可能存在显著差异,这也是对目前研究证据的一项重要挑战。
- 第二,有关肌肉分解、自噬、炎症和胰岛素抵抗的生物标志物可以识别出对可能受高蛋白收益的患者;然而我们目前缺乏证明相关生物标志物能够改善临床预后的证据。
- 第三,评估氮(nitrogen ,N)平衡,蛋白质摄入和分解的平衡(通过尿素氮)可能对预后有所帮助。研究发现可以通过补充更高的蛋白保证正氮平衡可以改善预后。相反,在补充高蛋白的情况下能观察到尿素氮生成和排出增加,所以对于高蛋白摄入是否等同于MPS存在质疑。
- 此外,急性肾功能衰竭或经过尿液排出的非氮成分(氨、肌酐、尿酸/氨基酸)氮平衡的评价也存在限制。ICU中个体化制定蛋白质补充方案目前尚处于起步阶段具有一定挑战性。BIA、超声、新的生物标志物等床旁技术的发展可以促进个体化方案发展的进步。
问题4:肠外营养方案的个体化
PN的个体化实施是优化ICU营养支持的关键。研究显示单独使用PN或联合EN(补充-EN,PN-SPN)与 标准低热卡治疗或单独EN相比,SPN降低住院感染率,PN减少机械通气时间,与EEN相比PN减少肠道缺血的发生率但与此同时PN增加ICU相关依赖。缺乏个体化方案可能是上诉研究结果差异的原因。Heidegger研究显示使用IC为导向制定早期治疗目标可以降低晚期感染率,这可能是避免发生喂养不足或喂养过度的关键因素。
选择合适的患者及时机开始PN治疗是目前最新的研究,也是未来继续研究的内容。“PN是有害的”这一过时且不准确的理念对所有ICU患者都是不正确的。如前所述,虽然PN的生理效应与EN不同且EN仍是首选方案,但新的ASPEN -ICU指南强调当EN无法实施时短期提供PN支持是安全、有效的,并与EN具有相同的临床结局。这项新的指南和其他4项大型随机试验都显示PN不再与感染风险相关。目前有限的证据表明EN联合PN对存在营养风险的患者是有益的,但是需要更多研究进一步证实。为了证实这项观点,一项针对腹部外科患者(并非所有患者都来自ICU)的研究证明从第3天开始的早期SPN与8天后启动营养治疗相比感染并发症显著减少。一项针对SPN的meta分析通过对死亡率、住院及ICU治疗时间等数据分析SPN并不会导致不良预后,而另一项针对ICU患者SPN的meta分析提示相比较于单纯EN,SPN降低住院感染的风险(RR=0.733, p=0.032)和死亡率(RR=0.569, p=0.030)。
在早期PN治疗方案的选择至关重要,指南推荐以低剂量作为初始(10-15kcal/day或<70%IC REE,蛋白质<0.8g/kg/d)在第一周内逐渐加量的方式。现在迫切需要更多的临床研究了解是否需要以及何时利用IC及生物标志物指导最优的个体化PN和SPN方案来改善临床及长期功能预后。
问题5:开始喂养时机和禁食时间的个体化
最近的研究表明,早期全量营养支持无法获益的原因可以通过人工营养支持方式(例如持续泵入)来解释。事实上,很多大型随机试验都证明交替喂养和间断禁食的方式优于持续喂养。间歇性喂养的保护机制可能是由于间歇性刺激禁食反应从而激活自噬和生酮促进细胞修复。间歇性的喂养可以避免“肌肉充分效应”即在提供可用性AA后MPS只是短暂的增加。并且配合日夜节律的规律喂养及禁食可以降低与很多内在疾病相关的昼夜节律紊乱发生率。然而直到最近我们仍不知道在禁食多长时间后开始出现禁食反应。近期一项针对ICU长时间住院患者的试点随机交叉试验显示在禁食12小时后开始出现循环酮水平升高的禁食反应。然而针对持续喂养和间歇喂养的随机对照试验很少并且结果不一致,一些随机对照试验结果显示间歇性喂养不耐受的情况增加,而另一些随机对照试验则表示间歇喂养能够达到更高的喂养剂量和/或更低的吸入性肺炎发生率,还有试验显示超声评估间歇喂养对肌肉水平没有影响。但是上诉试验除了方法设计不同外、样本量都很小并且研究终点也不一致。此外他们的禁食时间都控制在4-6小时但这个时间可能太短并没有激发禁食反应而获得其益处。在未来的随机试验应该研究最佳的喂养时机、喂养持续时间、剂量和理想的中间禁食时间。需要对喂养间隔时间、禁食时间及在此期间的能量需求进行个体化评估。因此未来的研究应该发现能够用于反映禁食反应激活及喂养代谢耐受性的相关生物标志物。酮体可以作为指导禁食间隔时间的生物标志物。
问题6:如何针对营养支持实施进行个体化监测?
大量研究表明,制定的营养目标和实际量存在差异:尽管存在一定混淆因素(例如病情危重的患者往往更加容易出现喂养不耐受)但观察到的数据显示存在较大的差异与预后不良相关。因此临床医生应该了解每日实际给予热卡和蛋白总量占目标量的百分比,可以通过信息化系统实现可视化监测。通过信息化系统准确监测每日营养治疗能够显著增加每日实际提供的剂量。这项系统配备有带有捕获装置(captor)的喂养管以防止或减少在无创通气及高流量鼻导管支持期间误吸风险。一项新的技术甚至可以监测喂养期间胃食管反流的发生及持续时间防止误吸。初期临床实验结果显示带有防误吸鼻饲管装置的自动化营养系统能够缩短患者住院时间,图2为我们展示了新的个体化营养监测平台。
问题7:如何进行个体化的微量元素及维生素缺乏程度的监测及补充?
微量元素(Micronutrients ,MN)缺乏是很常见的问题,但在ICU却很少进行检测和诊断。ESPEN指南推荐对特定的微量元素进行检测,因为其缺乏会导致多种并发症;而且针对微量元素缺乏的诊断和治疗给出了相关推荐意见。什么时候进行微量元素检测?在入ICU的第6-7天开始,对那些微量元素缺乏高风险、消耗过多的患者(例如CRRT患者90%接受CRRT治疗的患者在治疗的第5-7天出现多种微量元素/水溶性维生素的显著丢失或测值降低),外肠梗阻,引流及烧伤患者进行监测。炎症反应普遍存在于ICU患者中,这也使检查结果的解读复杂化:在CRP>40mg/l的情况下部分微量元素的参考值会下降,所以测值偏低也不代表存在缺乏,但是铜离子水平会随着CRP的升高而升高。较参考值下降20% 就需要引起临床医生的充分关注并在PN添加多种微量元素及维生素,若下降超过20%则需要给予补充剂量并在第7-10天进行复查。
哪些微量元素的缺乏存在风险?能够明显影响临床结局的微量元素有铜、硒、锌和铁,会导致神经肌肉无力(铜)、全血细胞减少(铜)、并且与免疫防御反应和伤口愈合相关。在ICU治疗及炎症反应减轻后可以开始对缺铁性贫血进行治疗。
问题8:如何对分解代谢和肌肉质量进行个体化监测?
在ICU普遍存在急性肌肉萎缩或乏力的表现是分解代谢的一个信号,这将会导致持续数年的功能障碍。一些生物标志物和监测手段能够用于监测分解代谢并对临床具有指导价值。新的GLIM营养不良诊断标准中包括MM减少的客观指标,这是所有患者诊断营养不良的重要依据。肌肉超声是一种广泛应用于分解代谢研究测量及治疗干预后效果的评价。其优点包括易于实施、无风险、成本低、能够监测肌肉坏死或筋膜炎,其测量结果与ICU治疗期间及转出后机体功能具有良好相关性。而缺点在于缺乏图像采集和分析的统一标准,与其他检查相比诊断结果具有较大可变性,并且难以发现一些微小的变化。CT扫描结果的可变性相对较小,且对MM的测量有明确标准。然而考虑到费用、辐射暴露、后勤及安全问题,反复使用CT扫描进行MM评价难以实施。新发展的肌肉特性的单层CT扫描技术的辐射暴露比胸部X片更少并且具有检查速度快的优点。
长期以来由于水电解质水平对测量结果的影响,通过BIA进行身体成分分析被认为是不可靠的。然而使用多频设备的研究表明虽然BIA对身体成分监测的精确性不如DAX,但是相位角值及其虽时间变化趋势能够提反映细胞活性和蛋白代谢的重要数据,BIA对LM的估测结果可见“Phase Angle Project”中的描述。
目前正在研究分解代谢的生化特征。虽然代谢组学能够提供显著的细胞粒度及个体化,但实施和结果解读的成本及专业性限制了其普遍性。尿素氮-肌酐比值(urea-to-creatinine ratio ,UCR)可用于生理学研究并能够进行常规的临床数据采集。UCR可用于鉴别危重症,PICS和术后肌萎缩的患者,但目前需要更多针对分解代谢治疗的前瞻性研究来证实其临床价值。
问题9:我们该如何个体化应用专门的合成代谢营养素?
数据显示通过EN提供的蛋白质水平往往低于世界卫生组织对健康人群的蛋白质建议,这可能会进一步加重肌肉损失。因此研究单一的营养物质来刺激MPS或减少肌肉蛋白分解具有十分重要的价值。由于符合自然合成特点,运动员常使用的营养素例如:亮氨酸、β-羟基-β-甲基丁酸(HMB)和肌酸受到了ICU医生的关注。亮氨酸是一种必需氨基酸,通过刺激哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)后作为MPS底物启动合成代谢途径。然而唯一一项其应用于ICU的可行性研究并没有得出关于MBP/MPS的结论,但是meta分析结果显示亮氨酸能够增加肌肉减少老年患者的MM。HMB是亮氨酸代谢产物,能够刺激MPS及抑制MPB使其成为被广泛研究的营养补充剂。最近一项系统综述报告称,在存在肌肉萎缩风险的各种临床人群(非ICU)中,MM和肌肉力量均得到了改善。最近的两项针对ICU的研究报告显示,无论是通过超声还是CT扫描监测肌肉丢失量没有显著差异,但此结果也有可能是由于指导时间不够的原因。肌酸能够提升细胞内的磷酸肌酸从而增加MPS过程中所必需的APT的产生。它可能会为包括危重症患者在内的潜在低磷酸肌酸水平的人群带来获益。虽然没有针对于ICU的研究,但是Cochrane的综述发现短期或中期补充肌酸可以改善肌营养不良患者的肌肉力量和LM。
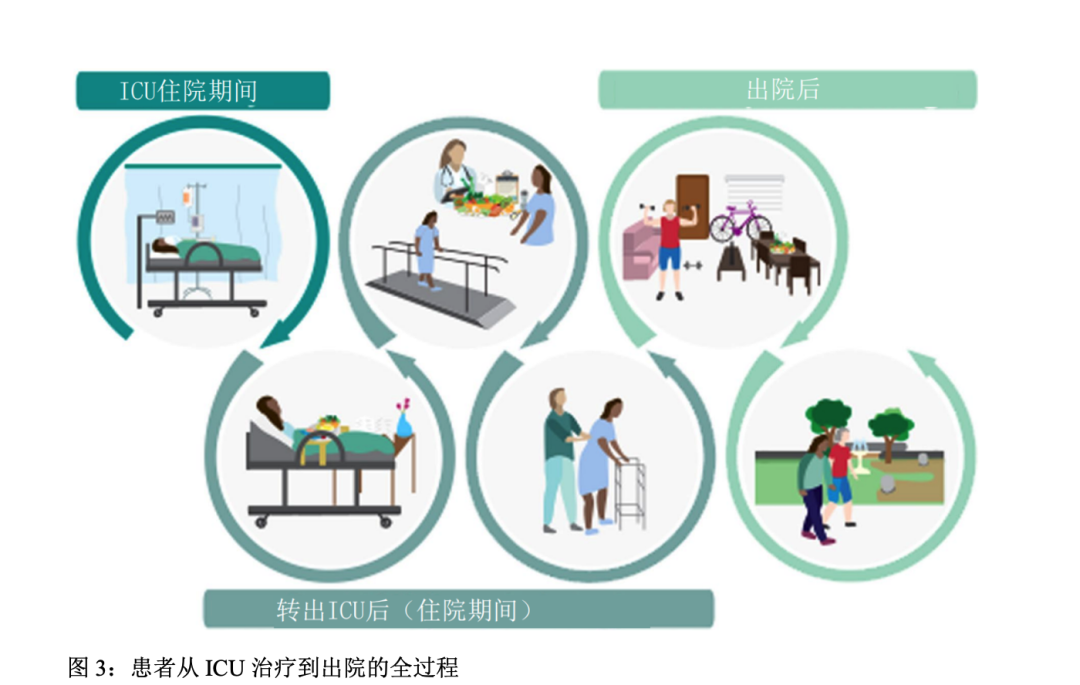
问题10:如何通过个体化营养、功能锻炼和使用合成药物后促进身体功能的个体化恢复?
ICU幸存者常常遗留身体功能障碍,特别是在使用呼吸机>48小时或明显MOF的情况下,因此在整个ICU治疗中营养和功能锻炼都至关重要(图3)。“ICU幸存者”被描述为“ICU定义的挑战”,现有的ICU营养和康复治疗都不能成功的解决这些功能障碍问题。除了分解代谢异常和喂养不足外,大多数患者在ICU治疗早期表现出严重的睾酮缺乏,急性疾病中持续性低睾酮血症会影响疾病的康复。睾酮降低水平和疾病严重程度,呼吸机使用时间,ICU住院时间和生存率相关。睾酮及睾酮类似物对预后的改善和身体功能的益处已在在多种疾病中得到证实。多项试验结果证实了氧雄龙(oxandrolone ,OX)对烧伤患者的益处,包括减少体重丢失、增加LM、促进愈合、减少住院时间且不增加感染、高血糖或肝功能障碍的风险,已成为了世界各地烧伤中心常见的标准治疗手段。之前关于睾酮与心血管或中风时间相关的担忧已经被两项大型研究结果消除,结果显示在低睾酮的患者中受试者全因心血管或中风事件的风险降低。有96%的患者在转出ICU后仍然有持续的低睾酮血症。目前需要进一步研究证实睾酮在非烧伤ICU及ICU后治疗的作用。
不幸的是在转出ICU后营养摄入不足的情况会加重,正如最近关于ICU及ICU后营养的综述所述,结构化营养治疗方案是改善这一情况的最佳策略。该综述为营养高风险患者提供了一项更优的治疗方案。该治疗方案显著降低了30天死亡率和并发症风险,改善了30天功能恢复和EQ-5D生活质量。
最后个体化的功能锻炼计划正成为目前研究的重点,并可能成为ICU康复的关键治疗措施。鉴于现有ICU康复锻炼采用“统一模式”的方法结果并不令人满意,通过心肺运动试验(cardiopulmonary exercise testing ,CPET)制定个体化运动康复计划是未来ICU康复治疗的关键。例如目前美国国立卫生研究院资助的REMM-HIIT试验利用步行VO2峰值心率指导运动目标是针对运动强度制定个体化方案的一项契机。正如REMM-HIIT中所使用的那样,这些CPET指导心率目标的个体化康复锻炼可以通过移动技术在家庭中实施。正如营养支持一样,我们同样需要先进的技术为ICU幸存者提供个体化的康复锻炼方案。
结语
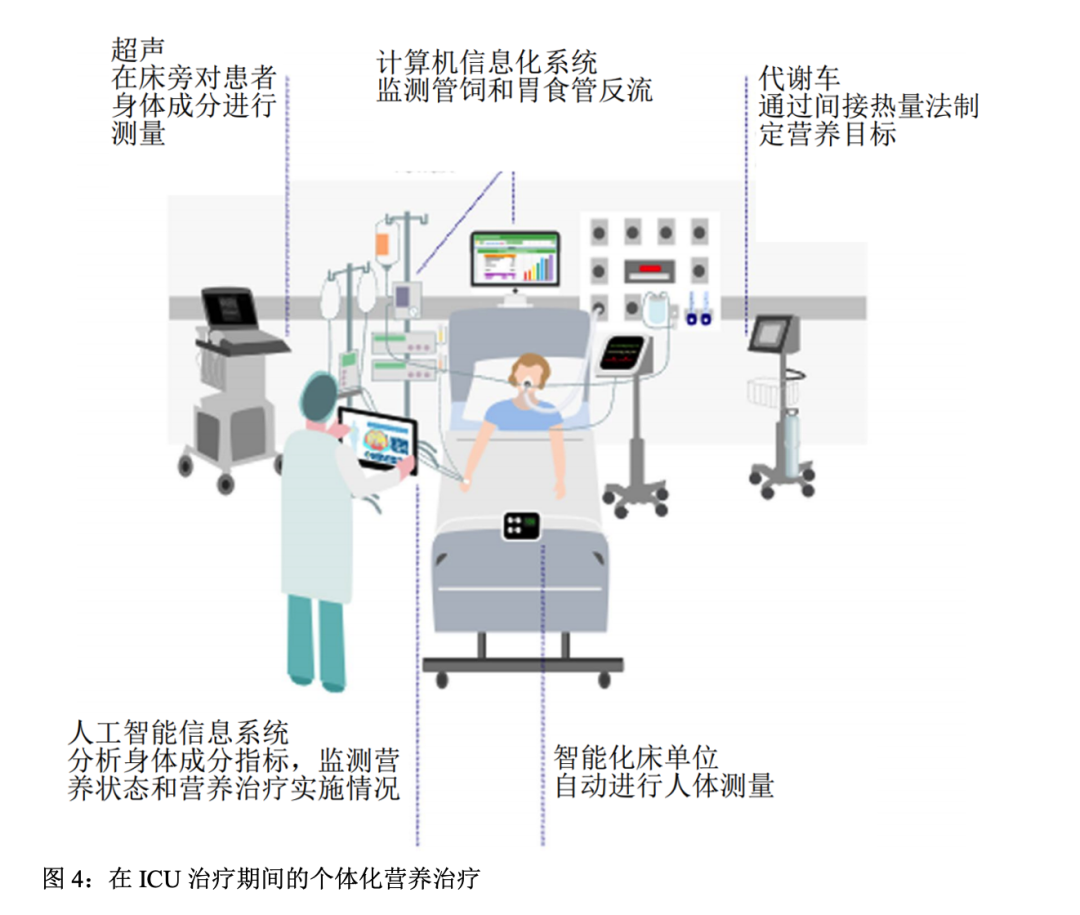
再怎么强调ICU个体化的营养治疗的重要性都不为过。我们已经进入了ICU营养治疗的时期,我们可以开始“能够测量以前不能监测的指标”。我们希望通过发展新的技术,如现代化的IC设备和一体化营养支持平台系统(图4)最终改善患者临床结局和长期的机体功能。重要的是,我们迫切需要对这些设备和技术进行试验以确保如何制定最优的ICU营养治疗方案用以改善ICU患者预后(图3)。此外我们还需要开发新的标记物和测量技术,例如使用标记物提示患者何时能够耐受热卡和蛋白摄入的加量以及底物的利用情况。以COVID-19大流行为例,ICU治疗生存率和保留机体功能为医疗带来了巨大挑战,现在比以前任何时候更需要关注营养和康复问题。

