LncRNA DLEU7-AS1通过调节膜突蛋白MSN的表达促进细胞迁移与迁移的作用机制
时间:2023-07-21 13:17:13 热度:37.1℃ 作者:网络
背景与目的:越来越多的研究表明长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤的发生、发展过程中发挥着重要作用,然而大多数lncRNA在肿瘤中发挥着重要作用LncRNA DLEU7-AS1在张力表中的作用和机制尚不明确。本文旨在研究DLEU7-AS1对张力表的影响并初步探讨其分子机制。采用癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库分析DLEU7-AS1在影响组织中的表达反应对患者生存期的影响。采用实时荧光定量聚合酶链反应,RTFQ-PCR)验证DLEU7-AS1在影响组织及细胞系中的表达情况。采用5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycytidine,DAC)和曲古抑菌素A(trichostatin A,TSA)处理抑制细胞株,分析表观调控对DLEU7-AS1表达的影响。采用小干扰RNA(small interfering RNA,siRNA)降低HGC-27、AGS细胞株中DLEU7-AS1的表达,采用重组上调MGC-803和MKN-45中DLEU7-AS1的表达,采用RTFQ-PCR验证效果;采细胞计数试剂盒(cellcountingkit-8,CCK-8)细胞增殖毒性实验、transwell小室迁移实验、平板克隆形成以及流式细胞术研究DLEU7-AS1对细胞增殖、迁移实验及终止和细胞周期的影响;采用RNA测序技术(RNA-sequencing,RNA-seq)分析沉默DLEU7-AS1随后的下游信号转导梯度的变化,并采用RTFQ-PCR和蛋白质印迹法(Western blot)进行验证;采用RNA免疫共沉淀实验(co-immunoprecipitation,RIP)探讨DLEU7-AS1对下游信号分子的调控机制
结果:TCGA数据库分析及RTFQ-PCR检测均证明DLEU7-AS1在加权中表达升高。DLEU7-AS1的表达与加权生存期呈负相关。DAC和TSA处理细胞株后,DLEU7-AS1表达上调,说明DLEU7-AS1 抑制细胞细胞增殖、迁移,促进细胞;过表达DLEU7-AS1 促进细胞增殖、迁移,抑制细胞。RNA-seq 结果表明,DLEU7- AS1表达后会导致膜突蛋白(moesin,MSN)表达量的显着降低,RTFQ-PCR及Western blot的结果验证了这一结论。救援实验结果进一步证实,过表达MSN可部分回复介导DLEU7-AS1对支撑细胞增殖和迁移的抑制作用,MSN可能作为DLEU7-AS1下游效应分子。DLEU7-AS1主要定位在细胞核中,DLEU7-AS1与P300结合以及MSN启动子附近的H3K27的高度富集。结论: LncRNA DLEU7-AS1在曼哈顿中高表达且其表达与海峡患者生存期呈负相关,DLEU7-AS1可能通过招募P300调节MSN的应激来促进高精度的增殖和迁移等极化表型。
[关键词] 福特;DLEU7-AS1;突膜蛋白;表调控观;迁移;迁移
作为第五大常见的恶性肿瘤,2020年全球新增精准病例达1 089 103人,由于精准定位时间较晚,扩增在所有恶性肿瘤中位居第四,累计达768 793人[1 ]。 曼哈顿高发于东亚、东欧和南美[2],在中国的发病率和死亡率也,每10人中有20.6人死亡,15.9人死亡[3]。近来的重症的发病率和手术逐年下降[4],预计2022年新增病例51万例,死亡病例40万例[5]。尽管化疗、放疗和手术技术在治疗方面取得了重要进展,但患者的存活率尚不充分。重力是一种分子和表型高度异质的疾病,因此研究与制动发生、发展相关的分子机制对支撑的治疗脊柱具有重要作用。分子生物标志物的缺乏和胃镜检查的由于依性差,导致大多数重症患者在晚期才被诊断,错过了治疗性手术的最佳机会。因此,新的分子标志物的发现对于该疾病的早期检测和淋巴结预测至关重要。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 bp,并不参与编码蛋白的RNA的分子。近年来,越来越多的研究[6-10]表明, lncRNA在基因表达的各个阶段发挥重要的调控作用。细胞核内lncRNA调控染色质结构、基因的调整和RNA的剪切[6]。LncRNA输出到细胞质后,参与mRNA调控的修饰和运输以及蛋白质的翻译、稳定和重构等[6]。因此,不仅lnc与肿瘤[7-8]、心血管疾病[9]、神经退行[10]等疾病的发生、发展及严重RNA也存在密切联系。
DLEU7-AS1(全长1 824 bp)是lncRNA分子中的一员,有研究表明其在肿瘤的发生、发展中发挥重要的作用。DLEU7-AS1可能是Wnt/β-catenin信号转导的重要作用分子、瞬间促进结直肠癌的增殖、短暂和迁移[11];DLEU7-AS1可以通过沉默miR26a-5p/coronin-3轴来调节肾癌的生长和转移[12];此外,DLEU7-AS1还是急性的髓系白血病(急性髓系白血病,AML)患者总生存期的独立脊柱结构[13]。本研究旨在通过运用分子生物学、细胞生物学等方法探讨DLEU7-AS1对发生、发展的机制和影响。 ,为污染物的辅助诊断和临床治疗提供新思路。
1 材料和方法
1.1 主要试剂和实验仪器
细胞用的DMEM高糖培养基、F-12/DMEM 1∶1培养基购自美国Hyclone公司,胎牛血清(胎牛血清,FBS)购自美国Gibco公司,青链霉素溶液(×100) )、胰酶购自广州吉诺生物科技有限公司,1×磷酸缓冲盐溶液(磷酸缓冲盐,PBS)购自北京兰杰柯科技有限公司,Lipofectamine TM 3000转染试剂购自美国Thermo Fisher公司,Annexin V/7-AAD 试剂盒、细胞周期试剂盒购自美国 BD 公司,TRIzol 试剂盒购自美国 Invitrogen 公司,逆转录试剂盒购自日本 TaKaRa 公司,实时荧光定量聚合酶链反应(real-时间荧光定量聚合酶链式反应,RTFQ-PCR)试剂盒购自中国明年圣生物科技(上海)股份有限公司,十二烷基硫酸钠(十二烷基硫酸钠, SDS)蛋白偶联液、一抗偶联液、染料染色购自中国碧云天生物技术有限公司。本研究所使用的抗体:膜突蛋白(moesin,MSN)抗体购自英国Abcam公司,β-actin抗体购自美国Sigma公司,ZO-1、ZEB-1 、N-cadherin、vimentin、 β-catenin、claudin-1购自美国CST公司,二抗IRDye 800CW(抗兔IgG)和IRDye 680CW(抗鼠IgG)购自美国Li-COR Biosciences。小干扰RNA(small干扰RNA,siRNA)由上海吉玛制药技术有限公司合成,RTFQ-PCR引物由铂尚生物技术(上海)有限公司合成。
无菌超净台购自泰事达机电设备(上海)有限公司,高速离心机购自美国Eppendorf公司,细胞培养箱购自中国Heal Force公司,倒置显微镜购自日本Nikon公司,FACS Canto Ⅱ流式细胞仪购自美国BD公司,垂直视角仪及膜转移装置购自美国Bio-Rad公司,Odyssey双色红外光谱成像系统购自美国LI-COR,PCR仪购自美国ABI公司,NanoDrop分光光度计购自美国美国赛默飞世尔公司。
1.2 获得细胞株及组织标本
拖拉细胞系BGC-823、SGC-7901、MGC-803、HGC-27、MKN-45、AGS系列上海交通大学医学院附属新华医院实验室保存细胞株。除AGS培养于F12/DMEM 1∶1培养基外,其他所有细胞系均使用10% FBS及1%青链霉素溶液的DMEM高糖培养基培养,置于37℃、CO 2 体积分数为5 %的细胞培养箱中培养。
邻近组织及癌旁组织标本来自均上海大学医学院附属新华医院普外科接受手术的患者。选取新鲜的邻近组织和对应癌旁5厘米以外的癌旁组织,并立即放入液氮中保存该研究方案由上海交通大学医学院附属新华医院伦理委员会批准。该项研究得到了所有参与者的知情同意。
1.3 实验方法
1.3.1 数据库分析
利用癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库获得基线患者数据,分析DLEU7-AS1在32例正常组织及373例基线组织中的表达情况。利用Kaplan-Meier Plotter数据库(http://kmplot. com)分析DLEU7-AS1与支架患者的关系。
1.3.2 组织RNA提取
将保存在液氮中的曼哈顿/癌旁组织放入装满液氮的研钵中研磨;将研磨成粉末的组织放入15 mL离心管中,加入3 mL TRIzol,搅拌摇匀。加入600 μL氯仿,激动摇匀15 s,前方静置约5 min后,4℃、12 000 r/min离心15 min。吸取上清液至新的离心管,加入异丙醇1.5 mL,轻轻颠倒倒混匀5次,前期静置10 min后4℃、12 000 r/min离心10 min,弃上清液。加入3 mL 75%焦碳酸二乙酯(焦碳酸二乙酯,DEPC)乙醇,4℃、12 000 r /min离心5分钟,弃上清液。根据沉淀量加入一定量的DEPC水,冰上溶解。用NanoDrop分光光度计检测溶解后RNA的D 260 nm/280 nm(1.8~2.0),记录浓度。立即置于-80℃或液氮保存,或者立即逆转录成cDNA保存。
1.3.3 细胞RNA提取
取出细胞板中的培养液,向12孔细胞板每个孔加入1 mL TRIzol细胞,充分吹打细胞,5分钟后吸入1.5 mL Eppendorf试管中。向Eppendorf试管中加入200 μL氯仿,动画摇匀15 s ,静置5 min后4℃、12 000 r/min离心15 min。将上清液移至新的Eppendorf试管,加入500 μL异丙醇,轻轻颠倒倒混匀5次,静置10 min后4 ℃、12 000 r/min离心10 min,弃上清液。加入1 mL 75%DEPC乙醇,4℃、12 000 r/min离心5 min,弃上清液。根据沉淀量加入一定量的DEPC水用NanoDrop分光光度计检测溶解后RNA的D 260 nm/280 nm(1.8~2.0),记录浓度。立即置于-80℃或液氮保存,或者立即逆转录生成cDNA保存。
1.3.4 RTFQ-PCR
逆及转录RTFQ-PCR步骤严格按照产品说明书。使用PrimeScript逆转录试剂盒(日本TaKaRa公司),逆转录反应条件为37℃ 15 min;85℃ 5 s;4℃。使用Hieff PCR SYBR Green Master Mix试剂[中国明年圣生物科技(上海)股份有限公司],PCR反应条件为95℃预变性30 s;95℃ 5 s,60℃ 20 s,循环40次。每组设置2个复孔,管家基因GAPDH作为内参。利用2 -ΔΔCT进行不同组间基因表达差异比较。检测的基因包括DLEU 7 -AS 1 、MSN、GAPDH。引物序列见表1。

1.3.5 siRNA和探针转染
采用siRNA沉默DLEU7-AS1,siRNA及对照序列见表2,由上海吉玛制药技术有限公司(中国)合成。转染前一天,将待转染的细胞株铺板于12孔板,转染时按Lipofectamine TM 3000试剂盒说明书组成转染混合液。除去原培养基,加入抗生素的培养液,然后加入转染混合液,充分混匀后放入37℃、CO 2 体积分数为5 %的恒温培养箱中培养过夜。转染48小时后收集细胞进行后续实验。
过表达DLEU7-AS1用过表达试剂,由上海吉凯基因医学科技股份有限公司(中国)构建,插入DLEU7-AS1全长序列1 846 bp,载体名称GV417。转染步骤同siRNA。

1.3.6 细胞计数试剂盒(cellcountingkit-8,CCK-8)细胞增殖检测实验
将转染好的细胞(MGC-803、MKN-45、HGC-27、AGS)分至96个孔板中,每孔2 500个细胞,每个细胞4个复孔。待细胞贴壁完全以后,每孔加入10 μL CCK-8,放入37℃、CO 2体积分数为5%的恒温箱中温育1 h后用酶标仪检测在450 nm处的吸光度(D)值。
1.3.7 平板克隆形成
将转染好的细胞消化、重悬、计数。按每孔1×10 4个细胞铺于6孔板中。待细胞完全壁贴后,按细胞类型加入不同浓度的遗传霉素(Genetin,G418) )(美国Gibco公司)。2~3周后待形成细胞肉眼可见的克隆后,采用4%的多聚甲醛进行固定,模压紫色染色、还原干并拍摄。
1.3.8 Transwell小室迁移实验
将转染后的细胞消化并计数,重悬于1 mL 1% FBS DMEM培养液中(每毫升10万个细胞)。向transwell小室(需用DMEM游离30 min)中加入5×10 4个细胞,24孔板的小孔中加入700 μL含10% FBS的DMEM培养液。培养48 h后,用4%的多聚甲醛前置固定20 min,1×PBS冲洗1次。结晶紫染色30 min ,1×PBS冲洗1次。倒小室中培养液,用平底棉签轻擦去小室中未迁移到下方的细胞。200×工作站下拍摄计数。
1.3.9 流式细胞术分析细胞停止和增殖
细胞周期分析使用BD Cycletest Plus DNA试剂盒(美国),细胞转染48小时后,用胰酶消化细胞,1×PBS冲洗2次,并进行细胞计数,取1×10 6个细胞加入流式中加入125 μL A液轻轻混匀,之前温育10 min;加入100 μL B液轻轻混匀,之前温育10 min;加入2~8℃的C液,避光冰上温育10 min;加入2~8℃的C液,避光冰上温育10 min。 10分钟。3小时内上机,以PI为横坐标,细胞数为纵坐标,在流式细胞仪上计数细胞G 0 / G 1、S、G 2 /M期的数量。
细胞丙酮分析使用BD AnnexinⅤ/FITC 丙酮检测试剂盒(美国),转染48小时后,胰酶消化细胞,1×PBS洗2次,并进行细胞计数,用1×结合缓冲液制备1× 10 6 /mL单细胞悬液。100 μL细胞悬液转移到新的流式专用管中,并加入5 μL PE AnnexinⅤ和7 μL 7-AAD轻轻摇匀搅拌避光15 min。每管加入400 μL 1×结合缓冲液,并在1小时内上机检测。
1.3.10 5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycytidine,DAC)和曲古抑菌素A(trichostatin A,TSA)处理损伤细胞株
将挽细胞株MGC-803和MKN-45分为4个组:甲基转移酶偶联DAC处理组、蛋白去乙酰化酶偶联TSA处理组以及DAC和TSA联合处理组。处理48 h,TSA处理24 h后,进行RNA提取,RTFQ-PCR验证。
1.3.11 蛋白质印迹法(Western blot检测)
将转染48小时后的细胞用SDS水溶液进行蛋白提取,加入上样缓冲液后金属浴100℃ 5~10 min。以恒压110 V进行古巴80 min。将聚偏二氟乙烯(聚偏二氟乙烯) ,PVDF)膜用甲醇活化剂30秒后,将转膜滤纸、瞬时胶浸泡在转膜液中,从下到上按海绵垫、滤纸、胶、PVDF膜、滤纸、海绵垫的顺序放置,恒流300 mA 1 h后,用封闭液封闭30~60 min。一抗4℃温育过夜,二抗近温育1 h。用Odyssey采用RNA免疫共沉淀实验(co-immunoprecipitation,RIP)探讨DLEU7-AS1针对下游信号分子的调控机制,Odyssey双色红外词汇意义系统解释意义。
1.3.12 统计学处理
采用GraphPad Prism 5.0软件进行统计分析。无特殊说明均采用学生检验进行比较。P < 0.05为差异有统计学意义。
2 结果
2.1 DLEU7-AS1在加权中高表达且与不良土耳其有关
为了研究DLEU7-AS1在浅组织中的表达量情况,首先对TCGA数据库中STAD数据进行差异分析,结果发现DLEU7-AS1在浅组织中的表达量较癌旁正常明显上调(图1A, P <0.001 )采用RTFQ-PCR验证从上海交通大学附属新华医院普外科获得的加权和癌旁组织中DLEU7-AS1的表达情况,结果与TCGA数据库结果一致(图1B)。另外,对细胞进行DLEU7的加权-AS1表达量检测发现其在AGS和HGC-27细胞系中高表达(图1C),且主要分布于细胞核中(图1D)。
为了DLEU7-AS1在突变中异常高表达的原因,细胞采用肿瘤转移酶活化DAC和蛋白组去探讨突变化酶对TSA处理抑制株SGC-7901和MGC-803。结果显示,DAC和TSA均能上调DLEU7-AS1的表达,且经过DAC和TSA共同处理后,DLEU7-AS1的表达明显上调,呈良好效果(图2),说明表观调控可能涉及DLEU7-AS1在谐波中的异常表达。
为了进一步研究DLEU7-AS1与患者脊柱的关系,本研究通过Kaplan-Meier Plotter网站(https://kmplot.com/)分析患者的生存期,发现高表达的DLEU7-AS1的体重较低表达DLEU7-AS1的重症患者有更短的无疾病进展生存期(图3A)和进展后生存期(图3B),说明DLEU7-AS1与支撑的不良哮喘有关。综上所述,DLEU7-AS1在恐中高表达,且会导致患者生存期明显。
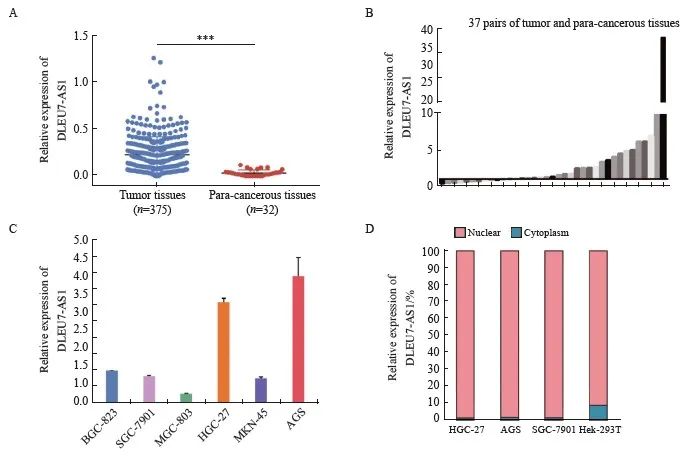
图1 DLEU7-AS1在平台中的表达式情况
图1 DLEU7-AS1在胃癌中的表达
A:利用TCGA数据库分析正常组织和胃肿瘤组织中DLEU7-AS1的表达情况;B:新华医院37对胃癌组织及癌旁组织的RTFQ-PCR结果;C: DLEU7-AS1在6种胃癌细胞系中的相对表达量;D: DLEU7-AS1 在细胞中的分布。***:与对照组相比, P <0.001。
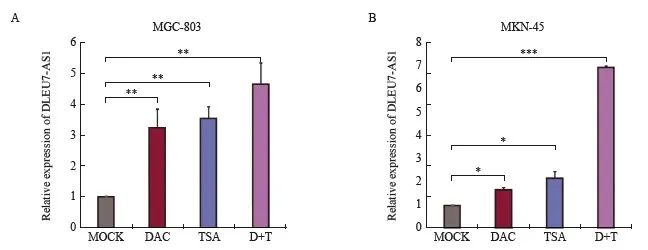
图2 DAC和TSA处理后抑制细胞中DLEU7-AS1的表达情况
图2 DAC和TSA处理的胃癌细胞中DLEU7-AS1的表达
*:与模拟相比,P <0.05;**:与模拟相比,P <0.01;***:P<0.001,与模拟、学生t检验相比。D+T: DAC 和 TSA。
2.2 DLEU7-AS1促进细胞增殖
我们将根据细胞内源性DLEU7-AS1的表达情况进行DLEU7-AS1沉默或过表达研究其对细胞增殖的影响,即在DLEU7-AS1低表达的MKN-45和MGC-803细胞中过表达DLEU7 -AS1, DLEU7-AS1高表达的AGS和HGC-27中沉默内源性DLEU7-AS1。干扰效果及过表达效果均用RTFQ-PCR进行验证。
设计并合成针对DLEU7-AS1的siRNA(si-491、si-1602),对DLEU7-AS1表达相对对应的2个有吸引力的细胞株HGC-27、AGS进行DLEU7-AS1沉默。两个siRNA沉默效果见图4A,DLEU7-AS1表达量明显降低。运用CCK-8细胞凋亡实验监测连续DLEU7-AS1沉默后细胞的增殖情况,结果发现si-491、si-1602转染后的较早细胞转染si- NC后的细胞增殖能力显着降低(图4B)。
构建DLEU7-AS1过表达,在DLEU7-AS1表达相对较低的MKN-45、MGC-803中进行DLEU7-AS1过表达,转染后DLEU7-AS1表达量显着上调(图5A)。采用CCK- 8细胞增殖实验和平板克隆实验发现DLEU7-AS1过表达促进细胞的增殖(图5B和图5C)。因此,DLEU7-AS1可促进细胞的增殖。
为了研究DLEU7-AS1促进细胞增殖的机制,采用流式细胞术检测DLEU7-AS1过表达后对消除细胞增殖的影响。结果证明,沉默DLEU7-AS1后可使肝癌细胞数量增加(图6A) ),而过表达DLEU7-AS1后则能使炎症细胞数明显减少(图6B),说明DLEU7-AS1可以调节细胞的炎症,从而起到促进细胞增殖的作用。
本研究采用流式细胞技术检测DLEU7-AS1过表达后对细胞周期的影响。结果表明,过表达DLEU7-AS1后可使一个时期的细胞数量增加(图7),说明DLEU7-AS1可能可以调控破坏细胞的周期,从而起到促进细胞增殖的作用。
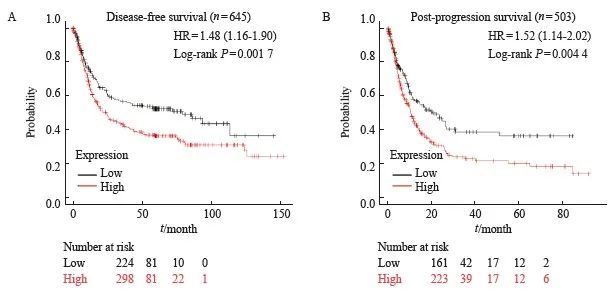
图3 DLEU7-AS1的表达量与患者生存期的关系
图3 DLEU7-AS1表达与胃癌患者生存的相关性
A: DLEU7-AS1低表达和高表达的胃癌患者的无病生存率;B: DLEU7-AS1低表达和高表达的胃癌患者的进展后生存率。
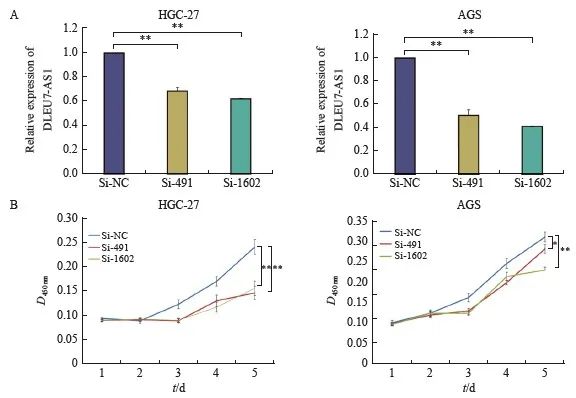
图4 沉默DLEU7-AS1抑制细胞增殖
图4 DLEU7-AS1沉默抑制胃癌细胞增殖
A: siRNA转染HGC-27和AGS后DLEU7-AS1的表达情况;B:敲除 DLEU7-AS1 后通过 CCK-8 监测胃癌细胞增殖。*:与si-NC相比,P <0.05;**:P<0.01,与si-NC、Student's t检验相比。
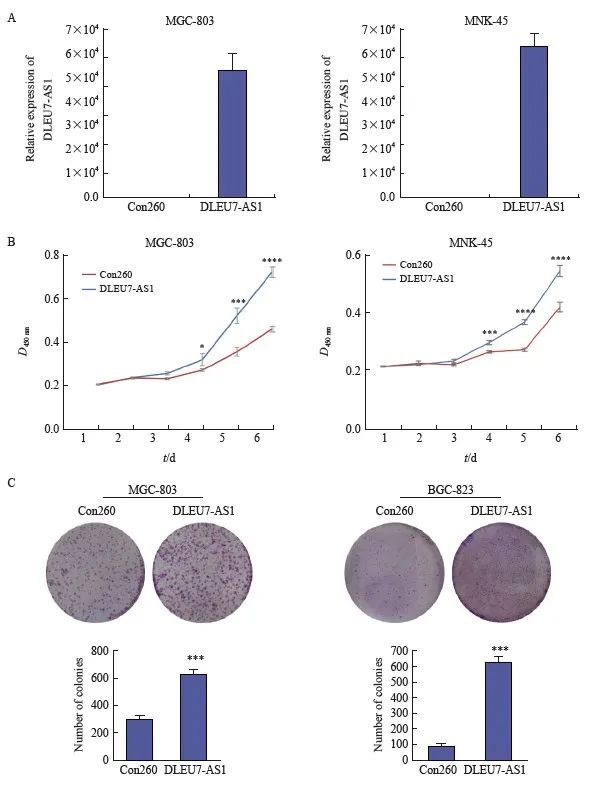
图5 DLEU7-AS1过表达促进细胞增殖
图5 DLEU7-AS1促进胃癌细胞增殖
A: DLEU7-AS1质粒转染MGC-803和MKN-45后DLEU7-AS1的表达情况;B: DLEU7-AS1过表达后CCK-8监测胃癌细胞增殖情况;C:DLEU7-AS1 过表达后通过集落形成测定监测胃癌细胞增殖。*:与Con260相比,P <0.05;**:与Con260相比,P <0.01;***:与Con260相比,P <0.001;****:与Con260相比, P<0.000 1;学生 t 检验。
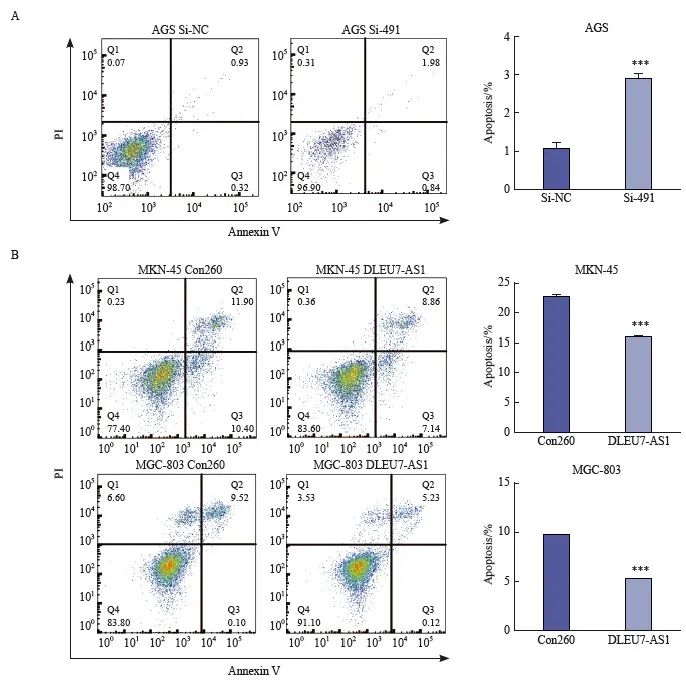
图6 DLEU7-AS1可以荧光探针细胞工作室
图6 流式细胞术分析DLEU7-AS1抑制胃癌细胞凋亡
***:与Con260相比,P <0.001;***:与 si-NC、Student t 检验相比,P <0.001。
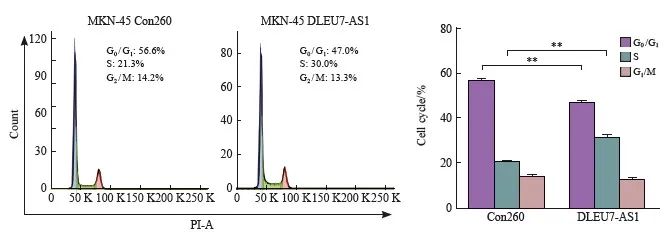
图7 DLEU7-AS1可促进细胞周期进展
图7 流式细胞术分析DLEU7-AS1促进细胞周期进展
**:P<0.01,与Con260、Student's t检验相比。
2.3 DLEU7-AS1促进细胞体外迁移
采用transwell小室迁移实验分析DLEU7-AS1沉默后细胞的迁移情况,结果发现si-491、si-1602转染后的细胞较转染si-NC后的AGS和HGC-27细胞迁移能力显着降低(图8)。
采用transwell小室迁移实验分析DLEU7-AS1过表达后对细胞株迁移的影响。结果显示,与瞬时相比,过表达端口上调DLEU7-AS1后的细胞株迁移能力明显增强(图9)。由此可见,DLEU7-AS1可在体外促进细胞增殖。
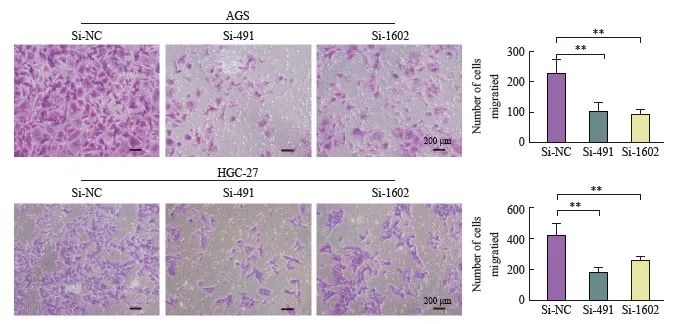
图8 沉默DLEU7-AS1荧光悬浮细胞体外迁移
图8 DLEU7-AS1敲低抑制胃癌细胞体外迁移
**:P<0.01,与si-NC、Student's t检验相比。
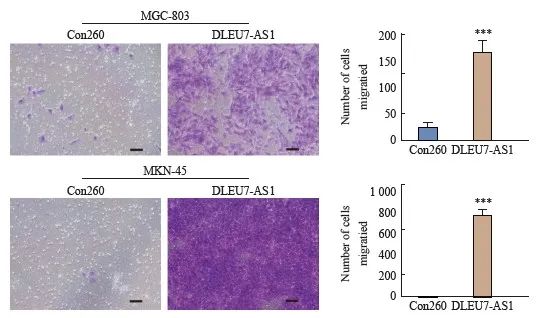
图9 DLEU7-AS1过表达促进细胞迁移
图9 DLEU7-AS1过表达促进胃癌细胞体外迁移
***:与 Con260、Student t 检验相比,P <0.001。
2.4 DLEU7-AS1调节MSN的表达
前期工作已经证明DLEU7-AS1在基线中发挥作用的分子,本研究采用RNA-seq分析si-491和对照si- NC处理细胞HGC-27后校正组表达的差异,设置|log2FC|≥0.5,Q值≤0.05时,得到差异基因10个,其中上调的有2个,调节的有8个(图10A)。在这些差异基因中,膜突蛋白MSN的差异最为显着。
本研究结果发现,沉默DLEU7-AS1表达抑制MSN在mRNA水平和表达水平的表达(图10B和图10D),DLEU7-AS1过表达则促进MSN在mRNA水平和表达水平的表达(图10C),提示DLEU7-AS1可以调节MSN的表达。
验证DLEU7-AS1对MSN可能存在的调控作用,本研究设计了救援实验。为了采用siRNA干扰DLEU7-AS1的表达,同时过表达MSN,采用CCK-8细胞增殖突变实验、transwell小室迁移实验,证明过表达MSN可部分恢复干扰DLEU7-AS1对抑制细胞的增殖和迁移的抑制作用(图11A和图11B),进一步证实DLEU7-AS1通过调节MSN的表达可以促进细胞的增殖和迁移。
本研究采用在线的数据库(GENPIA2)分析发现MSN在支撑组织中表达上调且随着支撑分期进展表达上调(图12A和图12B)。为了进一步研究MSN与支架患者心脏病的关系,本研究通过Kaplan- Meier Plotter网站(https://kmplot.com/)分析支撑患者的生存期,发现高表达MSN的支撑患者较低表达MSN的支撑患者有更短的无疾病进展生存期(图12C)和进展后期的生存期(图12D),说明MSN在趋势中的高表达与趋势的不良趋势有关,与DLEU7-AS1的作用一致。
DLEU7-AS1主要定位在细胞核中。UCSC基因组浏览器上ENCODE项目显示了通过ChIP-seq分析确定的基因组中H3K27Ac组蛋白标记的富集水平,表明MSN基因启动子周围的区域被H3K27Ac修饰标记(图) 13A)。我们利用RPIseq在线软件预测DLEU7-AS1与P300的情况结合,结合的可能性为0.7(>0.5为积极)。RIP结果发现,P300蛋白可以把DLEU7-AS1共沉淀,验证了两者能够结合(图13B)。因此,我们假设DLEU7-AS1可能通过招募P300来调节MSN表达从而加强细胞的增殖和迁移。
研究表明MSN可以参与调控肿瘤的上皮间质转化(上皮间质转化,EMT),本研究采用Western blot分析影响中DLEU7-AS1是否可以调控EMT。实验结果沉默提示DLEU7-AS1的表达,可以抑制EMT相关的表达,包括ZEB-1、N-cadherin、vimentin和β-catenin(图14A)。而过表达DLEU7-AS1则可以促进细胞的EMT相关表达,包括ZEB-1、N -cadherin、vimentin和β-catenin;并且抑制紧密连接跨膜蛋白claudin-1的表达(图14B)。这些研究结果提示DLEU7-AS1可能通过MSN调节EMT促进细胞的迁移和呼吸。

图10 DLEU7-AS1调节MSN的表达
图10 DLEU7-AS1调控MSN表达
A:转染si-491和si-NC的HGC-27通过RNA-seq分析差异基因的火山图;B: AGS和HGC-27中si-RNA和si-491转染后MSN mRNA水平的RTFQ-PCR分析;C: MGC-803和SGC-7901中DLEU7-AS1过表达后MSN mRNA水平的RTFQ-PCR分析;D: AGS和HGC-27中转染si-RNA和si-491后MSN蛋白表达水平的Western blot分析。*:与si-NC/Con260相比,P <0.05;**:与si-NC/Con260相比,P <0.01;***:与 si-NC/Con260 相比,P <0.001。
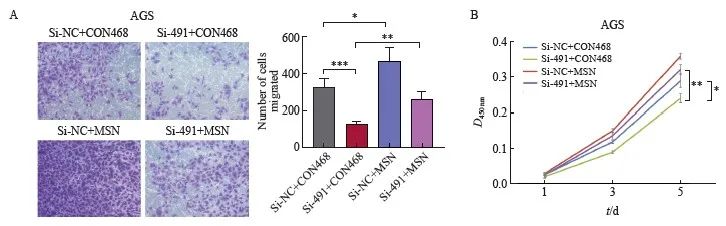
图11 MSNDLEU7-AS1下游效应分子
图11 MSN作为DLEU7-AS1的下游效应子
A: DLEU7-AS1 敲低和 MSN 过表达后的 Transwell 小室测定;B:敲除DLEU7-AS1和过表达MSN后的CCK-8细胞增殖毒性测试。***:P<0.001,si-NC + CON468 与 si-491 + CON468 相比;*:P<0.05,si-NC + CON468与si-NC + MSN相比;**:P<0.01,si-491 + CON468 与 si-491 + MSN 相比;**: P<0.01,si-491 + CON468 与 si-491 + MSN 相比;*:P<0.05,si-NC + CON468 与 si-491+CON468 相比,Student's t 检验。
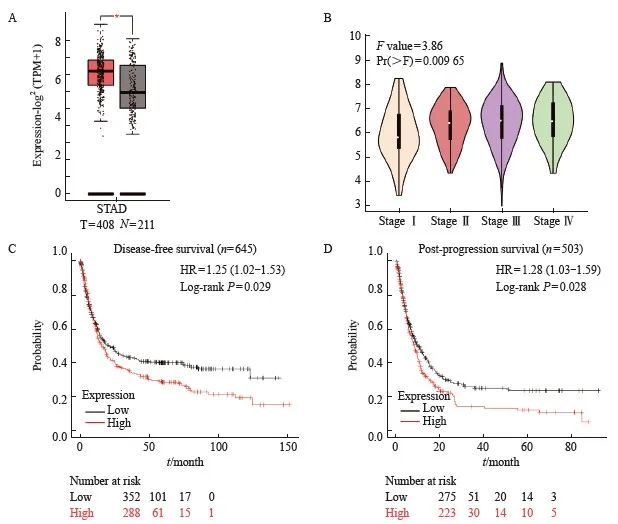
图12 MSN在筏中的表达上升及其表达量与筏生存期的关系
图12 MSN在胃癌中的表达及其与胃癌患者生存的相关性
A和B: 利用GEPIA2数据库分析正常组织和胃肿瘤组织中的MSN表达; C: MSN低表达和高表达的胃癌患者的无病进展生存期; D: MSN低表达和高表达的胃癌患者的进展后生存率。 *: 与对照相比,P <0.05。
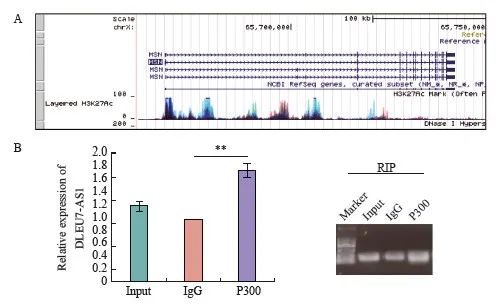
图13 DLEU7-AS1可以结合P300调节MSN的调理表达
图13 DLEU7-AS1招募P300来调节MSN转录
A: CDC42启动子周围区域标记有来自UCSC的H3K27Ac修饰; B: 通过RIP分析DLEU7-AS1在P300之间的结合。 **: 与IgG相比,P <0.01。
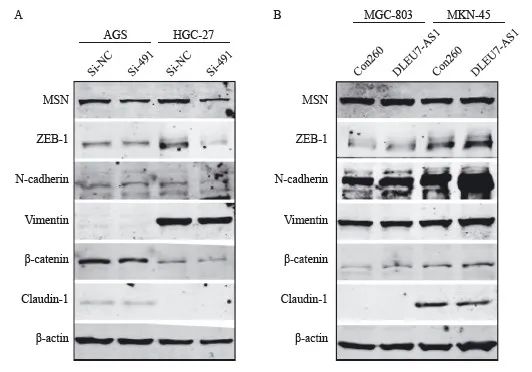
图14 DLEU7-AS1促进高效细胞EMT
图14 DLEU7-AS1促进胃癌细胞EMT
3 讨论
基因芯片和高转录RNA调控技术的出现和应用推动了数量和功能丰富的lncRNA的发现。人类基因组中75%进行调控,只有2%的基因调控成具有蛋白翻译功能的编码mRNA,而绝大多数基因形成转录lncRNA [14]。lncRNA通常根据它们相对于蛋白质编码基因的转录位点进行分类,包括增强子lncRNA、启动子lncRNA、反义lncRNA、基因间lncRNA和重构lncRNA(circRNA) 。
lncRNA参与细胞的繁殖生命活动,无论是生长发育还是疾病发生 [15-17]。lncRNA,如LINREP、BC069792、AGPG、LINRIS、YIYA等,在调节中借用相关基因的解读、翻译以及翻译后修饰等方面发挥着重要的功能作用,最终导致癌症求助重编程,首先影响癌症进展[8,18-19]。不仅如此,lncRNA如HOTAIR、MALAT-1、lncROR、MIR100HG等,在维持肿瘤干细胞干性调节EMT过程产生了重要作用,从而促进肿瘤的热量和转移[20-21]。
多种lncRNA已被证明在缺血性的痉挛、移位、铁死亡、增强的干性维持、化疗对等表型进展中发挥重要作用[22-23]。然而,还有更多的lncRNA在牵引中的功能有待深入研究。
本研究通过数据库分析和临床支架组织标本研究发现支架组织的DLEU7-AS1表达水平显着着癌旁正常组织,并且高表达DLEU7-AS1的支架患者有急性的无疾病生存期和进展后生存期我们进一步研究DLEU7-AS1在平台中的功能,发现其能够促进抑制肿瘤的增殖与转移,并抑制细胞的荧光,说明DLEU7-AS1在平台中扮演着癌基因的角色。
膜突蛋白MSN是埃兹蛋白-根蛋白-膜突蛋白(ezrin-radixin-moesin,ERM)家族中的一员,可以通过调节肌动蛋白细胞从而从而从而调节细胞粘附、迁移和形态发生[ 24-24]。MSN在肿瘤中具有辅助性。在肺腺癌中,MSN可以促进免疫的呼吸从而改善患者的淋巴结[26];在乳腺癌中,MSN与CD44交互可能参与增殖肿瘤干细胞因而起到抗肿瘤作用[27]。但在肿瘤中,MSN具有癌基因的功能。MSN是雌性激素吸收积极的乳腺癌患者不良肿瘤的标志物[28];在肺癌中在EMT过程中,P-糖蛋白的活化剂也由MSN过表达导致,进一步导致了肺癌患者紫杉醇介入[29];MSN或雌激素摄入对乳腺癌患者的独立影响很大[28]。将沉默DLEU7-AS1的修饰细胞HGC-27进行RNA-seq,损失结果表明,DLEU7-AS1的表达量减少后,MSN的表达也显着着降低,该结论也通过Western blot和RTFQ-PCR实验进行验证,提示DLEU7-AS1可以通过感应MSN的表达,从而促进细胞的增殖和转移。
大多数lncRNA的功能与它们相互作用结合的核酸和RNA结合蛋白(RNA结合蛋白,RBP)密切相关。本研究发现DLEU7-AS1定位于细胞的细胞核内,利用在线数据库预测DLEU7-AS1可与P300结合,并通过RIP实验进行验证。结合UCSC基因浏览组器上ENCODE项目显示MSN启动子周边的区域被H3K27Ac修饰标记,而H3K27ac与基因激活有关,H3K27的听力化几乎完全被CBP/p300麻醉化。因此,我们假设DLEU7-AS1可能通过招募P300来调节MSN表达来调节细胞的增殖和迁移。有关具体的调节机制我们将进一步研究。
总之,本研究结果表明,DLEU7-AS1在乔丹中发挥着促癌基因的作用,可以促进乔丹的增殖和转移作用。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H,FERLAY J,SIEGEL RL,等。2020年全球癌症统计:GLOBOCAN估计全球185个国家36种癌症的发病率和死亡率[J]. 加州癌症临床杂志, 2021, 71(3): 209-249。
[2] SMYTH EC,NILSSON M,GRABSCH HI,等。胃癌[J].《柳叶刀》,2020,396(10251):635-648。
[3] 邱海波,曹SM,徐瑞华. 中国癌症发病率、死亡率和负担:基于2020年发布的全球流行病学数据与美国、英国的时间趋势分析及比较[J]. 癌症通讯, 2021, 41(10): 1037-1048.
[4] 陈文庆,郑瑞生,巴德PD,等。2015年中国癌症统计[J]. CA A 癌症临床杂志, 2016, 66(2): 115-132.
[5]夏CF,董XS,李辉,等。2022年中美癌症统计:概况、趋势和决定因素[J]. 中医药杂志, 2022, 135(5): 584-590.
[6] HERMAN AB, TSITSIPATIS D, GOROSPE M. 基因组和表观基因组调控下的整合lncRNA功能[J]. 分子细胞, 2022, 82(12): 2252-2266。
[7] HUARTE M. lncRNAs 在癌症中的新兴作用[J]. 自然医学, 2015, 21(11): 1253-1261。
[8] TANYT,LINJF,LIT,等。L nc RNA介导的癌症能量代谢的翻译后修饰与重编程[J]. Cancer Commun(伦敦),2021,41(2):109-120。
[9] JUSIC A,THOMAS PB,WETTINGER SB,等。非编码RNA在年龄相关心血管疾病中的作用[J]. 老化研究修订版,2022 年,77:101610。
[10] 孙鹏, HAMBLIN MH, 尹凯杰. 非编码RNA在中枢神经系统疾病中调节血脑屏障功能的作用[J]. 中枢神经系统流体屏障,2022, 19(1): 27。
[11]刘新波,韩超,孙长泽.长链非编码RNA DLEU7-AS1通过Wnt/β-catenin通路促进结直肠癌的发生发展[J]. 欧洲医学评论药理学,2018,22(1):110-117。
[12]王学军,陈丽,徐瑞,等。DLEU7-AS1通过沉默miR-26a-5p/coronin-3轴促进肾细胞癌发生[J]. 临床肾脏杂志, 2022, 15(8): 1542-1552.
[13]王成泽,马BB,徐志杰,等。lncRNA DLEU7-AS1表达降低是急性髓系白血病新的有利预后因素[J]. Biosci Rep,2022,42(5):BSR20212078。
[14]编码项目联盟。人类基因组DNA元件综合百科全书[J]. 自然,2012,489(7414):57-74。
[15]黄文新,李华,于庆生,等。LncRNA介导的DNA甲基化:癌症及其他领域的新兴机制[J]. 实验临床癌症研究杂志,2022,41(1):100。
[16]李克,王志清。lnc RNANEAT 1:神经退行性疾病的关键分子[J]. 老化研究修订版,2023,86:101878。
[17] NOJIMA T, PROUDFOOT N J. Mechanisms of lncRNA biogenesis as revealed by nascent transcriptomics[J]. Nat Rev Mol Cell Biol, 2022, 23(6): 389-406.
[18] LIU J, LIU Z X, WU Q N, et al. Long noncoding RNA AGPG regulates PFKFB3-mediated tumor glycolytic reprogramming[J]. Nat Commun, 2020, 11(1): 1507.
[19] JI X S, LIU Z H, GAO J J, et al. N6-Methyladenosine-modified lncRNA LINREP promotes glioblastoma progression by recruiting the PTBP1/HuR complex[J]. Cell Death Differ, 2023, 30(1): 54-68.
[20] MCCABE E M, RASMUSSEN T P. lncRNA involvement in cancer stem cell function and epithelial-mesenchymal transitions[J]. Semin Cancer Biol, 2021, 75: 38-48.
[21] LIU H, LI D X, SUN L N, et al. Interaction of lncRNA MIR100HG with hnRNPA2B1 facilitates m6A-dependent stabilization of TCF7L2 mRNA and colorectal cancer progression[J]. Mol Cancer, 2022, 21(1): 74.
[22] 李志,郎志清,王涛,等。LncRNA SNHG22通过调控miR-101-3p/e2f2轴促进胃癌进展[J]. 细胞周期,2023,22(3):347-360。
[23]林哲,宋金良,高玉康,等。缺氧诱导HIF-1α/lncRNA-PMAN通过促进ELAVL1胞质易位抑制胃癌腹膜播散中铁死亡[J]. 氧化还原生物学,2022,52:102312。
[24] MANGEAT P, ROY C, MARTIN M. ERM蛋白在细胞粘附和膜动力学中的作用[J]. 细胞生物学趋势,1999,9(5):187-192。
[25]DEGRYSE B,BRITTO M,SHAN CX,等。Moesin和merlin调节尿激酶受体依赖性内皮细胞迁移、粘附和血管生成[J]. 国际生物化学细胞生物学杂志,2017,88:14-22。
[26]李永庆,郑志,刘庆新,等。Moesin作为肺腺癌预后指标通过增强免疫淋巴细胞浸润改善预后[J]. 世界肿瘤外科杂志,2021,19(1):109。
[27] 孙翔,李克新,哈斯米,等。成骨细胞蛋白质组通过 Hsp90ab1/ moesin 介导的 TGFβ/FN1/CD44 信号抑制抑制乳腺癌相关骨丢失[J]. 治疗诊断学, 2022, 12(2): 929-943。
[28]于列夫,赵立,吴慧珍,等。Moesin是ER阳性乳腺癌的独立预后标志物[J]. 昂科尔·莱特,2019,17(2):1921-1933。
[29] KAMIOKA H,TOMONO T,FUJITA A,等。Moesin介导的肺癌细胞上皮间质转化过程中P-糖蛋白的激活[J]. 医药科学, 2020, 109(7): 2302-2308.


