前沿进展 | PARP抑制剂获益患者高达50%!同源重组修复缺陷(HRD)检测至关重要!
时间:2023-12-14 16:43:07 热度:37.1℃ 作者:网络
HRD作为新兴的肿瘤分子标志物,在多种恶性肿瘤患者治疗管理中对PARP抑制剂疗效预测发挥着越来越重要的作用。《同源重组修复缺陷临床检测与应用专家共识(2021版)》指出:HRD临床检测在PARP抑制剂治疗晚期卵巢癌疗效预测中具有重要的应用价值,可对卵巢癌患者进行分层,优化相应治疗决策,最大限度扩大PARP抑制剂临床获益人群;在乳腺癌、卵巢癌、胰腺癌、前列腺癌中,其对PARP抑制剂或含铂类药物的临床应用可能也具有潜在的指导价值[1]。《卵巢癌PARP抑制剂临床应用指南(2020版)》指出:HRD检测可以使PARP抑制剂敏感人群从占20%左右的BRCA突变人群扩大到占50%左右的HRD阳性人群[2]。
关于HRD,本文将从DNA的损伤与修复开始逐步探讨。
01 DNA损伤与修复
DNA损伤(DNA damage)指的是由于机体内在因素或环境等外在因素所导致的DNA组成和结构的变化。DNA损伤具有双重生物效应:(1)DNA结构改变是生物进化的基础;(2)DNA损伤可以使细胞功能出现再生障碍,与多种疾病的发生息息相关。DNA损伤的表现形式主要包括:碱基损伤与糖基破坏、碱基错配、DNA单/双链断裂、DNA链的共价交联。在所有DNA损伤形式中,DNA双链断裂对细胞危害最大,若未得到及时修复,则可能引起复制受阻和染色体缺失等,进而导致细胞死亡或向肿瘤转化的有害结局。DNA修复(DNA repair)是机体维持DNA结构完整性与稳定性,保证生命延续和物种稳定的重要环节。
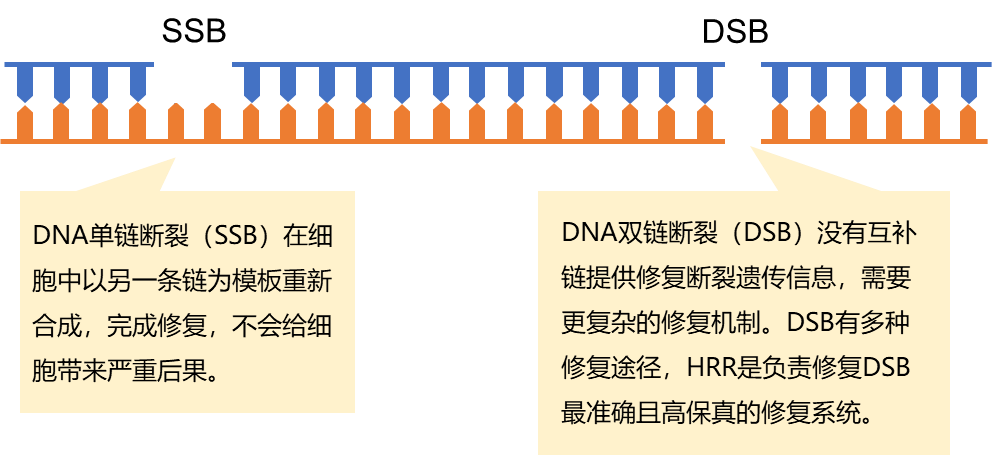
图1:DNA的单/双链损伤模式图
02 同源重组修复(HRR)与同源重组修复缺陷(HRD)
同源重组(Homologous recombination, HR)是减数分裂中一种引入遗传多样性的机制,通过来自父本和母本的配对染色体相互交叉,交换两条 DNA 链之间的遗传物质。HR也可以发生在有丝分裂中,它通过精确修复 DNA 双链断裂和正常细胞代谢过程中遇到的其他损伤来促进DNA的稳定性。HR是一个高度保守的过程,在DNA修复、DNA复制、减数分裂染色体分离和端粒维持中起着重要作用。这个过程不仅创造了遗传多样性,还保持了 DNA 序列的稳定性。
同源重组修复(homologous recombination repair,HRR)是DNA双链断裂的首选修复方式。它以未受影响的姐妹染色体作为模板,来修复丢失的DNA 序列。HRR是一条涉及多个步骤的复杂信号转导通路,其中关键蛋白为BRCA1/2基因所编码。BRCA1/2与多种其他DNA修复蛋白相互作用,形成DNA损伤修复的复杂系统,这些蛋白包括ATM、RAD51、PALB2、MRE11、RAD50、NBN、CDK12 和 ATR蛋白等等[3]。
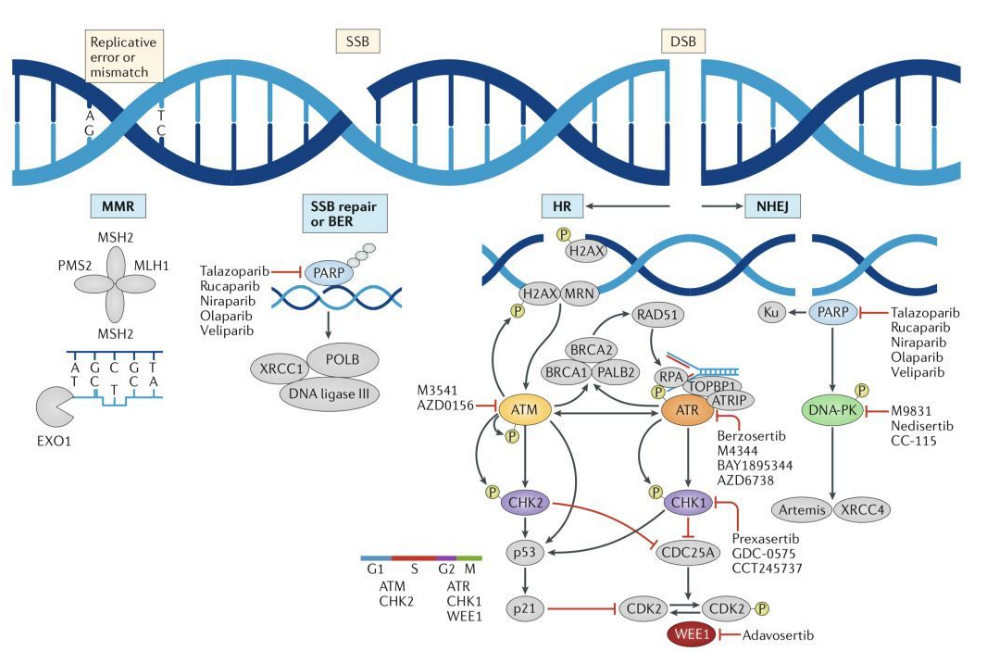
图2:DNA损伤的修复调控途径[4]
同源重组修复缺陷(homologous recombination deficiency,HRD)通常指细胞水平上的HRR功能障碍状态,当HRD存在时,DSB会过度依赖非同源末端连接、微同源末端连接和单链退火途径等低保真、高易错的替代性DNA损伤修复途径,从而极可能造成核酸序列的插入/缺失,拷贝数异常,并引起染色体交联,造成基因组和染色体不稳定。
03 HRR与HRD的关系[1-4]
HRD可由HRR相关基因胚系突变或体细胞突变以及表观遗传失活等诸多因素导致。HRR通路相关的基因突变是导致HRD的主要原因,卵巢癌中常见的HRR突变有BRCA1、BRCA2、ATM、BARD1、BRIP1、CHEK1、 CHEK2、FAM175A、MRE11A、NBN、PALB2、RAD51C、RAD51D等,其中BRCA1和BRCA2突变较为常见。
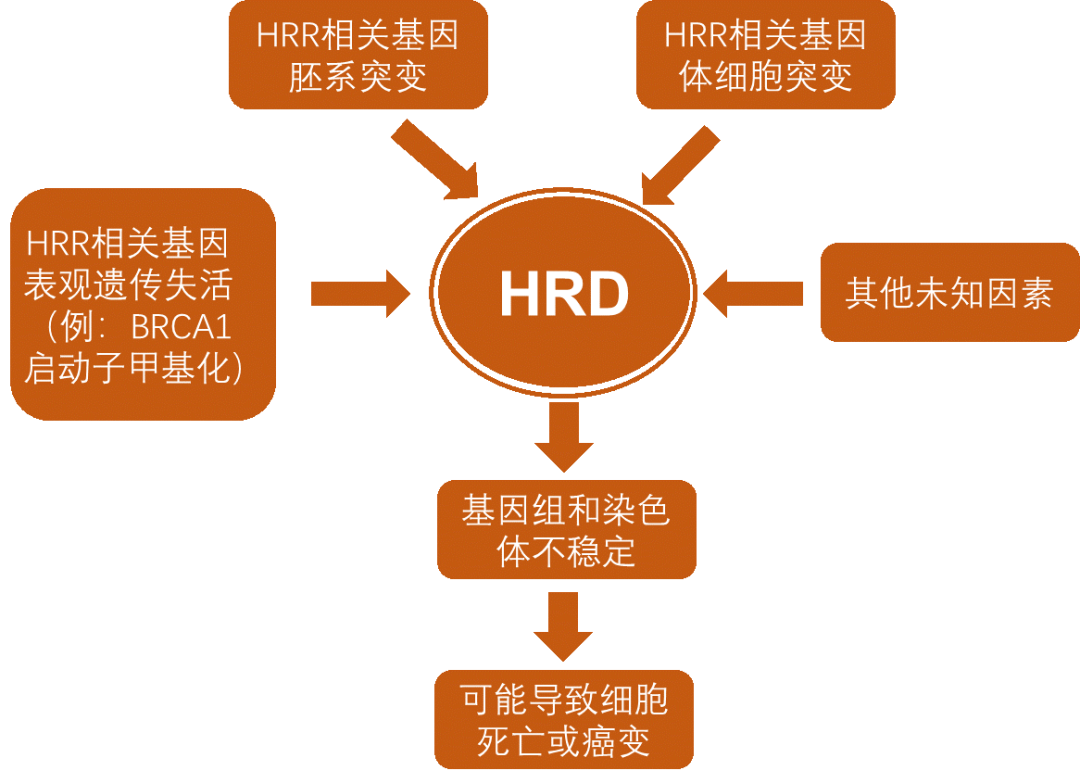
图3:导致HRD的因素及其影响
HRD是恶性肿瘤较为常见的分子标记,卵巢癌、乳腺癌、前列腺癌、胰腺癌发生率较高;HRD阳性卵巢癌、乳腺癌表现出一定的临床病理学特征,BRCA相关的遗传性乳腺癌和卵巢癌表现更显著。HRD的存在会使肿瘤细胞对诱发DNA交联的铂类药物高度敏感,同时应用PARP抑制剂可促发肿瘤细胞合成致死。
04 PARP抑制剂与HRD的关系 [1-4]
最初,PARP抑制剂是基于BRCA1/2突变的患者研发的,但不断增加的临床数据已显示其在更广泛的肿瘤群体中的益处,临床适应证也从BRCA1/2突变,发展到HRD。当使用PARP抑制剂靶向作用于单链修复中的PARP酶时,未经修复的DNA单链断裂可发展为DNA双链断裂。在HRD的肿瘤细胞中,PARP抑制剂可造成大量的DNA损伤,从而导致肿瘤细胞的凋亡。HRD并不能直接导致细胞凋亡,只有当PARP抑制剂作用于HRD 细胞时,在两种主要的DNA修复机制同时失效的情况下,才会导致细胞死亡即“合成致死”效应。
从合成致死的原理上,PARP抑制剂可以在所有的HRD肿瘤细胞中发挥作用,即HR通路上除了关键组分之一的BRCA1/2基因突变,还涉及到其他的HRR基因包括RAD51、ATM、MRE11、TP53等,HRR基因发生突变失活同样导致DNA双链损伤修复功能缺陷。
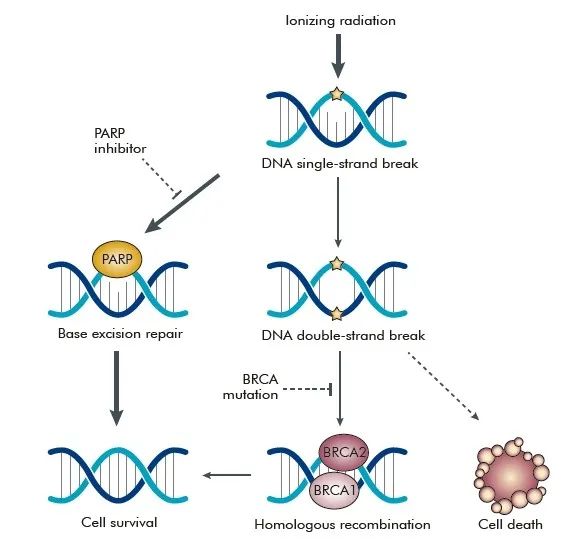
图4:PARP抑制剂作用机制图
PAOLA-1研究纳入新确诊的Ⅲ-Ⅳ期高级别浆液性或子宫内膜样卵巢癌、输卵管癌及原发性腹膜癌患者,实验组使用奥拉帕利+贝伐珠单抗联合治疗,对照组使用贝伐珠单抗单药进行维持治疗。结果显示,HRD阳性(包含BRCA突变)患者两组的中位PFS分别为37.2个月和17.7个月(HR =0.33);HRD阳性(排除BRCA突变)患者两组的中位PFS分别为28.1个月和16.6个月(HR= 0.43);HRD阴性/突变未知患者两组的中位PFS分别为16.9个月和16.0个月(HR=0.92)。HRD阳性患者(无论是否包含BRCA突变)接受奥拉帕利治疗的中位PFS远高于对照组,HRD是独立于BRCA突变预测奥拉帕利维持治疗疗效的指标[5]。
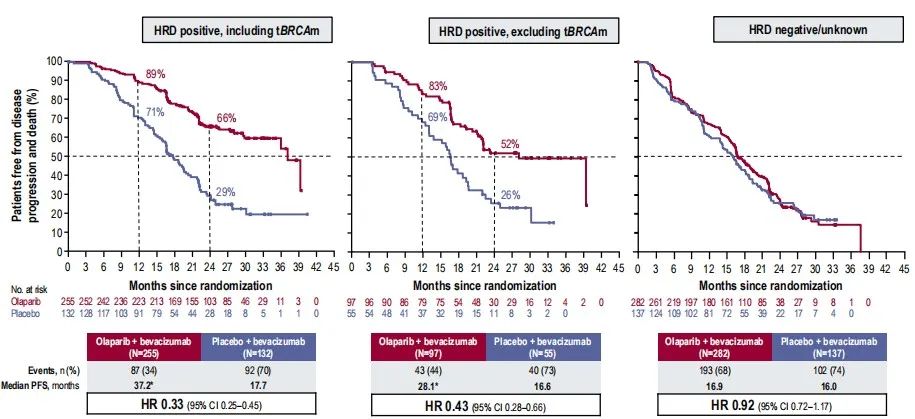
图5:不同治疗方案下肿瘤患者的无疾病进展和死亡情况[5]
05 目前NMPA批准的PARP抑制剂情况[6]
目前,国家药品监督管理局(NMPA)批准的4种PARP抑制剂。
表1:NMPA批准的PARP抑制剂情况

06 HRD检测与判读
HRD会产生特定的、可量化的、稳定的基因组改变,其中包含可被鉴别的基因突变、插入/缺失模式,以及染色体结构异常、基因拷贝数变异等,这也是当前构建HRD临床检测方法的理论基础。HRD 检测采用 NGS 方法,通常包括两个部分,BRCA1/2 突变状态及基因组不稳定性状态的评分(genomic instability score,GIS),或称HRD 评 分(HRD score)。HRD评分可依据杂合性缺失(loss of heterozygosity,LOH)、端粒等位基因不平衡(telomeric allelic imbalance,TAI)、大片段迁移(large⁃scale state transition,LST),以量化基因组变异的程度。
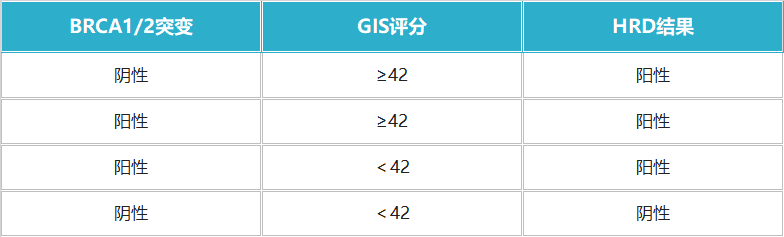
目前,较为公认的HRD状态评估方法是通过BRCA1/2的致病性变异状态及GIS来评价,并且报告解读已有较明确的标准:“当BRCA1/2突变和(或)GIS评分≥42分时,即判定为HRD阳性”[4]。
表2:HRD状态评估结果判读
07 HRD检测的临床应用
PARP抑制剂疗效预测:
NCCN卵巢癌指南(2022.V1)、上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识(2020年)推荐:对于新诊断的卵巢癌患者、铂敏感复发的卵巢癌患者、既往接受过2线或以上含铂类药物化疗的铂敏感复发性卵巢癌患者需进行HRD状态(包括BRCA1/2和HRD score)检测(胚系和体系),以评估预测PARP抑制剂的治疗效果[7-8]。
NCCN前列腺癌临床实践指南(2022.V4)推荐:所有转移性去势抵抗性前列腺癌需进行包括BRCA1/2在内的HRR基因检测(胚系和体系),以评估预测PARP抑制剂的治疗效果[9]。
HRR突变用于肿瘤遗传风险评估:
乳腺癌和卵巢癌NCCN指南(2020.V3)推荐,评估乳腺癌与卵巢癌的家族遗传风险,需进行胚系检测的基因有BRCA1/2,TP53,PTEN,ATM, BRIP1, CDH1, CHEK2, NBN, PALB2, RAD51C, RAD51D, STK11等[10]。
中国前列腺癌患者基因检测专家共识(2020年版)推荐:全部前列腺癌患者进行DNA修复基因(特别是BRCA2、 BRCA1、 ATM、PALB2、 CHEK2、 MLH1、 MSH2、 MSH6、PMS2)胚系检测,来进行遗传风险评估[11]。
胰腺癌NCCN指南(2022.V1)推荐,胰腺癌患者应进行胚系检测的基因有BRCA1/2,PALB2, MLH1, MSH2, MSH6, PMS2, ATM, TP53等,以胰腺癌家族性高风险评估[12]。
08 HRD检测意义
HRD检测在卵巢癌、乳腺癌、胰腺癌、前列腺癌等患者中,对于指导PARP抑制剂临床用药具有重要临床价值,可最大限度扩大PARP抑制剂临床获益人群。
参考文献
[1] 中国抗癌协会肿瘤标志专业委员会遗传性肿瘤标志物协作组等. "同源重组修复缺陷临床检测与应用专家共识(2021版)." 中国癌症防治杂志 2021年13卷4期, 329-338页 (2021).
[2] 中华医学会妇科肿瘤学分会. 卵巢癌PARP抑制剂临床应用指南[J]. 2020.
[3] Patrick G Pilié, et al. State-of-the-art strategies for targeting the DNA damage response in cancer. Nat Rev Clin Oncol. 2019 Feb;16(2):81-104.
[4] 二代测序临床报告解读肿瘤学专家组, 张绪超. 肿瘤二代测序临床报告解读共识[J]. 循证医学, 2022, 22(2):15.
[5] Fujiwara K , Harter P , Leary A , et al. Phase III PAOLA-1/ENGOT-ov25 trial: Olaparib plus bevacizumab (bev) as maintenance therapy in patients (pts) with newly diagnosed, advanced ovarian cancer (OC) treated with platinum-based chemotherapy (PCh) plus bev[J]. Annals of Oncology, 2019, 30:ix191-ix192.
[6] 温灏. PARP抑制剂不良反应管理的中国专家共识(2021年版).
[7] 中国抗癌协会妇科肿瘤专业委员会, 中华医学会病理学分会. 上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识[J]. 中国癌症杂志, 2020, 30(10):841-848.
[8] Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer,Version 1.2022,NCCN Clinical Practice Guidelines in Oncology.
[9] Prostate Cancer, Version 4.2022, NCCN Clinical Practice Guidelines in Oncology.
[10] Breast Cancer, Version 3.2020, NCCN Clinical Practice Guidelines in Oncology.
[11] 中国抗癌协会泌尿男生殖系肿瘤专业委员会, 中国临床肿瘤学会前列腺癌专家委员会. 中国前列腺癌患者基因检测专家共识(2020年版).
[12] Pancreatic Adenocarcinoma, Version 1.2022, NCCN Clinical Practice Guidelines in Oncology.


