HLA:SARS-CoV-2变异体中受压细胞毒性T细胞表位强度与COVID-19严重程度相关
时间:2023-05-04 14:24:34 热度:37.1℃ 作者:网络
截至2023年2月13日,导致新型冠状病毒肺炎(COVID-19)大流行的严重急性呼吸综合征冠状病毒(SARS-CoV-2)已在全球感染了7.55亿多人。尽管进行了大规模疫苗接种,但由于变体能够逃脱疫苗诱导的免疫反应,导致这次大流行广泛传播。

SARS-CoV-2感染的临床结果范围广泛,从无症状、轻度和中度疾病状态到与严重肺炎、急性呼吸窘迫综合征(ARDS)和淋巴细胞减少症相关的严重和危重状态在严重的COVID-19病例中,负责控制病毒感染的免疫机制已被证明功能失调,持续的细胞因子产生导致高度炎症状态参与对抗病毒感染的免疫系统的主要武器之一是细胞毒性T淋巴细胞(CTL)或CD8+ T细胞反应,在严重的COVID-19病例中表现出功能耗尽的表型。此前在患有轻度COVID-19的恢复期个体中检测到更高频率的SARS-CoV-2特异性T细胞,这表明CTL反应具有长期保护作用。
人类之间的遗传异质性已知会显著影响疾病的严重程度HLA基因型是宿主因子之一,在个体间表现出较高的序列变异。HLA I类基因型由A、B、C三组HLA等位基因组成,可直接影响CTL反应,使具有某些HLA基因型的个体更易患某些疾病。
以前的研究已经发现了许多HLA-I类等位基因,这些等位基因与严重COVID-19.9的易感性显著相关,通过使用各种生物信息学技术和机器学习算法预测HLA等位基因与致病表位的结合亲和力,从而促进了T细胞反应的量化。这些表位预测工具已被用于基于表位识别来确定HLA等位基因对严重COVID-19的易感性,并基于表位的高人群覆盖率来确定基于肽的疫苗靶点。此外,表位的结构预测也提供了关于病毒蛋白质组中对突变具有鲁棒性的受限区域的见解。
宿主免疫反应通常对病原体施加选择压力,导致能够逃避抗病毒反应的突变变体的出现。在SARS-CoV-2的变体中,Delta变体(B.1.617.2)在2021年4月至5月印度的COVID-19强烈波浪中占主导地位,因为它具有较高的传播性和部分逃避宿主免疫反应。先前的研究表明,在SARS-CoV-2变体以及亲本Wuhan-Hu-1株的分离株中,T细胞免疫逃逸的可能性要么局限于某些HLA等位基因,要么覆盖更大的人群。
相反,在新出现的变异中产生的突变促进了逃逸,主要来自中和抗体反应,而不是相对保守的T细胞反应。然而,实验研究表明,由于SARS-CoV-2蛋白ORF3a和Nucleocapsid27的HLA限制性表位突变,SARS-CoV-2变异体中CTL活性的丧失,需要在全球水平上进一步研究CTL免疫逃逸。
BA.1是最早出现的Omicron亚变体之一,已知在Spike蛋白中容纳多达37个突变,使其能够逃避抗体介导的中和此外,最近出现的BA.2、BA.4和BA.5 Omicron亚变体已被证明无法被ba.1感染的血清识别。然而,这些新出现的变异中CTL逃逸的程度仍有待研究。由于先前通过自然感染或接种疫苗暴露于BA.1刺突蛋白,已经观察到交叉反应性T细胞对BA.1刺突蛋白的反应,并且在大多数具有HLA依赖性逃逸的个体中,以前已经记录了对BA.1的强烈T细胞反应有效的T细胞应答高度依赖于与宿主HLA分子高亲和力结合的表位的呈现。因此,为了分析和解释突变驱动的病毒变异从宿主T细胞反应中逃逸,有必要确定对宿主提供保护并可能处于选择压力下的表位。
2023年5月3日发表在HLA的研究,研究人员旨在探讨宿主遗传异质性在决定COVID-19差异易感性中的作用,并确定在决定疾病结局方面更有影响力的表位。
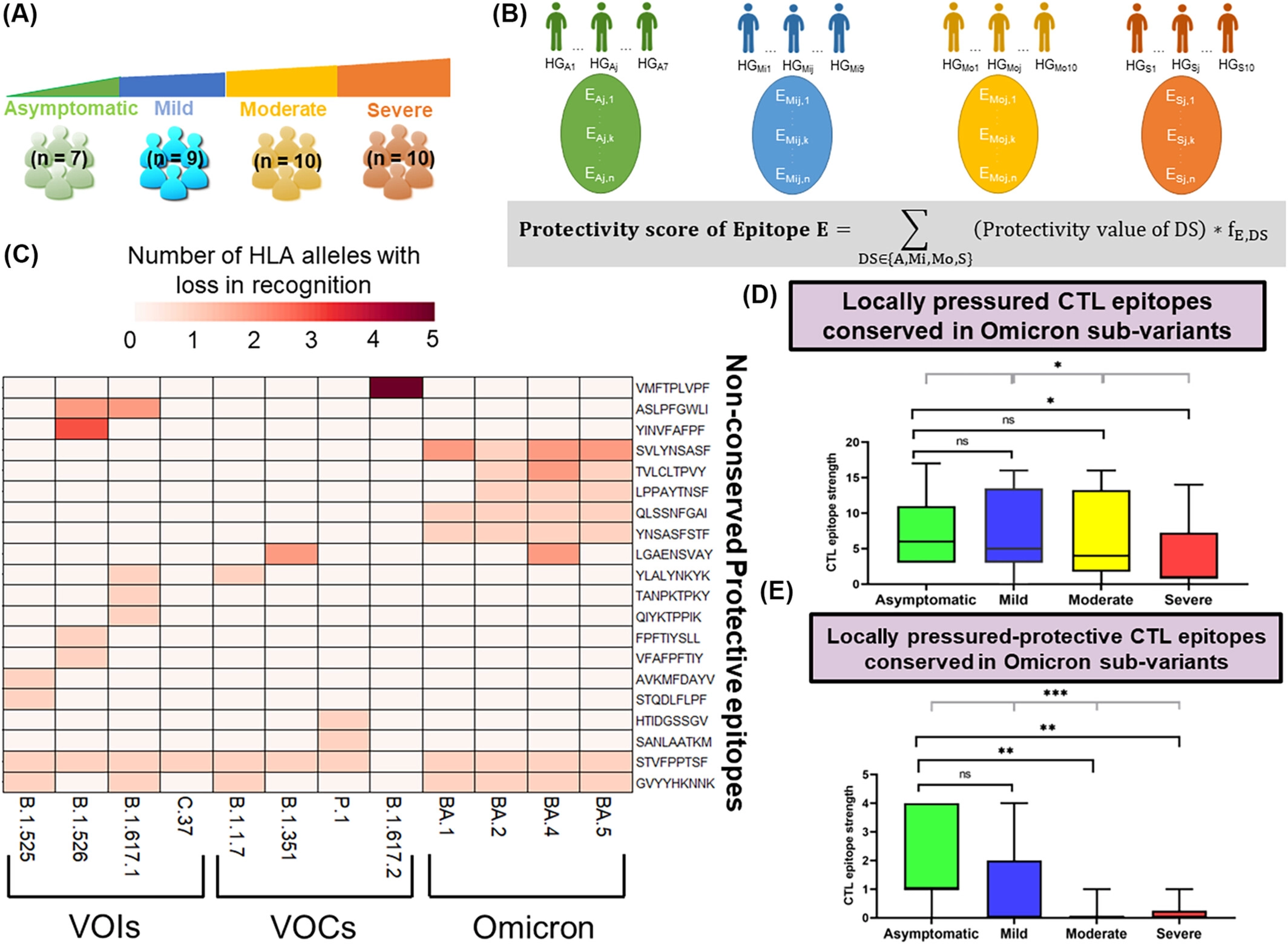
预测CTL表位强度与COVID-19严重程度的相关性
从NCBI病毒数据库中获得的SARS-CoV-2变体的蛋白质序列数据中,研究人员使用IEDB表位预测工具从生物信息学上获得了每个变体的CTL表位集,比较这些表位集在不同的变体和候选表位,这些表位在不同的变体中受到免疫压力,并称之为“压力表位”。在来自班加罗尔的COVID-19队列中建模表位-HLA识别,通过将HLA基因型作为整体考虑,并估计T细胞对这些压力表位的反应。
模型表明,根据当地队列的COVID-19患者的HLA基因型数据,观察到来自亲本株Wuhan-Hu-1的压力表位的识别与COVID-19的严重程度相关;并且鉴定和排序HLA等位基因和表位,提供保护,防止严重疾病的感染个体。CTL反应的估计程度解释了COVID-19的不同严重程度。与症状较轻的个体相比,经历过严重COVID-19的个体的CTL反应估计显着降低。
但这项研究存在一些局限性。首先,TAP蛋白酶体途径,HLA结合肽从内质网到细胞表面的囊泡运输,以及由于胸腺阴性选择而缺乏与自身肽相似的病毒表位特异性TCR,这些都是在基于表位呈递定量CTL表位强度时需要考虑的进一步方面。
其次,由于缺乏本地HLA等位基因先前可用的实验结合亲和力研究,某些表位的高亲和力结合无法得到验证。但这点在文献中得到了广泛的支持,在超过25篇论文中577个实验验证的表位中,有41482个高结合表位出现在本文章中。
除此之外,已知COVID-19在患者中呈现广泛的免疫病理,因此在某些情况下,CTL反应不一定是确定疾病严重程度的主要因素。因此,关于严重疾病状态下CTL表位识别率较低的假设可能并不适用于本文章考虑的所有COVID-19患者样本。尽管每个类别的样本量都很小,但可以观察到一个明显的趋势。研究表明,虽然多种因素可能导致严重程度,但CTL表位识别本身就足以显示出明显的趋势。一旦上述数据可用,本文的框架还允许将其中一些方面纳入未来的研究。
近年来,对病毒和宿主基因组的大规模计算机分析为分析宿主-病原体相互作用和确定引起大流行或流行的病原体采用的进化路径提供了一种全面的方法。目前的分析重点是宿主遗传异质性在决定COVID-19疾病结局和推动新的SARS-CoV-2变异进化中的作用。研究结果为自然界中普遍存在的宿主-病原体军备竞赛以及潜在的临床意义提供了更深入的进化见解。在人群中确定压力表位有助于根据人群中高度代表性的HLA等位基因施加的局部选择压力预测未来SARS-CoV-2变体可能发生的突变,并有助于更好地应对正在发生的大流行。
原始出处
, , , , , . Pressured cytotoxic T cell epitope strength among SARS-CoV-2 variants correlates with COVID-19 severity. HLA. 2023; 1- 13. doi:10.1111/tan.15071


