特别关注|HBV相关肾小球肾炎的研究进展
时间:2023-08-02 11:24:25 热度:37.1℃ 作者:网络
据统计,全球慢性HBV感染者数量约为2.4亿,其中8%~20%伴有肾功能受损[1-2],主要包括HBV相关肾小球肾炎(HBV-GN)。黄瑶等[3]的研究回顾分析了9310例肾脏病理资料,包括继发性肾小球肾炎(SGN)2523例,其中HBV-GN占10.62%,是较为常见的SGN类型之一。HBV-GN由Combes[4]于1971年首次报道,于1989年正式命名,儿童发病多见,成人发病率男性高于女性,临床上主要表现为不同程度蛋白尿,可伴有血尿和高血压,常见病理类型有:膜性肾病(MN)、系膜增生性肾小球肾炎(MPGN)和IgA肾病,MN最为常见。
HBV-GN的发病机制尚不清晰,目前普遍认为免疫复合物沉积是其主要发病机制,近年来研究提示病毒直接损伤、免疫损伤及遗传因素也起到一定作用(图1)。直至目前,HBV-GN尚无可行性较高的诊断及疗效评估指标,亦缺乏确切有效的治疗方案。本文就HBV-GN的发病机制、诊断标准及治疗进展作一综述。
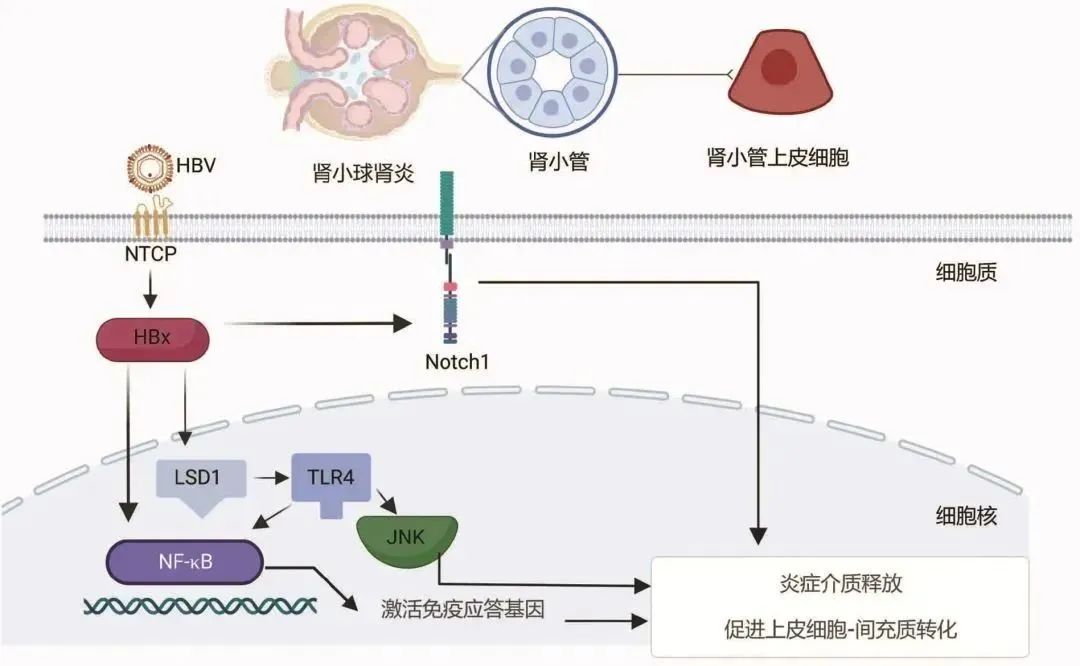
图1 HBV-GN发病机制图
注:NTCP,钠离子-牛磺胆酸共转运蛋白;JNK,c-Jun氨基末端蛋白激酶。
1HBV-GN的发病机制
1.1 病毒抗原与宿主抗体免疫复合物沉积
HBV抗原能够与自身抗体结合形成免疫复合物沉积于肾小球,因HBV抗原的分子量及电荷属性不同,沉积部位也不同,具有多种病理学表现。HBeAg大小为17 kD,是三种抗原中最小的一种,可穿透基底膜而沉积于肾小球上皮细胞下,病理可表现为MN。HBsAg和HBcAg大小分别为35~50 kD和22 kD,同属阴离子,无法穿透肾小球基底膜而沉积于肾小球内皮细胞下及系膜区,病理多表现为MPGN。
1.2 HBV直接损伤肾小管细胞
钠离子-牛磺胆酸共转运蛋白(NTCP)是一种可在肾脏中表达的糖蛋白[5],最早被认为是胆汁酸运输的受体并在胆汁酸肠肝循环中起到重要作用[6],后被发现可作为受体与HBV前S1蛋白(HBV preS1)结合介导HBV进入肝细胞[7],初步证实HBV具有感染肾脏的基本条件,但关键转录因子的表达尚未被证实。多项研究[8-9]观察到了血清学HBV标志物阴性的HBV-GN患者,推测HBV或可直接损伤肾脏。HBx是一种多功能调节蛋白,具有调节细胞周期及激活信号转导通路的作用[10-11],与HBV在细胞中的复制密切相关。HBx在肾小管细胞中能够调节细胞周期蛋白表达从而影响肾小管上皮细胞凋亡[12]。Li等[13]将HBx质粒转染到人近端肾小管上皮细胞(HK-2),发现HBx质粒转染增加了NF-κB磷酸化,猜想HBx可能通过激活NF-κB信号通路促进肾小管上皮细胞-间充质细胞转分化,最终导致肾脏间质纤维化。HBx还可上调组蛋白赖氨酸特异性脱甲基酶(LSD1),LSD1处于NF-κB上游,通过LSD1-Toll样受体(TLR)4-NF-κB/JNK信号通路激发炎症反应,促进炎性介质释放并诱导细胞凋亡[14-15]。
1.3 病毒介导的特异性免疫效应机制
HBV介导的免疫效应在HBV-GN的发病过程中同样具有重要作用。Zhou等[16]在HBV-GN的肾组织中检测到了CD4+、CD8+T淋巴细胞和巨噬细胞,并观察到了肾小管间质纤维化,提示免疫细胞激活引起的自身细胞损伤在发病过程中具有一定作用。HK-2是非专业的抗原呈递细胞,正常情况仅表达少量的主要组织相容性复合体Ⅱ(MHC-Ⅱ)类抗原及部分T淋巴细胞、巨噬细胞的共刺激分子,在HBV感染时可转化为专业的抗原呈递细胞[17],分泌多种细胞因子并促进免疫炎症反应[18-19]。HK-2细胞在HBx转染后可促进CD4+T淋巴细胞的增殖及趋化因子单核细胞趋化蛋白-1的产生,还可使巨噬细胞黏附指数增加,大量激活巨噬细胞并促进炎症损伤[20]。
Notch1作为Notch信号通路主要受体之一可在HBV-GN患者的肾小管上皮细胞及间质区域表达,随着肾小管炎症及间质纤维化加重,受体数量也相应增加。Wang等[21]应用短发夹RNA敲除Notch1可抑制HBx转染后的肾小管上皮细胞-间充质细胞转分化,这表明HBV感染通过某种机制上调了Notch1的表达并促进了肾间质纤维化。Notch1还可促进IL-4分泌并减少IFNγ分泌,使辅助性T淋巴细胞1/2(Th1/Th2)细胞增殖失衡,进一步诱发免疫紊乱。
黑色素瘤缺乏因子(AIM)2属HIN-200蛋白家族,与细胞质双链DNA结合后能够促进含半胱氨酸的天冬氨酸蛋白水解酶-1(caspase-1)、IL-1β和IL-18的释放。Zhen等[22]的研究发现,AIM2在HBV-GN患者肾组织中的表达(81.4%)显著高于慢性肾小球肾炎患者(4.0%),并与IL-1β、IL-18及caspase-1的表达密切相关。推测AIM2能够与HBV DNA结合并激活上述炎症信号通路,通过免疫介质的释放增加引起肾损伤。
TLR4是参与机体免疫应答的重要蛋白分子,可调控炎症细胞及T淋巴细胞活化,还可促进细胞因子释放并介导免疫炎症反应。Zhou等[16]研究结果显示,在HBV-GN患者中,TLR4主要在肾小管和间质间隙中表达并与肾脏病变严重程度呈正相关,进一步行体外研究发现TLR4上调可抑制HBV DNA复制,但过强的免疫应答可引起肾脏免疫损伤并促进HBV-GN进展。
1.4 遗传因素
HLA基因复合体是调节免疫应答的重要基因群,在抗原识别、提呈等方面发挥重要作用,包括Ⅰ、Ⅱ、Ⅲ 3类。Bhimma等[23]在30例HBV-GN黑人儿童肾组织中进行了HLA检测,发现DQB1*0603的表达频率显著高于健康对照组。Park等[24]的研究发现DRB1*1501与DRB1*1502在部分HBV-GN患者中表达频率明显增加,其中DRB1*1502与HBV-MPGN呈强相关性,DRB1*1501与HBV-MN呈弱相关性。此外,在部分HBV-GN患者中发现了单点HBx基因突变,提示HBx蛋白或可介导调控区氨基酸的替换,进而影响HBV复制[25]。HBV-GN的发生需要病毒及宿主的遗传因素共同作用,但相关研究较少,具体机制仍需进一步探索。
2HBV-GN的诊断
HBV-GN诊断的金标准为肾病理学检查,以肾组织中检测到HBV-Ag阳性为基本条件,血清HBV相关指标阳性及除外其他SGN可进一步支持HBV-GN的诊断。肾穿刺活检属于有创性检查,部分患者因禁忌证无法进行,某些地区或基层医院亦尚未开展该项检查,临床上需要可行性较高的无创辅助诊断指标。
M型磷脂酶A2受体(PLA2R)是特发性MN血清学诊断的金标准[26],正常情况下可少量存在于足细胞表面,能够与血液循环中的抗PLA2R抗体结合形成原位免疫复合物并沉积于肾小球基底膜,通过激活补体途径损伤肾小球滤过屏障[27]。Xie等[28]应用免疫荧光技术测定了39例HBV-GN患者肾组织中的PLA2R,结果显示在25例(64%)HBV-GN患者中检测到了PLA2R,提示PLA2R抗体在HBV-GN中同样具有诊断价值。同样地,Dong等[29]测定了103例HBV-GN患者肾组织中的PLA2R,其中有66例(64%)检测到了PLA2R,并且这部分患者具有更高的尿蛋白水平及更为严重的肾脏病理损伤。涂天琪等[30]应用ELISA法测定了229例HBV-GN患者血清抗PLA2R滴度,结果表明抗PLA2R滴度与24 h尿蛋白定量呈正相关,与血白蛋白呈负相关,抗体滴度下降早于24 h尿蛋白下降。血清PLA2R测定对HBV-GN的诊断价值仍需大规模研究进一步验证。
3HBV-GN的治疗
目前HBV-GN的治疗主要为抗病毒及免疫抑制治疗。现有研究表明,随着HBV复制减弱及HBV抗原清除,HBV-GN患者蛋白尿水平及肾功能均可得到显著改善。2012年KDIGO指南[31]推荐将抗病毒治疗作为主要治疗手段,包括干扰素(IFN)和核苷酸类似物(NUC)。
3.1 IFN
IFN具有抗病毒、抗增殖及免疫调节作用,其HBeAg及HBsAg阴转率较NUC更高,治疗周期更短,适用于儿童及年轻患者。普通IFNα的推荐疗程为24周,PEG-IFN的推荐疗程为48周,血清转换率可达15%~46%[32-33]。临床上应遵循个体化原则评估最佳治疗方案。一项纳入182例HBV-GN患者的Meta分析[34]结果显示,IFN在儿童患者中治疗效果更确切,与NUC相比,能够更大程度上缓解蛋白尿水平并提高HBeAg清除率。IFN可扩大HBV感染后免疫机制介导的肝损伤作用,还可引起流感样综合征、胃肠道反应、骨髓抑制等不良反应,因此应用受限。
3.2 NUC
NUC具有给药方便、耐受性好等优势,现已广泛应用于HBV感染的治疗,但部分NUC本身即具有肾毒性,主要包括阿德福韦酯(ADV)及富马酸替诺福韦酯(TDF)。Udompap等[35]的研究表明ADV及TDF与临床估算的肾小球滤过率(eGFR)降低相关,不建议应用于HBV-GN患者的治疗。
恩替卡韦(ETV)及富马酸丙酚替诺福韦酯(TAF)作为指南推荐的慢性肾脏病、肾功能不全或接受肾脏替代治疗的一线抗HBV药物,具有较高的肾脏安全性。其中ETV用于肌酐清除率<50 mL/min患者时需调整剂量,而TAF在eGFR≥15 mL·min-1·1.73 m-2的患者中均不需要调整剂量[36]。Notsumata等[37]的研究纳入了38例由ETV转换为TAF治疗的HBV患者,治疗后肾功能相关标志物如eGFR、尿肝脏型脂肪酸结合蛋白及血清成纤维细胞生长因子23均较转换前明显改善。同样地,Ogawa等[38]的研究共纳入313例应用ETV或NUC治疗2年以上后转换为TAF的HBV患者,肾功能相关标志物也均较转换前显著改善。由此可见,HBV-GN患者应用TAF治疗具有更为显著的获益。
3.3 NUC联合免疫抑制剂
免疫抑制剂在抑制免疫应答、减缓肾病进展方面具有不可替代的重要作用,目前临床上多与抗病毒药物联合应用,不建议单用于HBV-GN的治疗。一项纳入317例HBV-GN患者的Meta分析[39]结果显示,抗病毒药物联合激素治疗与单用抗病毒药物相比可显著降低患者的尿蛋白水平,用药过程中未观察到肝肾功能的恶化。多项研究[40-41]比较了他克莫司联合ETV与ETV单药治疗的效果,同样观察到了联合治疗组尿蛋白水平的显著降低,并且联合免疫治疗未使HBV复制较前活跃。
4结语
HBV-GN作为乙型肝炎常见合并症之一,对乙型肝炎患者的预后具有重要影响。目前,HBV-GN的发病机制仍不明确,尚缺乏简便特异的诊断方法及规范的治疗方案,仍需更大规模、更高质量的研究进一步探寻,为临床治疗提供新的靶点及思路,做到早期诊断及治疗,改善乙型肝炎患者的预后。
原始出处
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.03.027
李朝霞, 李楠, 辛桂杰. HBV相关肾小球肾炎的研究进展[J]. 临床肝胆病杂志, 2023, 39(3): 651-656.


