梅斯盘点:2022年乳腺癌十大研究进展
时间:2022-12-28 12:00:01 热度:37.1℃ 作者:网络
乳腺癌的全身治疗已初步形成包括化疗、靶向治疗、内分泌治疗和免疫治疗在内的成熟体系。近年来,“精准治疗”逐渐受到重视,基因组学、转录组学以及代谢组学等多组学技术蓬勃发展,为乳腺癌患者个体化治疗提供新的手段,进一步改善患者的预后并提高患者生活质量。
1、DS-8201横空出世,让HER2+和HER2低表达乳腺癌患者获益
DS-8201是一个新型的ADC药物,由人源化抗HER2抗体+伊立替康类化疗药物的偶联药物组成。可裂解的连接子在血液循环中结构稳定,药物脱落率低,从而降低毒副反应,且DS-8201具有高效的“旁观者效应”。DS-8201目前在乳腺癌、胃癌、结直肠癌中进行了若干研究,显示出良好的抗肿瘤活性。
2022年6月5日,《新英格兰医学杂志》(NEJM)在线发表DESTINY-Breast04 研究结果。DESTINY-Breast04研究是一项全球、随机、开放标签3期临床试验,评估曲妥珠单抗-deruxtecan与医生选择的治疗方案(TPC)相比,在 HER2低表达、既往接受过解救治疗(HR阳性患者要求接受过内分泌解救治疗)的不可切除和/或转移性乳腺癌患者中的疗效和安全性。结果显著,引发全球学者的关注,见:NEJM:新型HER2-ADC Enhertu打破HER2低表达的乳腺癌治疗困境(DESTINY-Breast04)。随后FDA加速批准其上市,见:FDA提前4个月加速批准DS-8201治疗HER2低表达乳腺癌,超6成乳腺癌患者均能受益
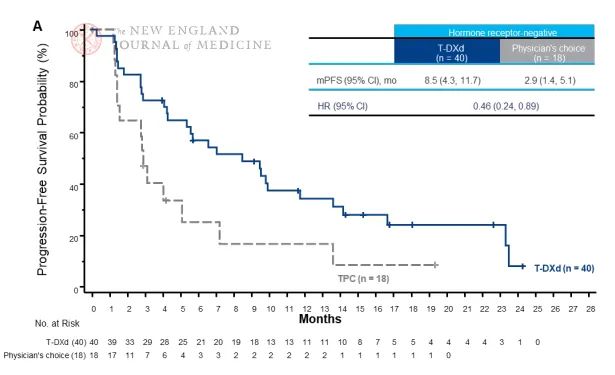
2、T-DXd与T-DM1头对头对比中获胜
与T-DM1头对头对比中,又大获全胜。T-DXd治疗在无进展生存期方面比T-DM1有优势。T-DXd组的无进展生存期中位数未达到(95%CI,18.5至无法估计),T-DM1组为6.8个月(95%CI,5.6~8.2)。T-DXd组12个月后无进展生存率为75.8%,而T-DM1组为34.1%(全因死亡或疾病进展风险为0.28),详细见:Trastuzumab Deruxtecan治疗HER2阳性乳腺癌效果优于trastuzumab emtansine、Enhertu在DESTINY-Breast03中延长HER2阳性转移性乳腺癌统计学意义上总生存,比T-DM1降低死亡风险36%
3、吡咯替尼、DS-8201用于乳腺癌脑转移
(1)吡咯替尼用于乳腺癌脑转移
PERMEATA研究结果显示吡咯替尼联合卡培他滨耐受性良好,对颅内、外病灶均能有效抑制,尤其是既往未经治疗的脑转移患者获益明显。
PERMEATA研究于2019年1月开始,共入组78例有颅内可测量病灶的HER2阳性乳腺癌脑转移患者,其中69例既往接受过曲妥珠单抗的治疗。根据患者中枢神经系统病灶既往局部治疗情况,分为——队列A:未经局部放疗的脑转移患者(N=59);队列B:局部放疗后再次进展的脑转移患者(N=19)。均接受吡咯替尼(400 mg,qd,po)联合卡培他滨(1000mg/m2, bid,po,d1-14,q3w)治疗。主要研究终点为中枢神经系统病灶客观缓解率(CNS ORR)。结果显示队列A的中枢神经系统病灶客观缓解率(CNS ORR)高达74.6%(95%CI:61.6~85.0),其中有7例(11.9%)患者达到完全缓解(CR)。队列B的中枢神经系统病灶客观缓解率(CNS ORR)为42.1%(95%CI:20.3~66.5)。次要终点结果显示,在31例同时伴有颅外可测量病灶的患者中,两个队列非中枢神经系统病灶客观缓解率(Non-CNS ORR)分别为70.4%和50%。中位随访15.7个月,队列A和队列B的中位无疾病进展生存期(PFS)分别为11.3个月(95% CI:7.7~14.6)和5.6个月(95% CI:3.4~10.0)[1]。安全性方面,腹泻和手足综合征是最常见的不良事件,总体可耐受和控制。
(2)DS-8201用于乳腺癌脑转移
这项2期临床试验证实,靶向 HER2 抗体药物偶联物(ADC)药物 Trastuzumab deruxtecan 能够有效治疗甚至清除 HER2 阳性乳腺癌患者的脑转移瘤。这项2期临床试验共15名患者(14名女性,1名男性)参与,他们均患有HER2阳性乳腺癌,且出现了脑转移。研究团队使用了这一ADC药物进行治疗。乳腺癌是女性最常见的癌症,但男性同样也会患乳腺癌(男性乳腺癌占乳腺癌的不到1%),15%的乳腺癌属于HER2阳性乳腺癌,这种乳腺癌易发生转移,而且其中有50%会转移到大脑。
临床试验结果表明,治疗后,15名患者中有11名患者(73.3%)的脑转移瘤缩小,其中2名患者(13.3%)的脑转移瘤完全消失。详细见:Nat Med:临床研究证实,ADC药物可有效治疗乳腺癌的脑转移
4、帕博利珠单抗治疗晚期三阴性乳腺癌获得最终证据支持
在这项3期临床试验的中期分析中,在化疗中加入帕博利珠单抗(pembrolizumab,K药)比单独化疗治疗晚期三阴性乳腺癌患具有更长的无进展生存期,这些患者的肿瘤表达程序性死亡配体1(PD-L1)且联合阳性分数(CPS)为10或以上。最终结果显示在肿瘤表达PD-L1且CPS为10或更高的晚期三阴性乳腺癌患者中,相比单独化疗,在化疗中加入帕博利珠单抗带来了总生存期的明显延长。详细见:NEJM重磅:K药一线治疗三阴乳腺癌OS结果终现!,随后FDA也批准了K药的新适应症。
5、HR+乳腺癌取得系列进展
MONALEESA-2、MONALEESA-3以及MONALEESA-7研究的最新更新结果表明,瑞博西利联合内分泌治疗可为HR阳性、HER2阴性晚期乳腺癌患者带来统计学显著意义的PFS以及OS获益,同时还有相当多的新的研究结果。
(1)瑞博西利加来曲唑治疗晚期HR阳性乳腺癌的总体生存率
激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性疾病是转移性乳腺癌最常见的亚型,并且仍然无法治愈。在之前对该3期试验的分析中,在激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的绝经后患者中,与单独采用来曲唑治疗相比,晚期乳腺癌采用一线瑞博西尼加来曲唑治疗的无进展生存期显著延长。不知道瑞博西尼的总生存期是否也会更长。研究人员报告了方案指定的总生存期最终分析结果,这是一个关键的次要终点。患者以1:1的比例随机分配接受瑞博西尼或安慰剂联合来曲唑。
中位随访6.6年后,瑞博西尼组334名患者(54.2%)发生181例死亡病例,安慰剂组334例(65.6%)患者发生219例死亡病例。与安慰剂加来曲唑相比,瑞博西尼加来曲唑具有显著的总体生存获益。瑞博西尼加来曲唑的中位总生存期为63.9个月(95%CI为52.4至71.0),安慰剂加来曲唑为51.4个月(95%CI为47.2至59.7)(死亡风险比为0.76;95%CI为0.63至0.93;两侧P=0.008)。没有观察到新的安全性事件。
由此可见,在HR阳性、HER2阴性晚期乳腺癌患者中,与安慰剂加来曲唑相比,瑞博西尼加来曲唑的一线治疗能具有显著的总体生存获益。瑞博西尼的中位总生存期比安慰剂长12个月以上。详细见:NEJM:瑞博西尼加来曲唑治疗晚期乳腺癌的总体生存率
(2)氟维司群联合Capivasertib治疗芳香化酶抑制剂耐药性晚期/复发性ER+HER2-乳腺癌
FAKTION研究是一项随机、多中心、双盲、安慰剂为对照的2期临床试验,招募了年满18岁、ER+HER2-、ECOG表现状态0-2分、经芳香化酶抑制剂治疗后进展或复发的转移性/局部晚期的不可手术的乳腺癌女性患者。受试患者被随机(1:1)分成两组,接受氟维司群+Capivasertib或安慰剂治疗直到病情进展、不可耐受的毒性、失访或撤出研究。主要终点是无进展生存期,次要终点包括总生存期和安全性。
2015年3月16日-2018年3月6日期间,筛查了183位患者,其中140位(77%)被随机分至氟维司群+Capivasertib组(n=69)或氟维司群+安慰剂组(n=71)。截止2021年11月25日,Capivasertib组和安慰剂组分别中位随访了58.5个月和62.3个月。Capivasertib组和安慰剂组的最新中位无进展生存期分别是10.3个月和4.8个月(校正风险比[HR] 0.56,p=0.0023)。Capivasertib组和安慰剂组的中位总生存期分别是29.3个月和23.4个月(校正HR 0.66,p=0.035)。FAKTION研究的最新数据显示,氟维司群加用Capivasertib可延长芳香化酶抑制剂耐药性ER+HER2-晚期乳腺癌患者的生存期。详细见:Lancet Oncol:氟维司群联合Capivasertib治疗芳香化酶抑制剂耐药性晚期/复发性ER+HER2-乳腺癌
(3)Abemaciclib联合内分泌治疗高风险早期乳腺癌
MonarchE研究旨在对比HR+HER2-高风险早期乳腺癌患者接受NAC±阿贝西利(Abemaciclib)治疗的疗效和安全性。这是一项多中心、开放标签的3期随机试验,招募了HR+HER2-淋巴结阳性、高复发风险的早期乳腺癌患者,随机(1:1)分成两组,予以标准的内分泌(ET)治疗至少5年,加用或不加用阿贝西利(150 mg,2次/日)治疗2年。主要终点是无侵袭性疾病生存率(IDFS)和无侵袭性疾病生存率(DRFS)。
2017年7月至2019年8月期间,共有2056位患者(平均49.9岁,2046位女性)进行了NAC治疗。截止2020年7月8日,中位随访了19个月。在亚组分析中,与单纯内分泌治疗相比,内分泌+阿贝西利治疗可明显改善患者的IDFS(HR 0.61)和DRFS(HR 0.61),相应的两年IDFS率和两年DRFS率分别绝对提高了6.6%和6.7%。而且,在病理乳腺肿瘤大小或阳性淋巴结数量的亚组中观察到了一致的治疗获益。
总之,阿贝西利联合内分泌辅助治疗可显著改善HR+HER2-、淋巴结阳性高复发风险早期乳腺癌患者的生存预后,包括无侵袭性疾病生存率和无侵袭性疾病生存率。详细见:JAMA Oncol:Abemaciclib联合内分泌治疗高风险早期乳腺癌
(4)新型高选择性CDK4/6抑制剂达尔西利可降低患者50%的疾病进展或死亡风险
DAWNA-1研究探索了达尔西利联合氟维司群治疗既往接受内分泌治疗后出现疾病进展的HR阳性、HER2阴性晚期乳腺癌的有效性及安全性,基于其中期分析的疗效,2021年12月获国家药品监督管理局批准上市。2022年ESMO大会更新了最新随访数据,达尔西利+氟维司群组和安慰剂+氟维司群组的中位PFS时间分别为16.6个月和7.2个月,与安慰剂组相比,达尔西利组可降低患者50%的疾病进展或死亡风险(单侧P < 0.0001),进一步支持该方案作为既往内分泌治疗后进展的新选择。DAWNA-2研究评估了达尔西利联合来曲唑或阿那曲唑一线治疗HR阳性、HER2阴性晚期乳腺癌的疗效和安全性,达尔西利+来曲唑/阿那曲唑组的研究者评估的中位PFS时间为30.6个月,较安慰剂+来曲唑/阿那曲唑组显著延长12.4个月,疾病进展或死亡风险降低49.0%,进一步支持该方案作为一线治疗的新选择。
6、低危导管原位癌 (DCIS) 保守手术后精准放疗
有研究发现,全乳照射 (WBI) 后强化肿瘤床治疗可显著降低大部分侵袭性乳腺癌患者的局部复发率,但尚无随机试验证实。该研究调查了 WBI 后强化肿瘤床放疗是否可以改善非低风险 DCIS 患者的预后,并评估了非低风险 DCIS 患者的放疗剂量分割敏感性。
这是一项在多个国家开展的国际性、随机、非盲的3期临床试验,招募了年满18岁的单侧的组织学明确诊断的接受保乳手术治疗的非低风险 DCIS 女性患者,随机(1:1:1:1)分成四组:无肿瘤床强化 vs 常规 WBI 后强化 vs 大分割 WBI 后强化,或随机(1:1)分至无强化 vs 每次常规 WBI 后强化 vs 每次大分割 WBI 后强化。常规 WBI 总剂量是 50Gy,分成25次,大分割 WBI总剂量是42.5Gy,分成16次。强化剂量是16Gy,分成8次。主要终点是局部复发的时间。
2007年6月25日-2014年6月30日,共1608位患者被随机分至无强化组(805位)或强化组(803位)。831位患者进行了常规 WBI,777位患者进行了大分割 WBI。中位随访了6.6年。无强化组和强化组的5年无局部复发生存率分别是92.7%和97.1%(HR 0.47,p<0.001)。强化组有更高的≥2级的乳腺疼痛(10% vs 14%)和硬结率(6% vs 14%,p<0.001)。
综上,对于切除后的非低危乳腺导管原位癌患者,全乳放疗后对肿瘤床进行强化放疗可减少局部复发率,但同时会增加 2 级及以上毒性的发生率。该研究是首个证实这类患者术后WBI后强化放疗可改善局部控制情况的随机试验。详细见:Lancet:非低风险乳腺导管原位癌的放疗剂量和分割方案
7、抗Trop-2靶向治疗在乳腺癌初见成效
人滋养层细胞表面抗原2(Trop-2)是一种跨膜钙信号转导子,与肿瘤进展和预后不良有关。Trop-2在多种实体瘤中高表达,其中乳腺癌高表达比例约为78%。戈沙妥珠单抗(sacituzumab govitecan,SG)是由抗Trop2人源单克隆抗体与细胞毒性代谢物SN-38偶联而成的新型ADC,已获批适应证用于既往接受过至少二线治疗的转移性TNBC患者。
TROPiCS-02随机对照III期研究旨在探索SG在接受过内分泌治疗、CDK4/6抑制剂及二线至四线化疗的HR阳性、HER2阴性转移性乳腺癌患者中的疗效与安全性。SG与医生选择化疗相比,主要研究终点PFS时间为5.5个月和4.0个月,进展或死亡风险显著减少34%,第二次中期分析次要终点OS时间为14.4个月和11.2个月,总死亡风险显著减少21%。安全性方面,两组≥3级治疗相关不良事件发生率分别为74%和60%,SG组并未出现新的安全信号,且显著改善总体健康相关生活质量。基于此研究结果,NCCN指南推荐,既往内分泌治疗、CDK4/6抑制剂、至少二线化疗(含紫杉类)治疗进展后的HR阳性转移性乳腺癌,可考虑选择SG(ⅡA类证据)。这提示SG可为CDK4/6抑制剂耐药且多线治疗失败的HR阳性、HER2阴性晚期乳腺癌患者提供新的治疗选择。详细见:ASCO2022 | TROPiCS-02临床重磅发布:戈沙妥珠单抗使HR+/HER2-MBC进展或死亡降低34%!、J Clin Oncol:Sacituzumab govitecan治疗内分泌耐药的HR+/HER2– 晚期乳腺癌、ESMO 2022:Sacituzumab Govitecan-hziy在HER2-低表达/HER2-0转移性乳腺癌中显示出有前景的疗效(TROPiCS-02研究)
在关键的3期ASCENT研究(NCT02574455)中,SG在基线时无已知脑转移的二线或以上(2L+) mTNBC患者的主要分析人群中显示,与单药化疗医生选择治疗(TPC)相比,SG具有显著的生存优势(Bardia A et al. NEJM 2021)和生命质量(Loibl S. et al.ESMO 2021)。通过后续随访,本次展示了最终的疗效数据,包括总生存期(OS)、安全性和生活质量。
在529例入组患者中,468例基线时未发现脑转移(中位年龄:54岁[范围27-82];既往治疗线中位数:4[范围,2-17])。截至2021年2月25日(最终数据库锁定),SG (n = 235) vs TPC (n = 233)显著提高了PFS中位数(5.6 vs 1.7个月;HR:0.39;p<0.0001)和中位OS (12.1 vs 6.7个月;HR:0.48; < 0.0001)。研究组24个月时的OS率为22.4% (95% CI, 16.8-28.5), TPC组为5.2% (95% CI, 2.5-9.4)。详细见:ASCO 2022 | ASCENT临床大胜收官:面对「老大难」mTNBC,戈沙妥珠单抗实现OS/PFS双获益!
8、早期靶向治疗bESR1突变可为晚期乳腺癌患者带来显著疗效
在雌激素受体阳性、HER2阴性的晚期乳腺癌中,芳香化酶抑制剂的获得性耐药通常源于ESR1突变的亚克隆,这些亚克隆可能对氟维司群敏感。PADA-1试验旨在探究在血液ESR1(bESR1)突变上升的基础上,早期改变治疗的有效性,同时评估氟维司群与帕博西尼联合使用的整体安全性。
这是一项随机的、开放标签的3期临床试验,招募了年满18岁、ECOG表现状态0-2分、雌激素受体阳性、HER2阴性晚期乳腺癌患者,检测其芳香化酶抑制剂(来曲唑 2.5mg,阿那曲唑 1mg或依西美坦 25mg,1/日)和帕博西尼(125mg/日,连服3周,停1周)一线治疗期间bESR1突变的上升情况。循环肿瘤DNA新出现或bESR1突变增加的且无同时疾病进展的患者被随机(1:1)分至两组,接受相同治疗方案或改为氟维司群(500mg)+帕博西尼治疗。主要终点是自随机分组后的无进展生存期和不良反应。
2017年3月22日至2019年1月31日,共纳入了1017位患者,其中279位(27%)出现bESR1突变上升,172位(17%)被随机分至两组:88位改为氟维司群+帕博西尼治疗,84位继续用原方案治疗。截止2021年7月31日,从纳入起中位随访了35.3个月,从随机分组起中位随访了26.0个月。氟维司群+帕博西尼组和芳香化酶抑制剂+帕博西尼组从随机分组起的中位无进展生存期分别是11.9个月和5.7个月(分层HR 0.61,p=0.0040)。
最常见的≥3级血液学不良反应事件有中性粒细胞减少症(70.3%)、淋巴细胞减少(6.5%)和血小板减少症(2.0%)。在第2阶段最常见的≥3级不良反应有中性粒细胞减少症(芳香化酶抑制剂+帕博西尼 vs 氟维司群+帕博西尼:41.7% vs 44.3%)和淋巴细胞减少(3.6% vs 4.5%)。31位(3.1%)患者经历了3级及以上的与治疗相关的不良反应事件。详细见:Lancet Oncol:早期靶向治疗bESR1突变可为晚期乳腺癌患者带来显著疗效
9、cT1-2N1乳腺癌初始化疗后可根据复发风险进行适应性的降级放疗
乳腺癌的初次化疗在辅助局部放疗方面存在两难选择,因为局部放疗的指南最初是基于初次手术的病理结果。该研究目的是根据预先确定的、基于共识的研究指南,评估降级局部放疗对接受初次化疗的cT1-2N1期乳腺癌患者的肿瘤学安全性。
这项前瞻性的注册研究纳入了于2011年1月1日-2015年1月1日期间转诊至荷兰17个放射肿瘤中心之一、并接受了初次化疗和乳腺级腋窝手术治疗的cT1-2N1期乳腺癌患者。研究指南包括三个局部复发风险组,并提供相应的局部放疗建议:低危组不进行胸壁放疗和区域放疗,中危组只进行局部放疗,高危组进行区域放疗。放疗包括 25 次 2 Gy 的生物等效剂量,加量或不加量。主要终点是区域复发率。研究人员假设,5年区域复发率应低于4%。
838位患者符合 5 年随访分析的条件:低危组 291位,中危组 370位,高危组 177位。所有患者的 5 年区域复发率为 2.2%。低危组 、中危组和高危组的5年区域复发率分别是2.1%、2.2%和2.3%。如果遵循研究指南,则低风险组、中风险组和高风险组的局部区域复发率分别是2.3%、1.0%和1.4%。详细见:Lancet Oncol:cT1-2N1乳腺癌初始化疗后可根据复发风险进行适应性的降级放疗
10、Encequidar治疗转移性乳腺癌优胜静脉紫杉醇
静脉紫杉醇 (IVpac) 因神经病变而复杂化,需要提前用药以预防超敏反应型反应。紫杉醇口服吸收不良;Encequidar (E) 是一种新型 P-糖蛋白泵抑制剂,可促进口服紫杉醇的吸收。
这是一项开放标签的III期临床试验,旨在比较转移性乳腺癌女性患者采用口服紫杉醇+E(oPac+E:紫杉醇 205 mg/m2,E 15 mg,每周连服3天)与IVpac(175 mg/m2,1次/3周)治疗的效果与安全性。有合适的器官功能、且末次紫杉烷用药至少满1年的转移性乳腺癌女性患者被随机(2:1)分至oPac+E组或IVpac组。主要终点是确认的影像学缓解率。次要终点包括无进展生存期(PFS)和总生存期(OS)。
从拉丁美洲共招募了402位患者(oPac+E组 265位,IVpac组 137位)。oPac+E组和IVpac组的确认的缓解率分别是36%和23%(p=0.01)。oPac+E组和IVpac组的PFS分别是8.4个月和7.4个月(风险比[HR] 0.768,p=0.046),OS分别是22.7个月和16.5个月(HR 0.794,p=0.08)。
oPac+E组和IVpac组的3-4级不良反应发生率分别是55%和53%。与IVpac组相比,oPac+E组的神经病变和脱发的发生率更低,严重程度更轻,但恶心、呕吐、腹泻和中性粒细胞减少并发症更高,特别是在肝酶升高的患者中。oPac+E组和IVpac组分别有3%和0%的病例死亡是与治疗相关。详细见:J Clin Oncol:口服紫杉醇+Encequidar治疗转移性乳腺癌优胜静脉紫杉醇


