收藏!血液瘤CAR-T细胞疗法热门靶点大汇总!
时间:2023-05-06 11:25:36 热度:37.1℃ 作者:网络
作为活药,嵌合抗原受体(chimeric antigen receptor, CAR)T细胞免疫疗法,以其特异性成为最具有前途的细胞免疫疗法,通过CAR基因修饰的T细胞过继移植,在血液系统恶性肿瘤的治疗中显示出了显著的疗效。
截止到目前,全球共有8款CAR-T产品获批上市。其中,FDA批准上市的有7款(表1),国内获批2款(表2)。
药物
靶点
适应症
时间
Kymriah(tisagenlecleucel)
CD19
B细胞前体急性淋巴细胞白血病;复发或难治性弥漫大B细胞淋巴瘤
2017.08.30
Yescarta(axicabtagene ciloleucel)
CD19
复发或难治性大B细胞淋巴瘤;复发或难治性滤泡性淋巴瘤
2017.10.18
Tecartus(brexucabtagene Autoleucel)
CD19
复发或难治性套细胞淋巴瘤
2020.07.24
Breyanzi(lisocabtagene maraleucel)
CD19
复发或难治性大B细胞淋巴瘤
2021.02.05
Abecma(idecabtagene vicleucel)
BCMA
复发或难治性多发性骨髓瘤
2021.03.26
Carvykti(ciltacabtagene autoleucel)
BCMA
复发或难治性多发性骨髓瘤
2022.02.28
表1. FDA批准的6款CAR-T细胞疗法
药物
靶点
适应症
时间
阿基仑赛注射液
CD19
成人复发或难治性大B细胞淋巴瘤
2021.06.23
瑞吉奥伦塞注射液
CD19
成人复发或难治大B细胞淋巴瘤
2021.09.03
表2. 国内批准的2款CAR-T细胞疗法
关于CAR-T疗法的靶点,CD19、BCMA 仍然是最流行的抗原靶点,其他研究比较多包括CD19、CD22、CD123、BCMA等,那么在血液系统肿瘤中,目前CAR的热门靶点都有哪些?
B细胞恶性肿瘤
CD19
以CD19为靶点的CAR-T细胞是B系血液恶性肿瘤领域一种革命性的免疫治疗方法。CD19 CAR-T细胞疗法在复发/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)和非霍奇金淋巴瘤(NHL)患者中取得了快速和持久的疗效,而且慢性淋巴细胞白血病的治疗中也取得一定成果。
CD20
随着单靶点CAR-T面临的问题各种显现,双靶点CAR-T应运而生,是解决CAR-T治疗无应答和复发/耐药的一大策略。
CD20是一种人B淋巴细胞限制性分化抗原,主要存在于前B和成熟B淋巴细胞上,表达于大部分B细胞非霍奇金淋巴瘤细胞上,但不表达于干细胞、原B细胞、正常浆细胞或者其他正常组织,是治疗B-NHL/CLL的有效靶点。
MB-106是一种全人源、第三代、CD20靶向CAR-T细胞疗法,含有4-1BB和CD28共刺激结构域,其改良的IgG1间隔区消除了FcR结合。用于治疗复发或难治性B细胞非霍奇金淋巴瘤(B-NHL)和慢性淋巴细胞白血病(CLL)。C-CAR039是一种新型的第二代双特异性CAR-T,主要靶向CD19和CD20抗原,具有优化双特异性抗原结合域的作用,总缓解率达88%。
CD22
CD22在B细胞恶性肿瘤中广泛高表达,包括慢性淋巴细胞白血病、非霍奇金淋巴瘤和急性淋巴细胞白血病等。目前靶向CD22的CAR-T疗法在ALL治疗中取得一定成果,但在治疗其他B细胞肿瘤中需要更多证据,而且可以考虑联合其他靶点,以克服免疫逃逸等问题。
T细胞恶性肿瘤
对于T细胞恶性肿瘤,临床上缺乏T细胞肿瘤特异性CAR-T靶抗原。
CD3
CD3是T细胞恶性肿瘤免疫治疗的有利靶点,但使用CD3作为T细胞恶性肿瘤的CAR-T治疗靶点,由于自相残杀,可能导致不良反应。
CD7
CD7是来自Ig超家族的跨膜糖蛋白,是T细胞表面的高特异性靶点,在95%T淋巴细胞白血病(T-ALL)病例以及T和NK细胞谱系中表达,与大多数T细胞血液肿瘤相关,是潜在的CAR-T治疗靶点。但是传统制备工艺的CD7 CAR-T不仅会杀灭CD7高表达的肿瘤细胞,也会“误杀”同样表达CD7的CAR-T细胞,最终导致CAR-T细胞的数量大幅降低。
AML
在B细胞恶性肿瘤中,CAR-T细胞取得较好的疗效,但CAR-T对AML的治疗价值仍未确定。
CD123
CD123,在各种血液系统恶性肿瘤中广泛高表达,包括急性髓细胞白血病(AML)、B细胞急性淋巴细胞白血病、霍奇金淋巴瘤、原发性浆细胞样树突状肿瘤(BPDCN)等。在白血病干细胞和分化程度更高的白血病细胞中都有表达,这使得CD123成为有吸引力的CAR-T治疗靶点。众多研究已经肯定了抗CD123-CAR-T细胞在AML患者中的治疗效果,但仍提出了血液学毒性的问题。
CD33
CD33是Siglecs家族的67 kDa 糖基化跨膜蛋白,在几乎90%的AML病例中表达于白血病细胞亚群,包括白血病干细胞,以及一些正常的髓系祖细胞。CAR-T细胞治疗不良反应(包括CRS、ICANS)是临床前实验和CD33靶向治疗临床试验中不可回避的问题,也是目前临床应用需要克服的难题。
CLL-1
白血病干细胞(leukemic stem cell,LSC)被认为是AML治疗失败和复发的主要原因。CLL-1是Ⅱ型跨膜糖蛋白,在造血干细胞上表达,也在急性髓细胞性白血病、急性淋巴表白血病、毛细胞白血病等肿瘤细胞上过表达,促进肿瘤细胞的过度增殖,是治疗AML的有效靶标。
有研究报道3例儿童AML患者接受抗CLL-1-CAR-T细胞治疗后,均达到了完全缓解。来自西部战区总医院刘芳团队开发的CLL1-CD33双靶点CAR-T疗法,在治疗AML时显示出积极的疗效。
FLT3
Fms样酪氨酸激酶3 (FLT3)是AML中最常见的基因突变之一,约占AML病例的30%。研究显示,抗FLT3-CAR-T细胞在体外有很强的FLT3+AML细胞杀伤能力,能延长AML小鼠的生存期且不会损伤健康的造血干细胞。
CD38在大多数AML细胞上表达,但在健康的人类造血干细胞上不表达,也是治疗AML的潜在靶点。另外,其他有效的CAR-T治疗潜在靶点如跨膜糖蛋白CD7、白细胞免疫球蛋白样受体B4(LILRB4)、双岩藻糖基化的碳水化合物抗原LewisY(LeY)和CD70等均值得期待!
多发性骨髓瘤
BCMA特异性表达于B细胞谱系,主要是成熟B细胞到浆细胞分化的终末阶段,并广泛表达于骨髓瘤细胞,是多发性骨髓瘤理想的治疗靶标。截至目前,已有两款以BCMA为靶点的CAR-T ide-cel和cilta-cel先后获得FDA批准用于治疗复发难治性多发性骨髓瘤。
其他还包括CD19、信号淋巴细胞激活分子家族成员7(SLAMF7,又名CS1)、κ轻链、CD38、CD138、NKG2D、CD56、CD44v6和G蛋白偶联受体家族C组5成员D(GPRC5D)等。具体如下表。
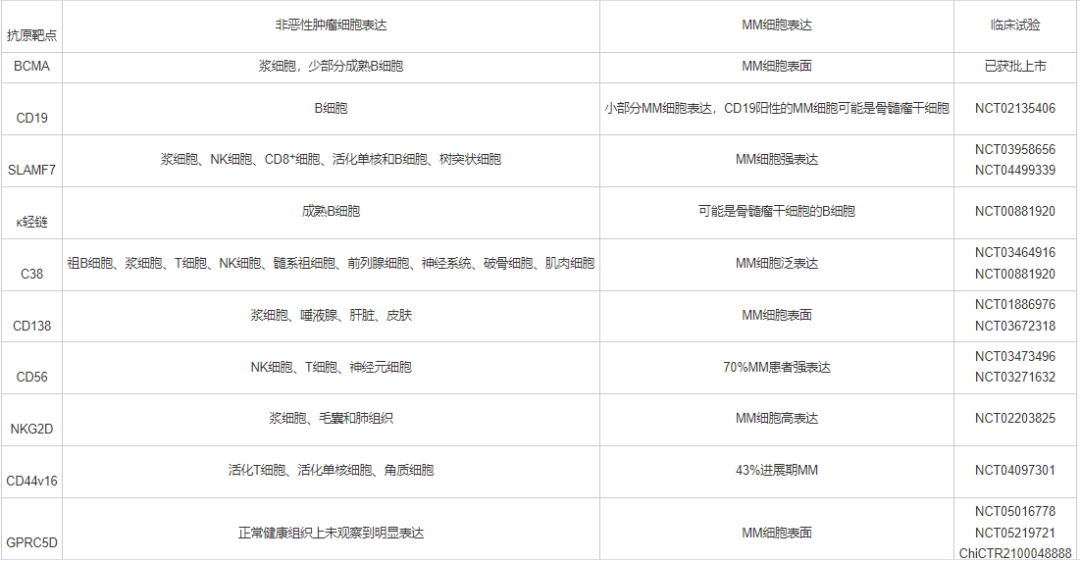
参考文献:
1.朱晶晶,林伟,王建勋.CAR-T细胞免疫疗法在血液恶性肿瘤治疗中的研究现状[J].实用癌症杂志,2022,37(12):2086-2088.
2.肖植文,喻敏,李菲.CAR-T细胞治疗在急性髓系白血病中的研究和应用进展[J].中国肿瘤临床,2022,49(20):1052-1055.
3.王莹,徐开林.CAR-T治疗多发性骨髓瘤的进展[J].临床内科杂志,2022,39(09):589-593.
4.刘晓珍,王玉霞,佟红艳.CAR-T疗法治疗急性髓系白血病的相关靶点研究进展[J].中国实用内科杂志,2022,42(10):864-870.


