Neuron | 中山大学唐亚梅教授团队发现小胶质细胞通过趋化外周CD8+ T细胞浸润脑实质引发脑损伤的新机制
时间:2023-01-09 15:01:33 热度:37.1℃ 作者:网络
放射性脑损伤(radiation-induced brain injury,RIBI)是头颈部肿瘤放疗后严重的并发症,多发于放射治疗结束后3-5年,临床表现为认知障碍或癫痫等症状,病理改变为脑组织水肿、坏死等,严重影响患者生活质量。目前放射性脑损伤的发病机制不明确,治疗手段有限,使得放射性脑损伤的临床防治成为领域内的关键难题之一。
2023年1月5日,中山大学孙逸仙纪念医院脑科学研究中心、神经科唐亚梅教授团队在Neuron 上发表了题为“Microglia drive transient insult-induced brain injury by chemotactic recruitment of CD8+ T lymphocytes”的研究论文,阐明了放射后小胶质细胞通过分泌趋化因子CCL2及CCL8,吸引CD8+ T细胞浸润脑组织并引发脑损伤的机制,为放射性脑损伤的治疗提出新的干预策略。

近年来,在阿尔兹海默症、帕金森病等神经疾病中,陆续发现了获得性免疫的重要参与者T淋巴细胞对脑脊液及脑组织的浸润现象,然而T淋巴细胞浸润中枢神经系统的机制及可能的致病机理仍有待阐明。在本研究中,为了系统地研究参与放射性脑损伤的细胞类型和分子机制,作者首先对放射性脑损伤病灶切除手术中获得的组织标本进行了单细胞转录组测序分析,发现病灶中存在显著的CD8+ T细胞浸润现象。同时,针对不同患者病灶组织的单细胞TCR测序结果也显示,浸润脑组织的CD8+ T细胞发生了显著的克隆扩增。
多方面证据提示浸润的CD8+ T细胞可能引起脑组织损伤,作者在CD8a-DTR转基因小鼠和野生型小鼠上依据课题组前期研究成果(He, et al, FASEB journal, 2020)制备放射性脑损伤模型,分别使用白喉毒素或Cd8a中和抗体系统性敲除全身CD8+ T细胞,发现CD8+ T细胞敲除后脑损伤病灶显著缩小,证实了CD8+ T细胞在介导放射性脑损伤发生中具有关键作用。
接下来,作者对放射后CD8+ T细胞如何浸润脑组织的机制展开进一步的探索。通过细胞互作分析,发现了一群高表达CCL2及CCL8等趋化因子的小胶质细胞亚群可能引发了CD8+ T细胞趋化入脑。应用RNAscope染色、体外实验以及小胶质细胞特异性敲除CCL2或CCL8的转基因小鼠模型,中和抗体以及小分子抑制剂等手段,作者证明通过干预CCL2/CCL8-CCR2/CCR5信号通路可有效抑制CD8+ T细胞迁移,显著减轻放射性脑损伤病灶。
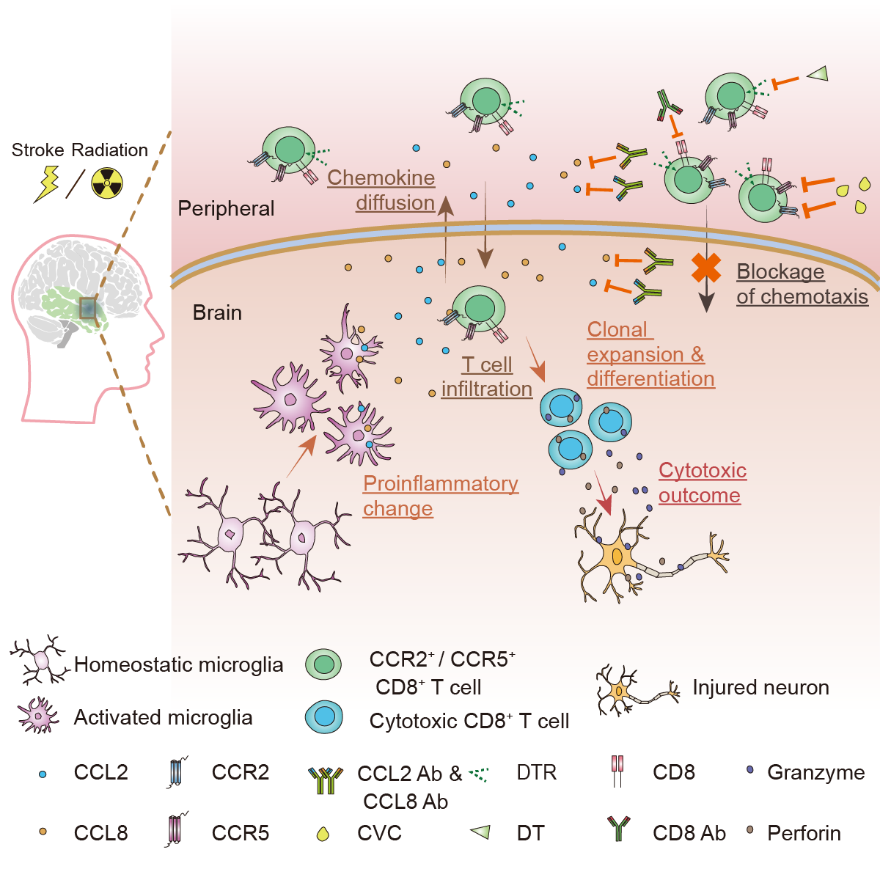
全文总结图(图源自Neuron )
有文献报道在诸如脑缺血等其他神经疾病中,也存在外周CD8+ T细胞向中枢神经系统的浸润。因此,研究团队进一步探索上述CCL2/CCL8-CCR2/CCR5信号通路是否同样参与了其他脑疾病,并且最终确定了阻断该信号通路可显著减轻大脑中动脉缺血(MCAO)导致的脑损伤。
本研究首次证明了大脑在受到射线或者脑缺血的刺激后,小胶质细胞通过分泌趋化因子CCL2及CCL8,吸引外周CD8+ T细胞浸润,释放穿孔素和颗粒酶等细胞毒性因子,引起大脑的继发性损伤。同时,本文也首次为通过抑制T淋巴细胞介导的获得性免疫来防治放射性脑损伤和脑缺血等脑疾病提供了创新理论和实验基础。
该研究在国家自然科学基金杰出青年项目、重点国际合作项目等基金资助下完成,中山大学孙逸仙纪念医院脑科学研究中心、神经科的博士后石中山、喻佩,林伟杰副研究员及研究助理陈斯泰为论文共同第一作者,唐亚梅教授为论文唯一通讯作者。该研究同时得到了美国梅奥诊所的Long-Jun Wu教授及香港中文大学Ho Ko教授的大力支持。
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(22)01082-0


