清华大学刘俊杰/王家发现新的编辑器,为DNA操作提供了一个高效而紧凑的平台
时间:2023-01-22 15:01:59 热度:37.1℃ 作者:网络
CRISPR-Cas模块作为原核生物的适应性核酸免疫系统,为各种生物的核酸操作提供了多功能工具。
2023年1月17日,清华大学刘俊杰及王家共同通讯在Cell Research在线发表题为“The compact Casπ (Cas12I) ‘bracelet’ provides a unique structural platform for DNA manipulation”的研究论文,该研究表明紧凑的Casπ (Cas12I)“手镯”为DNA操作提供了一个独特的结构平台。该研究从环境宏基因组中发现了一个新的微型V型系统,CRISPR-Casπ (Cas12I) (~860 aa)。Casπ (Cas12I)与由tracrRNA和crRNA组成的大引导RNA (~170 nt)配合,在广泛的生化条件下识别独特的富含5 ' C的PAM用于DNA切割,并在哺乳动物细胞中产生基因编辑。
Cryo-EM研究揭示了Casπ效应子以3.4 Å分辨率环绕DNA目标的“手镯”结构,与Cas12和Cas9核酸酶的典型“双瓣”结构有很大不同。大引导RNA作为效应器组装的“双臂”支架。该研究扩展了CRISPR效应器对DNA靶向机制的认识,并为DNA操作提供了一个高效而紧凑的平台。
CRISPR和CRISPR相关基因(Cas)作为许多原核生物和巨大噬菌体对抗核酸入侵的适应性免疫模块。一般来说,CRISPR免疫应答包括DNA适应、效应生物发生和核酸干扰三个阶段。CRISPR效应体具有出色的工程能力,可提供RNA引导的DNA靶向和切割活性,在许多生物中也被有效地重新利用为基因组、表观基因组和转录操作工具。
尽管越来越多的CRISPR-Cas效应物已经在体外证实了DNA干扰活性,但其中只有少数几个,如SpyCas9和AsCas12a,基本上起作用,并被广泛用于体内高效的基因组编辑。在这些少数效应物中,Cas核酸酶的大分子尺寸(1200-1400个氨基酸(aa))在很大程度上限制了将载体运送到靶细胞的选择。此外,尽管最近有几种类型的Cas核酸酶< 1000 aa的紧凑效应器被用于基因组编辑,但这些紧凑系统的初始版本都表现出较弱或中等的编辑效果,需要广泛和持续的优化才能进一步应用,类似于过去十年中基于SpyCas9的技术的发展。此外,所有这些紧凑效应子都能识别富含T的原间隔相邻基序(PAM),这在很大程度上限制了基因编辑实践中的靶向范围。已经进行了结构设计和定向进化来改变PAM对Cas效应子的偏好,但经常观察到这些突变体的编辑效力或保真度显著降低。因此,提供独特靶向范围的紧凑但高效的效应器对于克服当前基因编辑工具箱中的应用限制至关重要。
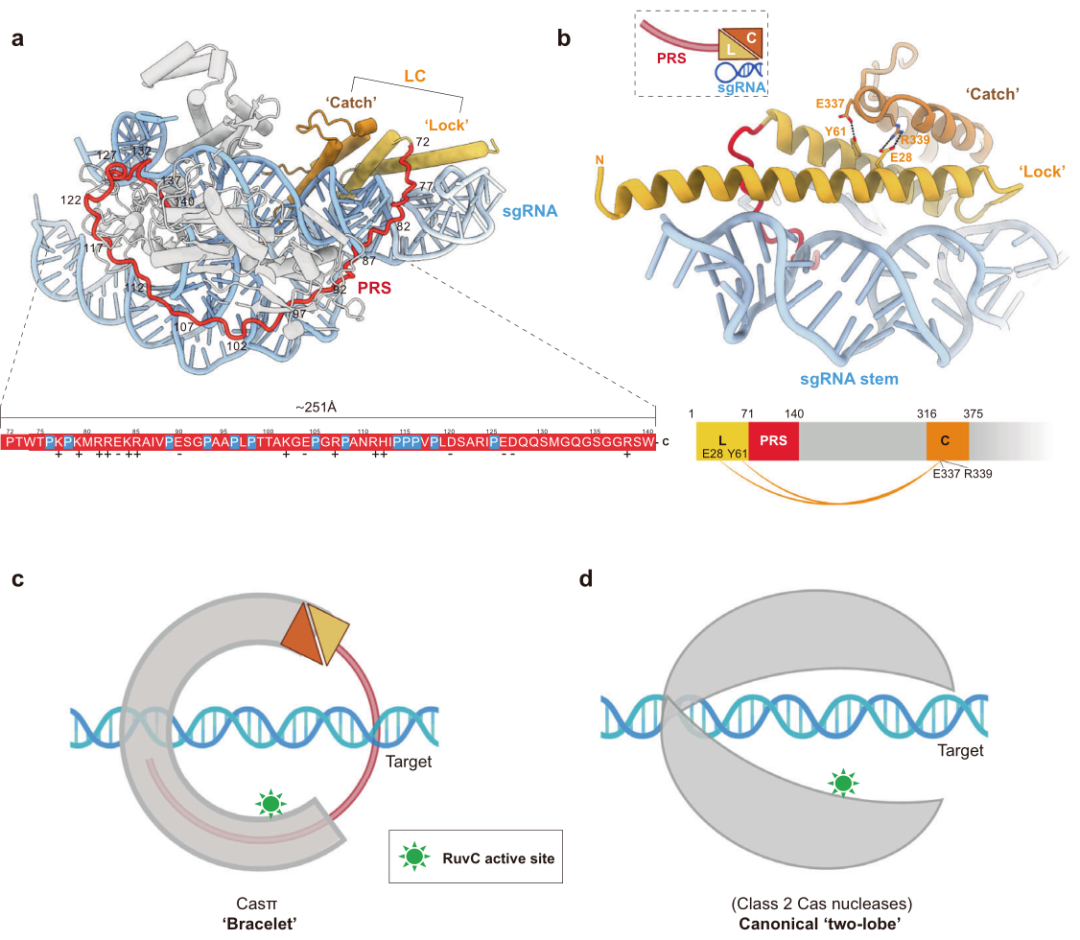
Casπ的“手镯”结构(图源自Cell Research )
在本研究中,通过大规模生物信息学筛选和人工注释,作者发现CRISPR-Casπ是一种不同于已报道家族的新型V型系统,具有丰富的C- PAM偏好、紧凑的尺寸、对各种生化条件的耐受性和高效的反式活性等独特的基因编辑应用潜力。值得注意的是,在没有任何优化的情况下,与SpyCas9和LbCas12a基准测试相比,初级版本的Casπ效应器(~860 aa)显示出强大的编辑能力。这有力地表明,Casπ具有巨大的潜力,可以通过理性设计或定向进化进行很大程度的改进,类似于SpyCas9或其他基于效应器的技术在过去十年中的开发。
同时,作者的Cryo-EM研究揭示了Casπ的“手镯”结构,为功能模块集成和工程提供了一个全新的结构平台。此外,考虑到Casπ蛋白的识别细节,“双臂”sgRNA也具有很大的工程能力,特别是在伸展的A-II元件内。总的来说,该研究结果提供了一个新颖而紧凑的DNA操纵平台,极大地扩展了CRISPR工具箱,并为进一步探索CRISPR生物学提供了新的方面。
原文链接:
https://doi.org/10.1038/s41422-022-00771-2


