Nature子刊 | 中国科学院杨运桂等团队合作开发新的方法,揭示了m6A在卵母细胞成熟和早期胚胎发育过程中的动态单细胞景观
时间:2023-01-22 15:01:58 热度:37.1℃ 作者:网络
m6A已被证明可以调节RNA代谢和各种生物学过程,包括配子体发生和胚胎发生。然而,在哺乳动物卵母细胞中或着床前,m6A在单细胞分辨率下的结构和功能尚未得到广泛研究。
2023年1月19日,中国科学院北京基因组研究所杨运桂、杨莹、中国农业大学韩建永及郑州大学孙莹璞共同通讯在Nature Communications 在线发表题为“scm6A-seq reveals single-cell landscapes of the dynamic m6A during oocyte maturation and early embryonic development”的研究论文,该研究利用scm6A-seq揭示了m6A在卵母细胞成熟和早期胚胎发育过程中的动态单细胞景观。该研究开发了一种单细胞m6A序列分析(scm6A-seq)方法,同时分析卵裂期胚胎单个卵母细胞/卵裂粒中的m6A甲基化组和转录组。该研究发现m6A缺陷导致异常RNA清除,从而导致Mettl3Gdf9条件敲除(cKO)卵母细胞质量低下。
该研究进一步揭示了m6A分别在中期II (MII)卵母细胞和卵母细胞到胚胎转化过程中调节修饰RNA的翻译和稳定性。此外,作者在双细胞胚胎的卵裂球之间的表观转录组中观察到m6A依赖性的不对称。因此,scm6A-seq可以深入研究m6A的特征和功能,这些发现为描述配子发生和早期胚胎发育的潜在机制提供了宝贵的单细胞分辨率资源。

m6A是真核生物转录组中最重要的RNA修饰之一。m6A存在于整个转录组中,主要富集在mRNAs的编码区和3 ' UTR。因此,m6A被广泛研究在配子发生和胚胎发育事件中发挥广泛的调节功能。许多研究强调了m6A在卵母细胞发育中的作用。在斑马鱼中,m6A修饰的母体转录本倾向于被Ythdf2识别,并且降解速度比未甲基化转录本更快。在小鼠中,Mettl3缺乏导致雌性高度无菌表型,具有卵母细胞排卵异常和卵母细胞成熟紊乱的特征。Ythdf2缺失导致减数分裂成熟期间女性特异性不育和母体转录剂量。
m6A甲基转移酶复合物组分KIAA1429在生发囊泡(GV)卵母细胞中高度表达,雌性小鼠KIAA1429缺失后卵巢变小,伴环绕核仁(SN)卵母细胞数量明显减少,卵母细胞能力异常。而在卵裂期胚胎中,母体的Mettl3缺失受精卵在细胞期被抑制。合子的Mettl3敲除导致合子基因组激活(ZGA)失败,GV卵母细胞到细胞胚胎m6A丰度降低。
小鼠合子胚胎的ZGA始于细胞胚胎晚期,许多研究指出了染色质重塑在合子转录启动中的意义,包括DNA甲基化、组蛋白修饰、染色质可及性、高阶染色质结构形成和RNA聚合酶II (Pol II)结合。有趣的是,除了新合成的合子转录本外,依赖ZGA的母体RNA清除过程对早期胚胎发育至关重要。此外,ZGA期间的RNA代谢导致了卵裂球表观基因组修饰的异质性,并提示在细胞胚胎阶段启动了转录组范围内的调节。
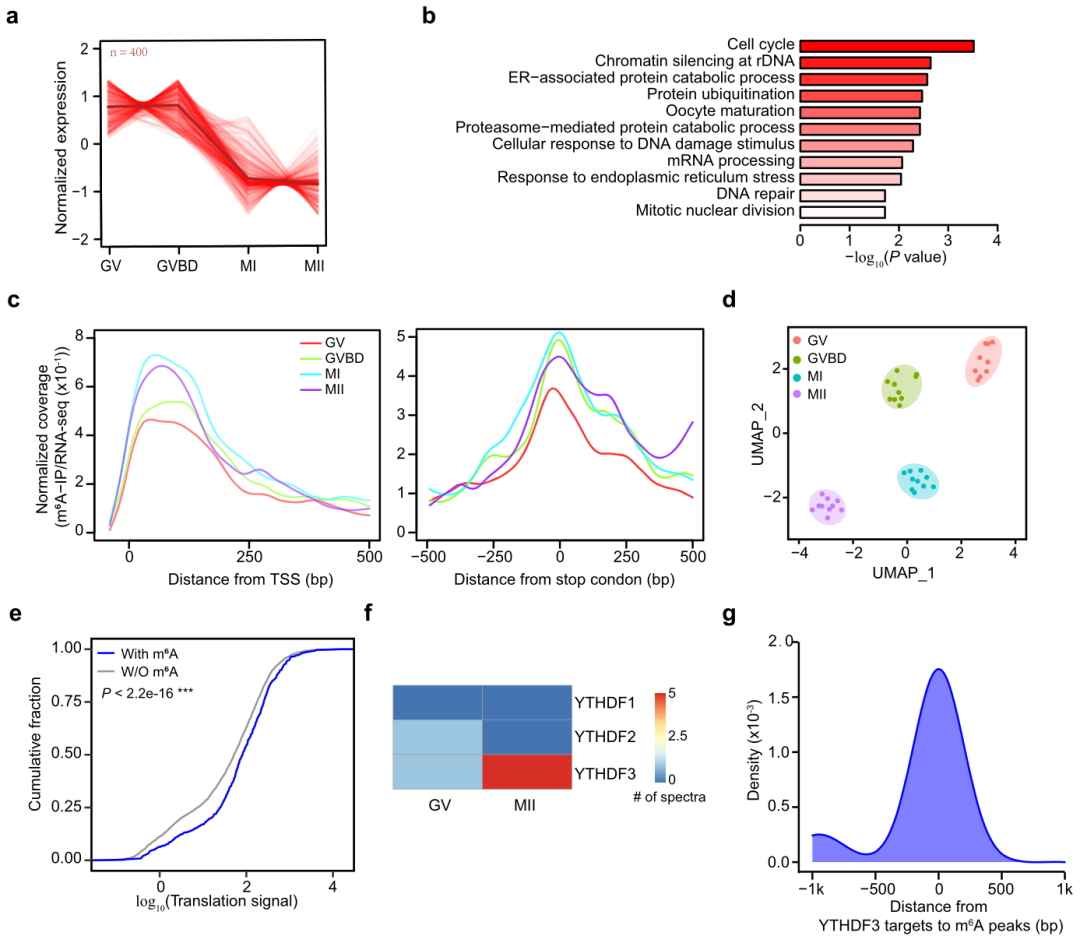
卵母细胞成熟过程中的动态m6A景观(图源自Nature Communications )
先前的研究已经描述了卵母细胞和胚胎早期阶段的单细胞转录组和低输入的翻译体和m6A甲基化组的情况。但单细胞水平RNA甲基化的特征和功能尚不清楚。现有的方法主要是基于抗体富集、敏感酶解或化学转化,已经开发出从大量到低输入样本的转录组范围内m6A的轮廓和特征。最近,使用外源表达的APOBEC1-YTH结构的scDART-seq显示了单细胞m6A检测的能力,为研究单细胞水平的外源性转录调控开辟了新的途径。
该研究开发了一种不含外源基因表达的单细胞m6A测序(scm6A-seq)方法。scm6A-seq结合了RNA多重标记技术原理和甲基化RNA免疫沉淀测序(MeRIP-seq/m6A-IP),能够捕捉转录组范围内的m6A序列,并比较单细胞间的m6A水平。利用scm6A-seq,该研究检测了小鼠卵母细胞和早期胚胎的m6A修饰。总之,该研究结果揭示了在卵母细胞发育和ZGA期间,m6A在单细胞分辨率下对RNA代谢的动态调控。
原文链接:
https://www.nature.com/articles/s41467-023-35958-7


