重磅综述:肿瘤微环境
时间:2023-08-17 19:36:48 热度:37.1℃ 作者:网络
在过去的几十年里,我们对癌症的理解发生了根本性的变化。随着人类对肿瘤的认识在不断深入,我们现在认识到,癌症不仅仅是一种疾病,而是一个复杂的生态系统。
肿瘤是肿瘤细胞和周围的正常细胞、以及各种免疫细胞(如淋巴细胞,单核巨噬细胞等)等在不断斗争、互相适应进化的。如果把肿瘤的相关特征汇总到一起的话,微环境这个词来表示是在是太符合了。
肿瘤微环境(TME)包括多种免疫细胞类型、癌相关成纤维细胞、内皮细胞、周细胞和各种其他组织驻留细胞类型。这些宿主细胞曾被认为是肿瘤发生的旁观者,但现在已知在癌症的发病机制中发挥关键作用。TME的细胞组成和功能状态可能会因肿瘤发生的器官、癌症细胞的固有特征、肿瘤分期和患者特征而大不相同。
肿瘤也有“冷”和“热”之分。“冷”肿瘤:也被称为免疫细胞抑制型肿瘤,其特点是肿瘤内部及周围T细胞浸润少。“热”肿瘤:也被称为免疫细胞浸润型肿瘤,其特点是:T细胞在肿瘤周围及内部大量浸润。因此,了解疾病进展的肿瘤细胞内在、细胞外在和系统介质之间复杂的相互作用对于合理开发有效的抗癌治疗至关重要。
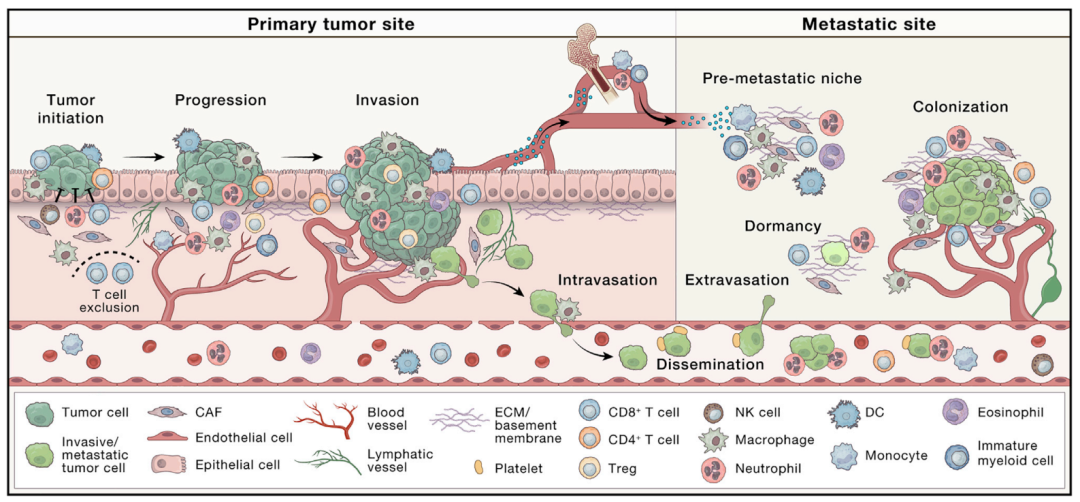
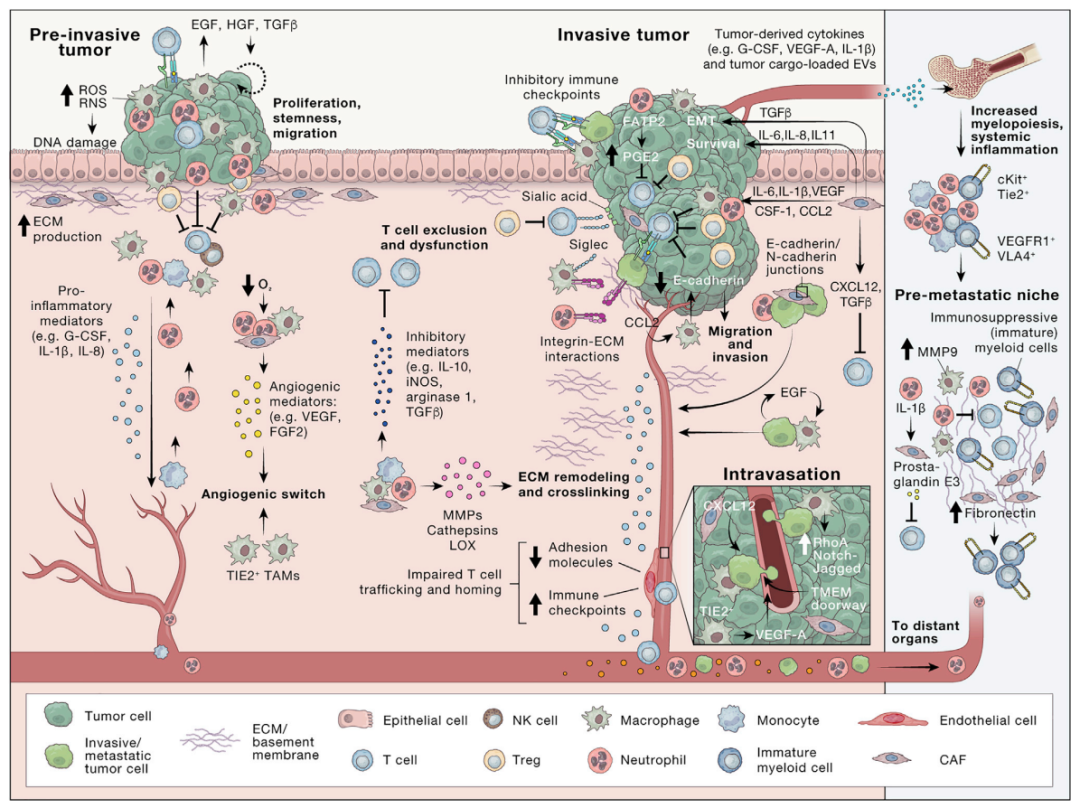
2023年3月13日,荷兰癌症研究所Karin E. de Visser和瑞士Lugwig癌症研究所Johanna A. Joyce在Cancer Cell发表综述文章The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth,回顾了 TME 在癌症进展的每个阶段的重要性,包括肿瘤起始、进展、侵袭和内渗到转移扩散和生长。
-01-
TME的主要细胞和非细胞成分
肿瘤微环境(TME)是一个高度结构化的生态系统。TME包括多种免疫细胞、肿瘤相关的成纤维细胞(CAFs)、内皮细胞和细胞外基质(ECM)等。这些成分可能因组织类型而异,并随着肿瘤的进展而共同进化。
TME中的各种细胞可以是肿瘤抑制性的,也可以是肿瘤支持性的。
(1)免疫细胞
✔ 适应性免疫细胞

✔ 髓系免疫细胞

✔ 适应性和先天性免疫细胞

(2)基质细胞和基质

(3)血管细胞

-02-
TME形成的基本原理
癌细胞通过招募和重编程非癌宿主细胞以及通过重塑血管系统和细胞外基质,来协调一个支持肿瘤的环境。这一动态过程依赖于癌细胞和TME的常驻或招募的非癌细胞之间的异型相互作用。
TME中有多种机制可以调节这种细胞间对话,包括通过细胞间接触和旁分泌信号传导。
✔ 接触依赖性通讯由粘附分子介导,包括整合素、钙粘蛋白、选择素和免疫球蛋白超家族成员,也通过间隙连接和隧道式纳米管介导。
✔ 除了直接的细胞-细胞接触外,通过释放细胞因子、趋化因子、生长因子和蛋白酶的旁分泌信号传导对TME内的细胞间通讯也至关重要。
ECM(细胞外基质)通过充当分泌分子的基质和细胞粘附和迁移的底物来促进细胞间通信,从而形成癌症中复杂的信号网络。
-03-
临床经验教训
CAR-T细胞治疗,让一些患者实现了长达十年的有效治疗。NK 细胞具有独特的抗肿瘤效应,不受MHC限制的细胞毒性、产生细胞因子和免疫记忆等功能,使其成为先天性和适应性免疫反应系统中的关键角色。早期临床数据表明:NK细胞非常适合用于异体治疗环境。虽然安全性结果令人鼓舞,但还需要进一步研究以阐明同种异体NK细胞是否能够逃避T细胞的排斥反应以获得长期持久性。
无论如何,CAR-NK 细胞疗法是一个很有前途的临床研究领域,对某些癌症患者具有良好的安全性和初步疗效。相信,CAR-NK细胞疗法可能会导致肿瘤免疫治疗的革命性进展。
参考资料:
[1] Laskowski, T.J., Biederstädt, A. & Rezvani, K. Natural killer cells in antitumour adoptive cell immunotherapy.Nat Rev Cancer (2022).
[2] Maskalenko et al., Harnessing natural killer cells for cancer immunotherapy: dispatching the first responders. Nature Reviews Drug Discovery, (2022).
[3] Le Saux and Schvartzman Advanced Materials and Devices for the Regulation and Study of NK Cells. Int. J. Mol. Sci., (2019).
[4] Zhang et al.,. CAR-NK cells for cancer immunotherapy: from bench to bedside. Biomarker Research,(2022)


